Application Note iPSC由来ヒト神経細胞を用いた
神経細胞毒性のハイコンテントスクリーニング
- 真に自動化された取得と解析で、セットアップと立ち去りが可能
- 各ニューロンの複数の表現型特徴を即座に定量化
- 生細胞の毒性を数分から数日間リアルタイムでモニタリング
PDF版(英語)
はじめに
神経系は、多くの化学化合物、環境物質、および特定の天然物質の毒性に敏感である。神経毒性は、脊髄損傷、脳卒中、外傷性脳損傷などの病理学的過程において、脳や末梢神経系に一時的または永続的な損傷を引き起こす可能性がある。また、アルツハイマー病やパーキンソン病などの神経変性疾患の主な原因でもある。
ヒト由来の人工多能性幹細胞(iPS細胞)を用いたハイコンテントイメージングは、医薬品候補や環境混入物質の神経栄養、神経保護、神経毒性効果を調べるために応用できる。このノートでは、iPSCとMolecular Devicesのシステムおよびソフトウェアを用いた自動エンドポイントアッセイおよびライブセルアッセイによる神経細胞毒性スクリーニングについて説明します。
iPSCベースの毒性スクリーニング
iPSCは成熟神経細胞の機能性と挙動を示し、大量に入手できるため、神経細胞毒性研究に非常に有用です。この生物学の関連性の高い細胞型とハイコンテント画像および解析との組み合わせにより、神経毒性アッセイはリード化合物のスクリーニングに有用であり、前臨床開発コストと動物実験の必要性を削減できる可能性がある。紹介するアッセイの例は、Cellular Dynamics International社の完全分化ヒトiPSC由来iCell Neuronsを用いて開発された。
神経細胞ネットワークの完全性の定量化
ハイコンテント解析は、神経突起伸長に対するプラス因子とマイナス因子の影響を定量的に決定する方法を提供する(図1)。iPSC由来ニューロンを96ウェルあるいは384ウェルプレートで3~5日間神経細胞ネットワークを形成させた後、48~72時間毒性化合物を作用させた。神経細胞ネットワークは、ImageXpress® Microシステム上でβ-チューブリンに対する標識抗体を用いて可視化した。画像解析はMetaXpress® ハイコンテント画像取得・解析ソフトウェアのNeurite Outgrowthアプリケーションモジュールを用いて行い、データ解析はAcuityXpress™ ハイコンテントインフォマティクスソフトウェアを用いて行った。
神経突起伸長アプリケーションモジュールは、核のカウンターステインの有無にかかわらずセルボディを検出し、セルボディの存在によって陽性神経細胞を決定し、それらの細胞から伸長する蛍光標識神経突起を同定する。神経突起の数、アウトグロースの長さ、細胞ごとまたはフィールドごとの枝の数など、いくつかのパラメータが神経細胞ネットワークを特徴付ける。そして、各ウェル中の細胞の数と表現型に関する統計を計算することができる。
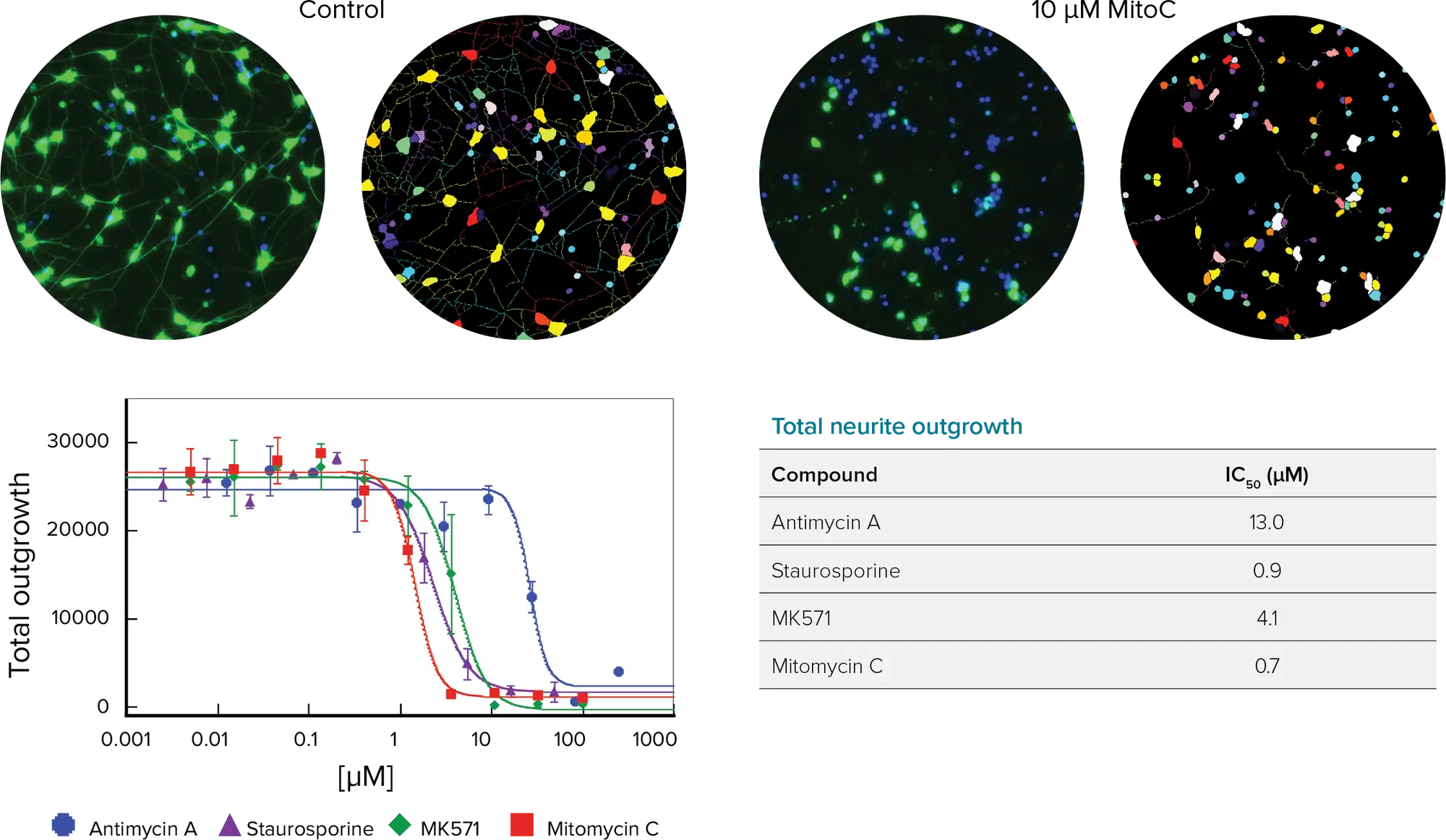
図 1. 神経突起伸長アプリケーションモジュールの結果。左上: 神経突起伸長モジュールの画像解析マスクのある対照ウェルと高用量ウェル。核(青)とβチューブリンIII(緑)で標識された神経突起。右上: 全アウトグロースに対する細胞毒性化合物の用量反応曲線。下: 全アウトグロース曲線から算出したIC50値。
ミトコンドリア膜電位の評価
ミトコンドリアの偏光解消は低酸素障害や細胞毒性の初期徴候であることが示されており、ミトコンドリア膜電位はJC-10色素を用いてモニターすることができる(図2)。健康なセルでは、JC-10はオレンジ色のJ会合体としてミトコンドリアに蓄積する。内膜電位が失われると、JC-10の単量体は細胞質に放出され、そこで緑色に蛍光を発する。
ニューロンをJC-10で染色し、酸化的呼吸の阻害とCa2+の過負荷を引き起こす化合物であるアンチマイシンAまたはバリノマイシンに30分間暴露した。MetaXpress®ソフトウェアのGranularity Moduleは、バックグラウンド以上の強度と粒状体のサイズに基づいてミトコンドリアを同定するようにカスタマイズできる。結果は視野内のセル数で正規化した。
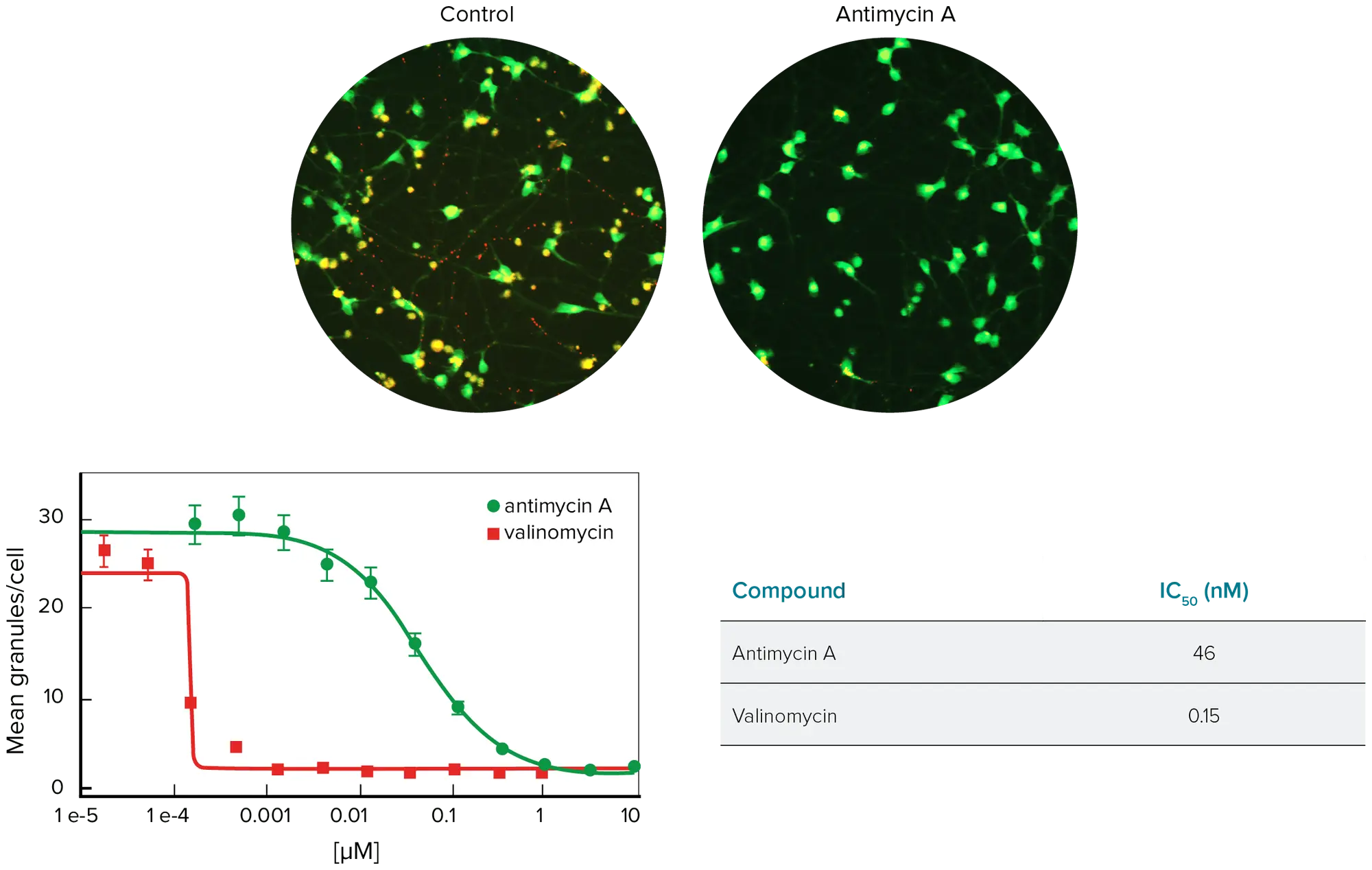
図2. 上:コントロールの神経細胞とアンチマイシンAで処理しJC-10で染色した神経細胞の画像。対物レンズ20倍で撮影。下: 細胞あたりの平均総ミトコンドリア/顆粒で測定した用量反応。
生細胞毒性のモニタリング
毒性アッセイは、生存率色素であるカルセインAMとHoechst核染色を組み合わせて生細胞で行うことができる。プレートの温度、CO2、湿度レベルを維持する環境制御を備えたImageXpress Microシステムを用いて、多くの既知の神経毒性および非毒性化合物を試験した(図3)。これらの化合物で観察された神経毒性活性は、in vivoまたは臨床データと相関しており、このアッセイが神経毒性予測に使用できる可能性が確認された。
カルセインAMは生きたニューロンの細胞体に加えて神経突起伸長部も染色するため、神経突起伸長アプリケーション・モジュールを用いて神経細胞ネットワークを解析し、カルセインAM染色とセル・スコアリング・アプリケーション・モジュールを用いた核の大きさの両方で、生きているニューロンと死んでいるニューロンを同定した。
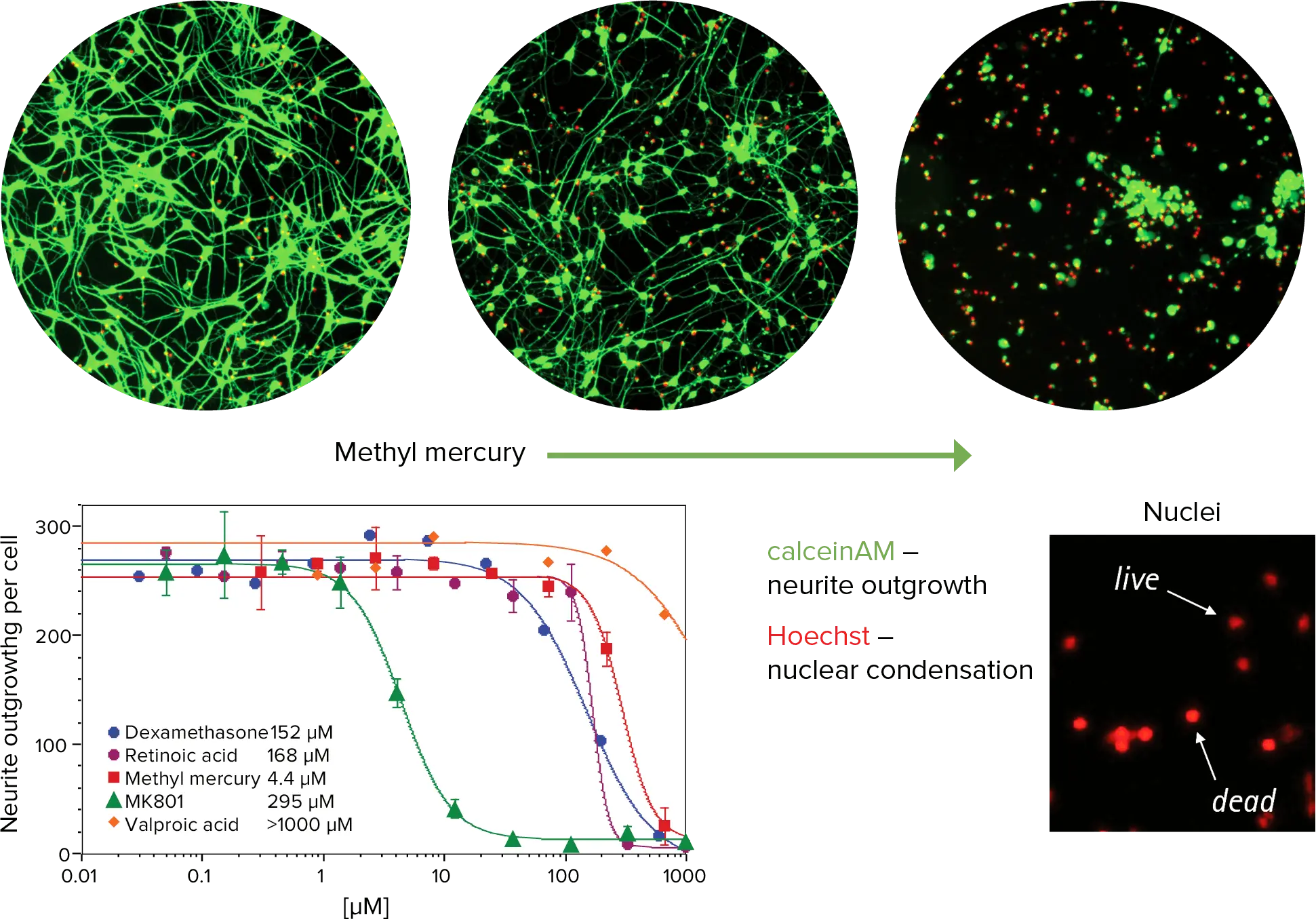
図3. 神経細胞に対するメチル水銀の影響。上:神経細胞に対するメチル水銀の用量依存的毒性効果を示す画像。カルセインAMの存在は生細胞の代謝を示す(緑)。左下: 神経突起伸長による細胞毒性化合物のIC50曲線と核の大きさによる細胞毒性評価。右下:Hoechst染色した核は赤色に擬似着色されている。
神経細胞毒性スクリーニングのための完全なソリューション
モレキュラーデバイスは、ImageXpress Microシステム、MetaXpress®ソフトウェア、AcuityXpressソフトウェアにより、スクリーニング環境における神経細胞毒性評価のための完全なソリューションを提供します。当社のライブセルオプションと洗練された表現型画像解析の組み合わせにより、医薬品開発の初期段階での毒性化合物の同定が可能になります。
PDF版(英語)