Application Note ハイスループット細胞遊走アッセイ
PDF版(英語)
はじめに

細胞遊走の生物学には、細胞の細胞骨格の変化、ひいては重要な生物学的機能につながる複雑なタンパク質シグナル伝達機構が関与している。細胞遊走を測定するアッセイ法は、そのメカニズムをより詳細に理解することを可能にし、創薬や治療法の発見に重要である。化学誘引物質非存在下での細胞遊走を測定するためによく使われる方法のひとつに、創傷治癒アッセイがある。このアッセイは、傷のついた細胞単層で行われるが、ハイスループットでこのアッセイを行うには多くの課題がある。Lin研究室(Genentech)は、PC-3細胞株の細胞遊走が特異性薬剤やshRNA遺伝子ノックダウン処理によって阻害されることを実証した。ここでは、ImageXpress Velosシステム-DL™(Blueshift Biotechnologies Inc.)レーザースキャニングプラットフォームとOris™セル遊走アッセイキット(Platypus Technologies)の組み合わせについて報告する。キットのウェルフォーマットは96ウェルプレートで構成され、各ウェルの中央で播種細胞の接着をブロックするシリコン製ストッパーの存在下、細胞単層が環状パターンで形成される。ストッパーを取り除いた後、蛍光検出のために細胞を標識する生細胞蛍光剤カルセイン-AM(Invitrogen社製)を用いて、それまでブロックされていた領域への細胞の遊走を測定する。ImageXpress Velosシステムはウェル全体をスキャンするため、ウェル中央の直径2mmの均一な未シード(ブロック)領域内の細胞遊走を迅速に測定するのに理想的である。その結果、統合された画像取得と画像解析プロセスにより、shRNAや薬剤効果の検出に必要な感度を備えた、シンプルでロバストかつハイスループットな細胞遊走アッセイが可能になったことが実証された。
アッセイ手順
細胞遊走アッセイ。Oris™ Cell Migration Assay kit(Platypus Technologies社)を用いた細胞遊走アッセイは、Kui Lin氏の研究室(Genentech社)と共同で、細胞遊走のためのPC-3細胞モデル系を用いて行われた。簡単に言うと、細胞を15,000個/ウェルで播種し、細胞単層を形成させた。細胞播種のストッパーを各ウェルから外し、細胞をPBSで1回洗浄して接着していない細胞を取り除いた。培地および/または薬剤を加え、細胞を24時間培養した。PBSで調製したカルセイン-AM溶液(最終濃度0.5μM)を加え、ImageXpress Velosシステムでの蛍光イメージングのために細胞を標識した。
細胞遊走の蛍光イメージャー。このデモに使用されたImageXpress Velosシステム-DLレーザースキャニングプラットフォームは、20mWの488nmレーザーで構成された。488nmレーザーは、チャンネル1(Ch1)の510-540nmバンドパス(bp)フィルターを用いて、カルセイン標識細胞の検出に使用された。画像取得は5×5ミクロンサンプリングで行われ、96ウェルプレート全体がスキャンされた。
結果と考察
細胞遊走イメージングと結果
オリス™ セル遊走アッセイは96ウェル黒壁プレートにフォー マットされ、医療グレードのシリコン製ストッパーを用い て、細胞プレーティングをウェルの環状領域に制限してい ます。ストッパーを外すと、各ウェルに直径2 mmの未播種領域があり、そこに播種細胞が遊走します(図1参照)。オリス™ セル遊走アッセイの図を図2に示す(Platypus Technologies社提供)。

コントロール 2 (C05) shRNA2 - DOX (C09) shRNA2 + DOX (C10) 図 1. shRNA処理と遊走なしコントロールの細胞遊走アッセイイメージ。2mm のストッパーは細胞芝生にきれいなエッジを残すが、ストッパーを外すと未播種領域にアーチファクトが観察される。DOX無添加のshRNA2処理(C09)では、播種していない領域への細胞の遊走と、より重い細胞増殖が認められた。対照的に、shRNA2を用いたDOX処理(C10)では、細胞の遊走と増殖の両方が阻害された。黄色の円は直径2.5mmの関心領域(ROI)に相当する。各画像の直径2.1mmのROI内の全ての分類対物について、面積カバー率(セル面積/ROI面積×100)を画像上に示す(白字)。
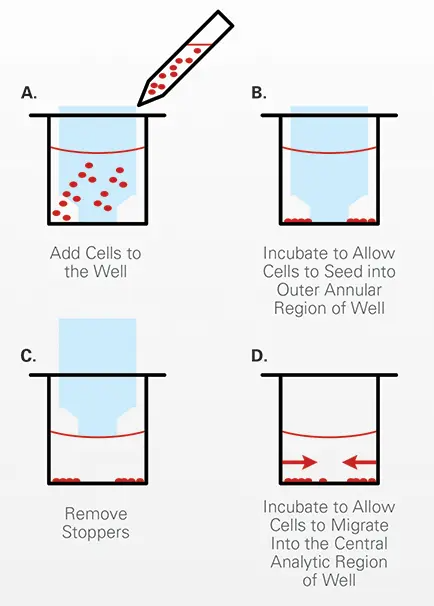
図2. オリス™ セル遊走アッセイ手順の図解。
Oris™細胞遊走アッセイ手順。細胞を様々な薬剤で24時間処理し、生細胞蛍光剤カルセイン-AMで染色した。細胞の遊走は、ImageXpress Velosシステムレーザースキャンプラットフォームを用いて各ウェルの表面全体を画像化することにより観察した。カルセイン-AM標識細胞からの緑色蛍光は、510-540nmのbpフィルターを用いた単一検出チャンネル(Ch1)を用いて取得した。このアッセイで使用した条件では、96ウェルプレート全体を5分以内でスキャンし、分析することができる。
カルセイン標識細胞のホールウェルイメージを図1に示す。細胞遊走のないコントロール試料(コントロール2)は、カルセイン標識の直前にストッパーを外して得た。これらのコントロールウェルの播種していない領域には、公称量のセルが観察される(図1のウェルC05の画像を参照)。すべての画像は、直径2.1mmのROIと細胞より小さな対物を除去するエリアフィルターを用いて、統合画像解析プログラムで処理した。各画像のROI内の分類された対物レンズの面積カバー率(セル面積/ROI面積×100)を画像上に示した(白字)。
細胞の遊走に対する様々なshRNA処理の効果のイメージングも図1に示す。shRNAを処理したウェルとコントロールのウェルとの間に違いが観察された。Oris™ Cell Migration Assayを用い、ドキシサイクリン(DOX)存在下でPC-3細胞の遊走を阻害するshRNA2の能力が、図1のC10に示されるように示された。遊走の阻害(C10)は、染色直前の試験エンドツーエンドでストッパーを除去した対照ウェルで観察された遊走前画像(C05)と類似している。対照的に、PC-3細胞は、DOXで誘導せずにshRNA2で処理した場合、遊走することができた(C09)。これらの予備的結果は、ImageXpress Velosシステム-DLが96ウェルプレートの新規細胞遊走アッセイからデータ解析のための画像を正常に取り込む能力を示しており、OrisフォーマットにおけるこのshRNAスクリーニングシステムのさらなる最適化を保証するものである。最適化には、播種していない領域の細胞バックグラウンドの除去、播種細胞の等しい最適な開始密度、最適な細胞遊走のためのインキュベーション時間の最適化などの方法の開発が含まれる。
結論
ImageXpress Velosシステムは、Oris™ Cell Migration Assayのための高速でシンプルな画像取得と解析プロセスを提供します。
- 96ウェルプレートからのホールウェル画像を5分未満で取得
- 統合された画像解析により、総細胞面積とカバー率を決定
- ホールウェルイメージングは、プレートリーダーと比較して、ハイコンテントとアッセイ感度が得られます。
- プレートセットアップとサンプル操作がシンプルで簡単
- 現在96ウェルフォーマットで利用可能
このプラットフォームのユニークな光学系とスキャニング・エンジンにより、シンプルな「プラグ・アンド・プレイ」アプリケーションが可能になり、学術界と産業界の両方でライフサイエンス研究者のニーズに応えることができる。
PDF版(英語)