Application Note マイクロ流路プラットフォームにおける神経細胞と
グリアの3Dネットワーク上でのハイスループット化合物評価
PDF版(英語)
著者一覧
Nienke R. Wevers1,2、Remko van Vught1、Karlijn J. Wilschut1、Arnaud Nicolas1,3、Chiwan Chiang1、Henriette L. Lanz1、Sebastiaan J. Trietsch1、Jos Joore1、Paul Vulto1,3
in vitro脳モデリング分野の大きな進歩に伴い、これらの技術を新薬候補の開発や評価に応用することが課題となっている。ここでは、マイクロ流路プラットフォームで、自発的に活動する神経細胞とそれを支持するグリア細胞の3次元ネットワークを培養する方法を実証する。このプラットフォームはハイスループットであり、あらゆる標準的な実験装置と互換性があるため、化合物の効果を並行して評価することができる。
中枢神経系(CNS)疾患の有病率は増加傾向にあるが、一般的な疾患のほとんどにおいて、疾患メカニズムの理解はまだ非常に限られており、その結果、効果的な治療法が確立されていない。長い間、ヒト脳の生理学的に適切なin vitroモデルが存在しないことが、新薬候補の開発における大きなボトルネックとなっていた。しかし、人工多能性幹細胞(iPSC)技術とそれに伴う分化プロトコルが利用できるようになって以来、この分野は大きく進歩した1,2。現在のプロトコールでは、無数の神経細胞サブタイプ3-7、グリア細胞8-10、内皮11など、ヒト脳のほぼすべての細胞サブタイプへの分化が可能である。
これと並行して、発生生物学の分野では、幹細胞、分化細胞、細胞外マトリックス(ECM)のin vivoでの3D(3次元)組織化をin vitroで培養したオルガノイドで捉えることに大きな進歩があった12-14。最近では、ECMに包埋されたiPSC由来の神経幹細胞が、いくつかの異なる脳領域を含む新生児脳のさまざまな特徴を模倣した大脳オルガノイドへと発達することが示された15。この技術は、脳の発達や神経疾患の病因を研究するために急速に導入された16。
このように脳生理学を模倣する技術が飛躍的に進歩したことで、これらの技術をどのようにして日常的な環境で薬剤候補や化合物の評価に用いるかという疑問が投げかけられるようになった。化合物ライブラリーの有効性と毒性効果を評価できるシステムが必要である。このようなプラットフォームの重要な前提条件には、自動ハイコンテントイメージャー装置との互換性と、比較的高速な読み出しが含まれる。さらに、生理学的に適切な反応を得るために必要な範囲で、ヒトの脳の複雑さを模倣しながらも、データポイントごとに限られた量のセル材料を利用する必要がある。
ここでわれわれは、マイクロ流路プラットフォーム(OrganoPlate®)で、ECM包埋神経細胞-グリア細胞ネットワークを3次元培養する方法を実証する。OrganoPlate®は96個の組織チップからなるマイクロタイタープレート形式で、3D細胞培養、共培養、非侵襲的な培地交換に使用できる17。ヒトiPSC由来の神経幹細胞や、様々な供給源から得られたiPSC由来の成熟ニューロンやアストロサイトがマトリゲル®と混合され、このマイクロ流体チップに播種される。セルはチップ内で3Dネットワークを形成し、様々な免疫蛍光染色を用いて特性評価される。ネットワーク内のニューロンの電気生理学的活性、神経突起伸長の程度、化合物処理に対する細胞の生存率を評価することにより、様々な化合物の潜在的神経毒性作用が研究された。
結果
プラットフォーム 図1にOrganoPlate® プラットフォームを示す。これは384ウェル・マイクロタイター・プレートフォーマットをベースとし、光学的アクセス用にカバースリップ厚のガラス(175μm)を採用している。プレートは96個のマイクロ流体組織チップで構成され、各チップを用いて小型化組織モデルを構築することができる17-19。各チップは隣接する4つのウェルに接続している。1つのウェルは細胞/ECM混合液の投与に、2つのウェルは増殖培地の供給に、そして4つ目のウェルは細胞イメージングに使用される(図1a)。細胞/ECM混合液は、フェイズガイドと呼ばれる毛細管圧バリア20 を用いて、組織チップのゲル流路にパターニングされる。ゲル化すると、隣接するチャンネルは増殖培地で満たされ、栄養、ガス、老廃物の交換が妨げられなくなる(図1b)。培地の流入口と流出口は、培地をリフレッシュしたり、化合物や染色試薬をセルに投与したりするのに使うことができる。
ヒト脳のin vitroモデルを可能にするため、われわれはiPSC由来の神経細胞とグリア細胞の3D ECM包埋ネットワーク形成のための培養条件を最適化した。様々な分化段階にある様々な種類の神経細胞を用いて、このプラットフォームと神経細胞培養との適合性を評価し、その応用の可能性を探った。神経幹細胞と初期分化細胞は、長期的な3D神経分化の可能性を評価するために使用された。OrganoPlate®に播種した時点ですでに終末分化状態にある他の細胞は、化合物スクリーニングなどの応用に便利な短期培養の選択肢を評価するために使用した。本研究で使用した様々な細胞タイプの概要を表1に示す。
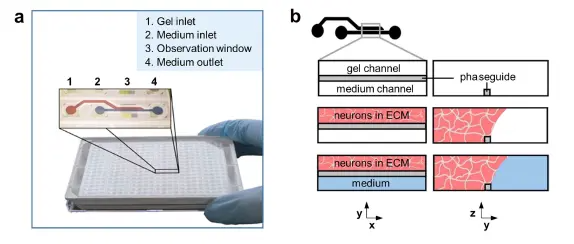
図1. OrganoPlate®に神経細胞とグリアを播種する。(a)OrganoPlate®の写真。OrganoPlate®は384ウェルプレートをベースにしており、合計96個のマイクロ流体組織チップで構成されている。各チップは、マイクロ流路で連結されたゲル注入口(1)、培地注入口(2)、観察窓(3)、培地排出口(4)の4つのウェルで構成されている。(b)3次元神経-グリアネットワーク培養の実験概要: 細胞は細胞外マトリックス溶液(ピンク色)と混合され、ゲル注入口ウェル(1)にピペッティングすることでゲル流路に播種される。フェイズガイドは、ゲルをゲル流路に制限する毛細管圧バリアである。ゲル化後、細胞培養メデューム(青色)をメデューム注入口と排出 口ウェルに加え、メデュームチャンネルを満たし、メンブレン フリーで栄養、代謝産物、ガスの直接交換を可能にする。
| 名前 | サプライヤー | 特徴 |
|---|---|---|
| アクソール神経幹細胞 | アクソルバイオサイエンス | ハンガントン病患者由来のヒトiPSC由来神経幹細胞。約6週間の分化期間を要する。 |
| ヒップ ™ ニューロン |
アムスビオ | 健常人由来のヒトiPSC由来初期分化ニューロンおよびアストロサイト。約5週間の分化期間を要する。 |
|
ドーパ.4U ™ |
アクシオジェネシス | 健常人由来のヒトiPSC由来終末分化ニューロン。これらのニューロンの亜集団はドーパミン作動性である。 |
| iCell ® ニューロン |
セルラー・ダイナミクス・インターナショナル | 健常人由来のヒトiPSC由来終末分化ニューロン。このニューロンは主にGABA作動性およびグルタミン酸作動性である。 |
| iCell ® アストロサイト |
セルラー・ダイナミクス・インターナショナル | 健常人由来のヒトiPSC由来アストロサイト。 |
表1. 本研究で使用したiPSC由来細胞の概要と特徴。
三次元ネットワークの迅速な形成 神経幹細胞、初期分化細胞、あるいはアストロサイトを含まない成熟ニューロンをマトリゲル®と混合し、オルガノプレート®のゲルチャンネルに播種した。セルはECM内で急速にネットワークを形成し、神経細胞の形態を示した。これは図2aに可視化されており、終末分化したドーパミン作動性Dopa.4U™ニューロンの経時的ネットワーク形成を示している。培養物は播種後の異なる時点で固定し、神経細胞マーカーβ3-チューブリンを染色した。神経突起伸長は、時点ゼロからの相対値で定量化され、急速なネットワーク形成を示した(図2b)。ネットワークの3次元的性質は共焦点イメージングによって確認された(図2cおよび補足ビデオ1)。同様のネットワーク形成は、終末分化したニューロンとグリアの共培養(iCell®ニューロンとアストロサイト、補足ビデオ2)でも観察された。
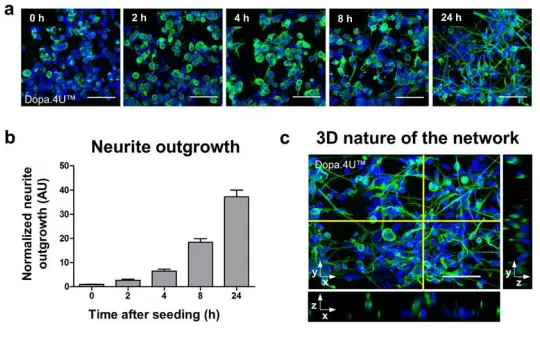
図2. 三次元ネットワークの形成 (a) ECM溶液と混合したDopa.4U™ニューロン(Axiogenesis)を組織チップに播種し、ネットワークを形成させた。異なる時点(播種後0、2、4、8、24時間)でセルを固定し、β3-チューブリンとDNA(DraQ5)染色によってネットワークと核を可視化した。スケールバー: 50 μm。(b) 時間経過に伴う神経突起伸長の定量化(時点t = 0時間で正規化)(平均±SEM、代表的な単一培養チップの200-400セルに基づくSEM)。(c) β3-チューブリンとDraQ5で染色したオルガノプレート®内のDopa.4U™ニューロン培養(1日目)の最大投影像。右と下の画像は、選択したプレーンの直交図を示す。
OrganoPlate®は、様々な神経細胞とグリア細胞のサブタイプの培養をサポートする。ヒトの脳は、様々なタイプのニューロンやグリア細胞を含む無数の細胞タイプから構成されている。本研究では、当社の3DシステムがiPSC由来のグルタミン酸作動性、GABA作動性、ドーパミン作動性ニューロンの培養に対応しているかどうかを調べた。さらに、ヒトの脳の複雑さをさらに模倣するために、終末分化したiPSC由来のアストロサイトを使って、神経細胞とグリア細胞の共培養を確立した。図3aは、培養2週間後のiCell®ニューロンとアストロサイトの混合集団を示している。この二つの細胞タイプは、β3-チューブリン(ニューロン)とグリア線維酸性タンパク質(GFAP;アストロサイト)を明確に発現している。図3b-dは、Axol iPSC由来神経幹細胞をオルガノプレート®で6週間分化させた後の神経-グリアネットワークを示している。神経細胞マーカーであるβ3-チューブリンと、アストロサイトマーカーであるビメンチンとs100βの発現によって示されるように、神経細胞とアストロサイトの両方が混在した集団が得られた(図3b,c)。さらに、神経細胞集団はグルタミン酸作動性ニューロン(vGLUT)とGABA作動性ニューロン(vGAT)の両方から構成されており(図3d)、興奮性細胞と抑制性細胞の両方が存在することを示している。図3eは、終末分化したDopa.4U™ニューロン(β3-チューブリン)の免疫蛍光染色を示しており、そのサブセットはドーパミン合成の律速酵素であるチロシン水酸化酵素(TH)を発現している。
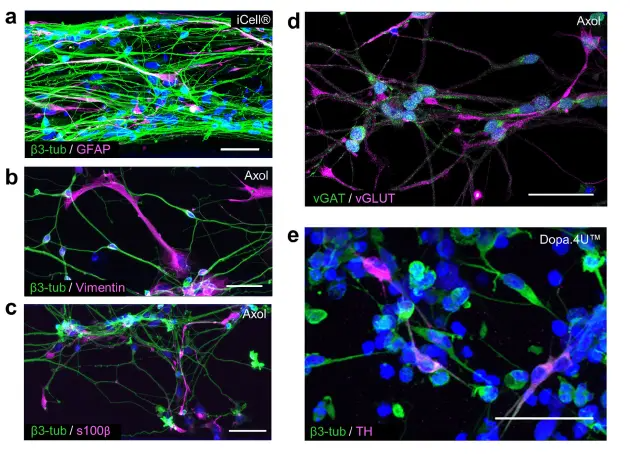
図3. OrganoPlate®は様々なタイプの大脳細胞の増殖と分化をサポートする。(a-c)免疫蛍光画像の最大投影により、ニューロンとアストロサイトの混合集団を示す。(a)14日目の成熟iCell®ニューロン(β3-チューブリン)とアストロサイト(GFAP)の共培養。(b,c)Axolハンチントン神経幹細胞は、OrganoPlate®で6週間培養後、ニューロン(β3-チューブリン)とアストロサイト(ビメンチン、s100β)に分化した。スケールバー: 50 μm。(d,e)免疫蛍光画像の最大投影は、異なる神経細胞サブタイプの存在を示す。(d)Axol神経幹細胞は、分化6週間後にグルタミン酸作動性(vGLUT)とGABA作動性(vGAT)の両方の神経細胞を示し、(e)5日目のDopa.4U™神経細胞はβ3-チューブリンとチロシン水酸化酵素(TH)で染色された。スケールバー: 50 μm。
神経細胞の自発発火。各細胞源における自発的な電気生理学的活動をカルシウムイメージングによって調べ、単一細胞およびネットワーク全体の神経細胞活動を調べることができた。カルシウム感受性の蛍光色素であるFluo-4 AMを細胞にロードし、高速蛍光イメージングを用いて細胞内カルシウム変動を経時的にモニターした(図4a-c)。終末分化したニューロン(Dopa.4U
™
とiCell
®
)、および3D分化神経細胞(Axol, HIP
™
)は自発的な電気生理学的活性を示した。各細胞源について、代表的な活性ニューロンを選択し、蛍光シグナルを経時的にプロットした(図4d-g)。
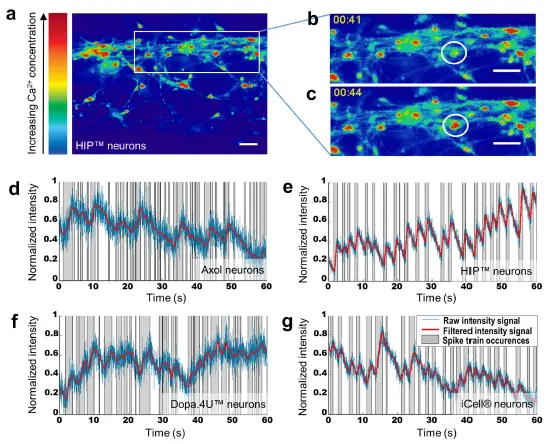
図4. カルシウムイメージングにより、試験したすべての細胞源で自発的な神経細胞活性が認められた: (a)オルガノプレート®で5週間分化させたHIPTMニューロンを示すカルシウムイメージングで得られた画像の例。色の暖かさは細胞内カルシウム濃度に対応する。(b,c)異なる時点(t = 41秒とt = 44秒)における1つのセルの細胞内カルシウム変動の例。スケールバー: 50 μm。(d-g)それぞれの細胞源から活性細胞を選び、その細胞内蛍光を経時的にプロットした。各細胞の蛍光強度を0と1の間でスケーリングし、それぞれその細胞の最低と最高の蛍光シグナルとし、ローパスフィルターで処理した。グラフは、ブリーチ補正後の生の強度信号(青)、フィルタリング後の信号(赤)、および異なるスパイクトレインを表す、局所最小値と局所最大値の間の活動領域(灰色)を示す。
3次元神経-グリアネットワークにおける化合物効果の評価。
電気生理学-ハイスループット化合物評価への3D培養の適用性を評価するため、電気生理学、神経突起伸長、および細胞生存能に対する化合物の影響を調べた。iCell®ニューロンをオルガノプレートに播種し、7日間培養した後、GABA(100μM)またはテトロドトキシン(TTX、1μM)に曝露した。GABAもTTXもiCell®ニューロンの発火を抑制したが、対照チップでは発火パターンに変化は見られなかった(図5b-d)。GABAは成熟した脳では主要な抑制性神経伝達物質であるが、神経細胞の発達期には興奮性に働く21,22。オルガノプレート®内の3D iCell®神経細胞培養物に対するGABAの抑制作用は、このネットワークが成熟した神経細胞集団で構成されていることを改めて示している。TTXはフグに含まれる強力な神経毒で、電位依存性ナトリウムチャネルを遮断し、活動電位の発火を抑制することが知られている23。
細胞生存能 - 次に、神経細胞とアストロサイトの共培養において、3種類の神経毒性化合物を様々な濃度で曝露した後の細胞生存率を評価した。同数のiCell® ニューロンとアストロサイトをマトリゲル® と混合し、オルガノプレート® で6日間培養した後、細胞を化合物に24時間暴露した。RealTime-Glo™細胞生存能アッセイを用いて、還元電位、ひいては細胞の生存率を測定した。試験した3種類の神経毒(メチル水銀24、エンドスルファン25、2,5-ヘキサンジオン26)はすべて、濃度依存的に細胞生存能を低下させた(図5e)。
神経突起伸長-さらに、化合物の毒性を検出するために、神経突起伸長を評価した。Dopa.4U™ニューロンをOrganoPlate®に播種し、24時間ネットワークを形成させた。続いてセルを、酸化ストレスを誘発することで知られる神経毒性化合物24であるメチル水銀の濃度範囲に曝露した。24時間暴露後、培養液を固定し、β3-チューブリン染色によって神経細胞ネットワークを可視化した。その結果、メチル水銀の濃度が高くなるにつれて、神経突起の平均長さが有意に減少することが観察された(図5f,g)。
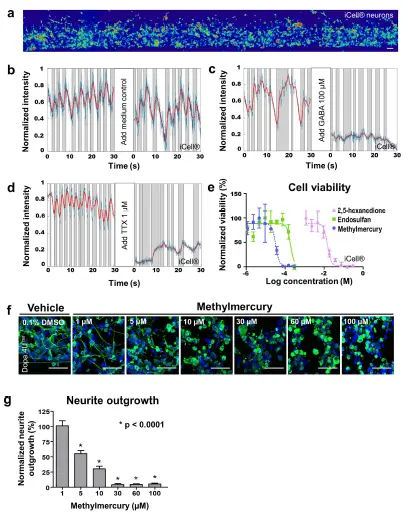
図5. 電気生理学、神経突起伸長、および細胞生存率に対する化合物の影響の検出。(a)化合物添加前後の電気生理学的活動を評価するために、iCell®ニューロンの完全なネットワーク(7日目)を撮影したカルシウムイメージング記録。色の濃さは細胞内カルシウム濃度に対応する。スケールバー: 50 μm。(b-d)グラフは、ブリーチ補正後の生の強度信号(青)、フィルタリング後の信号(赤)、および局所最小値と局所最大値の間の活動領域(灰色)を示し、異なるスパイクトレインを表す。GABA(100μM)またはTTX(1μM)の添加により、iCell®ニューロンの発火が抑制された(7日目)。(e)同数のiCell®ニューロンとiCell®アストロサイトをECM溶液中で混合し、OrganoPlate®に播種した。培養6日後、細胞を様々な濃度のメチル水銀、エンドスルファン、または2,5-ヘキサンジオンに24時間暴露した後、RealTime-GloTM assay(Promega社製)を用いて細胞生存能を評価した。細胞生存率をビヒクルコントロール(メチル水銀とエンドスルファンは0.3%DMSO、2,5-ヘキサンジオンは培地)と比較してプロットした(平均±SD、n = 3)。(f) Dopa.4UTMニューロンをECM溶液に混ぜてOrganoPlate®に播種し、24時間ネットワークを形成させた後、様々な濃度のメチル水銀に24時間暴露した。細胞を固定し、β3-チューブリンとDraQ5で染色して神経突起と核を可視化し、共焦点顕微鏡でイメージングした。最大プロジェクション画像を示す。スケールバー: 50 μm。(g)メチル水銀に曝露したニューロンの神経突起伸長を定量したところ、濃度依存的な減少が認められた(平均±SEM、代表的な単一培養チップの200~400個のセルに基づくSEM、クラスカル・ワリス検定(非ガウス型データセット)および多重比較のためのダンのポストホック検定、*p < 0.0001)。
ディスカッション
本論文では、3D神経細胞-グリア細胞ネットワークの並行培養と試験の方法を紹介する。このネットワークはマイクロ流路で培養され、様々な市販のiPSC由来の神経細胞とアストロサイトで構成されている。分化、遺伝子発現、セル-細胞相互作用、細胞-マトリックス相互作用など、多くの重要な細胞プロセスや特性は、in vivoと比較して2次元の平面設定では異なるためである。このため、2次元細胞培養で得られた結果を生体へ外挿することは困難である27-30。3次元培養システムで培養されたニューロンは、2次元単層培養と比較して、神経突起伸長が長く、細胞の生存率が向上し、分化のパターンが異なることが観察されている31,32。
一方、現在の3D培養システムにはいくつかの欠点がある。現在の3D細胞培養システムや脳オルガノイドシステムは、拡散輸送の制限、播種条件の大きなばらつき、細胞播種、培地交換、染色、イメージングなどの複雑な手順に悩まされている30,33。ここで紹介するプラットフォームは、3D培養に伴う取り扱いや再現性の問題をほぼ解決している。96個の平行チップを同時に播種することで、ウェル間のばらつきが減少し、ポンプを必要としない使いやすいプラットフォームとなっている。小容量、マイクロ流体ゲル層状化、多孔性細胞外マトリックスの組み合わせは、拡散輸送の制限を防ぐ。このシステムでは流体の流れは積極的に誘導されないが、マルチリザーバー・マイクロ流路システムには最低限の流れが内在しており、拡散だけでなく細胞外マトリックスを介した間質流によって栄養供給と老廃代謝物の除去が行われる。さらに、培地が入ったリザーバーとマイクロ流路内の実際の培養容積が幾何学的に分離しているため、培地交換や化合物や染色試薬の添加が完全に非侵襲的であり、マイクロ流体空間への補充は、ピペッティングのステップではなく、リザーバー間の受動的なレベリングによって行われる。他のマイクロ流路培養システムと比較すると、提案されているプ ラットフォームは人工膜を完全に排除しており、ECM間質液と培地チャネ ルの交換を妨げない17,20。このプラットフォームがハイスループットであり、標準的 な実験装置との互換性があり、組織チップ1個あたりに必 要な細胞材料の量が限られていることから、さまざまな 濃度の化合物をさまざまな複製で評価できることは明らかで ある。さらに、このプラットフォームは自動化された環境でも容易に採用でき、より多くの化合物や条件のスクリーニングが可能である。
OrganoPlate®における神経細胞-グリア細胞培養の3D的性質は、あらゆる方向への細胞増殖とネットワーク形成を可能にし、細胞-マトリックス相互作用を可能にするため、従来の2D培養に比べて複雑性が増している。しかしながら、この研究で提示されたモデルは、ヒトの脳に存在する全てのセルタイプを網羅しているわけではない。希望する応用に応じ て、複雑性を増すために追加の細胞タイプをモデルに加える ことができる。オリゴデンドロサイトやミクログリアなど、他のグリア細胞タイプを追加して、CNS内の髄鞘形成や免疫プロセスを研究することができる。さらに、様々な疾患の患者から採取したiPSC由来細胞をOrganoPlate®内で分化させ、発生異常や疾患プロセスを研究することもできる。
もう一つの選択肢は、神経細胞-グリアネットワークに隣接する培地チャネルで脳微小血管周皮細胞や内皮細胞の容器を成長させ、血液脳関門(BBB)を模倣することである34。BBBは高度に特殊化されたバリアであり、中枢神経系の恒常的な環境を保証している。親水性化合物のCNSへの受動的拡散を制限することで、BBBはほとんどの薬物の脳への侵入を妨げている。したがって、BBBと同様にアストロサイトとニューロンからなるモデルは、薬剤候補の評価をさらに向上させる。これによって、脳内での化合物の効果だけでなく、そもそも化合物が脳に入る能力や、BBBの完全性に影響を及ぼすかどうかも評価できるようになる。
最後に、個別化医療は中枢神経系疾患の治療の未来を象徴している35。ほとんどの疾患は、患者ごとに異なる原因によって生じるため、これらの疾患をうまく治療するためには、オーダーメイドの治療が必要になると考えられる。iPSC技術を用いれば、1人の特異性患者の神経細胞-グリア細胞ネットワークを96個並行して培養することが可能であり、様々な化合物を試験して最適な治療法を評価することができる。
以上のことから、我々は、マイクロ流路プラットフォームにおいて、ニューロンおよびグリアの3Dネットワーク上で医薬品化合物のハイスループット評価を可能にする新規手法を開発した。様々な種類の細胞を用いて、このプラットフォームが、神経幹細胞や前駆細胞の長期分化や、定義された比率で混合可能な終末分化細胞の短期培養に適合することを示した。ネットワークはロバスト性と時間効率の高い方法で形成され、細胞播種後7日以内にアッセイを行うことができる。この3D ECM包埋ネットワークは、カルシウムイメージング、神経突起伸長、細胞生存率など、幅広いリアルタイムおよびエンドポイントアッセイとの適合性を示した。このプラットフォームの使いやすさと標準的な実験装置との互換性により、化合物のスクリーニングや評価を目的とした3D中枢神経系モデルの可能性が最大限に引き出された。最後に、患者由来のiPSCを用いることで、この方法は、中枢神経系の一般的な疾患の治療を改善するための個別化医療の選択に使用することができる。
方法
材料
以下の試薬は、Thermo Fisher Scientific社(米国マサチューセッツ州ウォルサム)から購入した:B-27®サプリメント50x、Fluo-4 AM細胞透過剤、ホルムアルデヒド37%、GlutaMAX™サプリメント、ヒト組換え上皮成長因子(EGF)、MEM非必須アミノ酸溶液100x、N-2サプリメント100x、リン酸緩衝生理食塩水1x(PBS)。以下の試薬はSigma-Aldrich(米国ミズーリ州セントルイス)から購入した:2,5-ヘキサンジオン、γ-アミノ酪酸(GABA)、ウシ血清アルブミン(BSA)、ジメチルスルホキシド(DMSO)、ダルベッコ変法イーグル培地(DMEM)、エンドスルファン、メチル水銀、ペニシリン-ストレプトマイシン溶液100倍、Triton™ X-100、TWEEN® 20。マトリゲル®はコーニング(米国ニューヨーク州コーニング)から購入した。子牛胎児血清(FCS)はATCC(米国バージニア州マナサス)から購入した。ヒト組換え型塩基性線維芽細胞増殖因子(bFGF)は、Peprotech社(米国ニュージャージー州ロッキーヒル)から購入した。Tetrodotoxin (TTX)はTocris Bioscience (Bristol, UK)から購入した。
セル培養
本研究では、市販されている4種類の神経細胞とグリア細胞の供給源を使用した。神経幹細胞(ハンチントン病患者由来)はAxol Bioscience社(英国ケンブリッジ)から、HIP™ニューロンはAMSBIO社(英国アビンドン)から、Dopa.4U™ニューロンはAxiogenesis社(ドイツケルン)から、iCell®ニューロンとアストロサイトはCellular Dynamics International社(米国ウィスコンシン州マディソン)から、それぞれ提供された。すべてのニューロン細胞タイプは、100U/mLペニシリンと100μg/mLストレプトミシンを添加した、供給元から提供された培地で培養した。iCell®アストロサイトは、15% FCS、2mM GlutaMAX™、1%非必須アミノ酸溶液、100U/mLペニシリン、100μg/mLストレプトマイシン、10μg/mL bFGFおよび10μg/mL EGFを添加したDMEM中で、マトリゲル®コートフラスコ(DMEM中80μg/mLマトリゲル®、37℃、5% CO2で15分間インキュベート)上で4継代培養した後、オルガノプレート®に播種した。神経細胞はすべて、解凍・遠心後すぐにOrganoPlate®に播種した。
**OrganoPlate®における神経細胞および神経-グリア細胞培養の播種と培養。**細胞を解凍し、製造元の指示に従ってスピンダウンした。遠心後、上清を吸引し、細胞を7 mg/mL Matrigel®(冷DMEMを用いて9.3 mg/mL Matrigel®ストックから希釈)に懸濁し、25,000個/μLの濃度にした。反復ピペット(Sartorius eLINE電子ピペット)を用いて、0.5-1μLの細胞懸濁液をOrganoPlate®(MIMETAS、オランダ)の各組織チップのゲルチャンネルに播種した。その後、OrganoPlate®をインキュベーター(37℃、5% CO2)に20分間入れ、マトリゲル®をゲル化させた。次に、50μLの培地(100U/mLのペニシリンと100μg/mLのストレプトマイシンを添加したものを供給元から提供)を培地注入口に加え、続いて50μLの培地を培地排出口に加え、OrganoPlate®をインキュベーターに戻した(図1bを参照)。半培地交換は週に2回行い、培地入口と出口ウェルから培地を半分ずつ吸引し、25μLの新しい培地を加えた。培養の進行と一貫性を評価するため、ImageXpress Micro XLS 顕微鏡(Molecular Devices, Sunnyvale, CA, USA)を用いて、OrganoPlate®の全96個の組織チップから位相差画像を週に2~3回撮影した。
免疫細胞化学
各ステップは、1チップに使用する手順と容量を記述している。プロトコールの各ステップでは、特に指定がない限り、チップのメデューム注入口とメデューム排出口の両方に50μLの溶液を加える。ゲル注入口はすべての手順で空のままにしておく。特に指定のない限り、すべての手順は室温(RT)で行う。各洗浄ステップは5分間である。メデュームをチップのメデューム注入口と排出口から吸引し、PBSと交換して5分間セルを洗浄した。PBSを吸引し、細胞をPBS中3.7%(v/v)ホルムアルデヒドで15分間固定した。固定液を吸引し、ウェルをPBSで3回、PBS中の4% FCS(v/v)で1回洗浄した。次に、細胞をPBS中0.3%(v/v)Triton X-100で10分間透過処理し、PBS中4%FCSで1回洗浄した。セルをPBS中2%(v/v)FCS、2%BSA(w/v)、0.1%(v/v)TWEEN® 20で45分間ブロックし、一次抗体溶液(チップあたり40μL;培地注入口10μL、培地排出口30μL)と共にRTで1時間、または4℃で一晩インキュベートした。以下の一次抗体をブロッキング液で希釈し、免疫細胞化学に用いた:β3-チューブリン(1:200、Abcam、AB78078)、β3-チューブリン(1:200、Abcam、AB18207)、GFAP(1: 200, Millipore, AB5804), Vimentin (1:20, Abcam, AB8978), S100β (1:100, Abcam, AB52642), vGLUT (1:1000, Abcam, AB72310), vGAT (1:750, Synaptic systems, 131011), and tyrosine hydroxylase (1:2000, Santa Cruz, H-196). ウェルをPBS中の4%FCSで3回洗浄し、その後40μLの二次抗体溶液を加えた(培地注入口に10μL、培地排出口に30μL)。以下の二次抗体を使用した: Alexa Fluor® goat-anti-mouse 488、Alexa Fluor® goat-anti-rabbit 488、Alexa Fluor® goat-anti-mouse 555、Alexa Fluor® goat-anti-rabbit 555(Thermo Fisher、ブロッキング液で1:250に希釈)。暗所で30分間インキュベートした後、ウェルをPBS中の4% FCSで3回、PBSで1回洗浄した。核を染色するためにDraQ5(Abcam、PBSで1:1000希釈、培地注入口10μL、培地排出口30μL)を加え、20分間インキュベートした。DraQ5溶液を吸引し、PBSで置換した。Leica TCS SP5共焦点顕微鏡(Leica, Wetzlar, Germany)を用いて、染色した細胞の高画質Z-スタック画像を取得した。
カルシウムイメージング
各ステップは、1チップに使用する手順と容量を記述している。プロトコールの各ステップでは、特に指定がない限り、チップのメデューム注入口とメデューム排出口の両方に50μLの溶液を加える。ゲル注入口は、すべての手順の間、空のままにしておく。Fluo-4 AM色素を用いたカルシウムイメージングにより、自発的な神経細胞活動を記録した。選択したウェルの培地を、培地中5μMのFluo-4 AM(最終濃度DMSOは0.1%)で置換し、RTで30分間インキュベートした。次に、Fluo-4溶液を色素を含まない調整培地と交換し、RTで15分間インキュベートした。蛍光シグナルの変化を検出するため、Leica AF6000顕微鏡を用いた高速蛍光イメージングを行った(倍率20倍、50Hz、ビニング2×2)。各細胞源について、数個の活性細胞を分析し、代表的な記録を選んで蛍光シグナルの経時変化をプロットした。カルシウムの記録は、Fijiのブリーチ補正プラグイン36 を使って光ブリーチングを補正した。選択された各細胞のシグナルは0から1の間でスケーリングされ、MATLAB®(2013bおよびSignal Processing Toolbox, The MathWorks Inc, Natick, MA, USA)のローパスフィルター(0.5Hzのバターワース、3次)を通して処理された。結果は、ブリーチ補正後の生の強度信号(青)、フィルタリング後の信号(赤)、および異なるスパイク列を表す局所最小値と局所最大値の間の活動領域(灰色)を示す(図4d-g)。
カルシウムイメージング化合物アッセイ
iCell®ニューロンは、上述のようにFluo-4 AMを負荷した。イメージング直前に、マイクロ流体チップに化合物を添加しても化合物が著しく希釈されないように、メデューム注入口と排出口のウェルからメデュームを吸引した。細胞への影響を避けるため、マイクロ流体チップ自体に残っているサブマイクロリットル容量の培地は吸引しなかった。自発活性は、ImageXpress Micro XLS-C コンフォーカルハイコンテントイメージングシステム(Molecular Devices社製、ワイドフィールドモード、倍率20倍、20Hz)を用いて30秒間記録した。画像取得を停止し、100μM GABAまたは1μM TTXを封じ込めた培地50μLを培地入口ウェルと出口ウェルに注意深くピペッティングした。30秒後に画像取得を再開し、化合物の効果を記録した。化合物添加前後の記録は、Fiji36 のブリーチ補正プラグインを使用して個別に補正した。この漂白補正プラグインは、全フレームの平均強度を各記録の最初のフレームに補正する。2回目の記録開始時(化合物条件から30秒後)の高度な白化を補正するため、2回目の記録の全フレームの平均強度に、両記録の平均強度の比率を乗じた。ブリーチ補正された記録は連結され、複数の細胞の蛍光シグナルを経時的にプロットするために、関心領域が手動で選択された。代表的な細胞のシグナルを上記のように処理し、プロットした(図5b-d)。
神経突起伸長
Dopa.4U™ニューロンを上述のようにOrganoPlate®に播種し、免疫細胞化学のセクションに記載した手順に従って、播種後の異なる時点(0、2、4、8、24時間)で固定した。ニューロンをβ3-チューブリンとDraQ5で染色して神経突起と核を可視化し、ライカTCS SP5共焦点顕微鏡で画像化した(図2a)。Molecular Devices社のMetaXpress®ソフトウェア(MetaXpress 6.1)の神経突起伸長アプリケーションを用いて、核のみおよび核とβ3-チューブリン染色の最大投影画像を解析した。セルまたは神経突起検出のエラーは手動で補正し、偽陽性の値はピクセル長0に置き換えた。グラフはGraphPad Prism 6(GraphPad Software, San Diego, CA, USA)を用いてプロットした(図2b)。
神経突起伸長に対する化合物の効果
上記のようにDopa.4U™ニューロンをOrganoPlate®に播種し、24時間ネットワークを形成させた。次に、細胞を完全Dopa.4U™培地中でメチル水銀またはビヒクルコントロール(0.3% DMSO, v/v)に24時間暴露した。その後、細胞を染色してイメージングし、神経突起伸長を上述のように解析した(図5f)。各条件における神経突起伸長は、ビヒクルコントロール(0.3%DMSO)に対して正規化した。グラフをプロットし、GraphPad Prism 6を用いて統計解析を行った。神経突起伸長データセット(非ガウス型)は、Kruskal-Wallis検定および多重比較のためのDunnのpost-hoc検定を用いて解析した(図5g)。
細胞生存率に対する化合物の影響
iCell®ニューロンとアストロサイトをOrganoPlate®に1:1の割合で播種し、6日間培養した後、細胞を神経毒性化合物の濃度範囲に24時間暴露した。メチル水銀とエンドスルファンには0.3% v/v DMSOを、2,5-ヘキサンジオンには培地を用いた。24時間後、細胞生存率を生物発光RealTime-GloTM MTアッセイ(Promega, Madison, WI, USA)を用いて、製造者の指示に従って評価した。発光シグナルは、Fluoroskan AscentTM Microplate Fluorometer(Thermo Scientific社製)を用いて5分ごとに測定した。各チップについて、培地入口、観察窓、培地出口を測定し、平均値を求めた。各条件につき3チップを使用し、GraphPad Prism 6を用いて各条件の正規化平均値と標準偏差をプロットした(図5e)。
参考文献
- マウス胚および成体線維芽細胞培養からの多能性幹細胞の誘導。セル 126, 663-76 (2006).
- ヒト成体線維芽細胞からの多能性幹細胞の誘導。セル 131, 861-72 (2007).
- Hu, B.-Y. & Zhang, S.-C. ヒト多能性幹細胞からの脊髄運動ニューロンの分化。Nat. Protoc. 4, 1295-304 (2009).
- Swistowski, A. et al. 定義された条件下で、ヒト人工多能性幹細胞から機能的ドーパミン作動性ニューロンを効率的に作製。Stem Cells 28, 1893-904 (2010).
- Shi, Y., Kirwan, P. & Livesey, F. J. ヒト多能性幹細胞から大脳皮質ニューロンおよび神経ネットワークへの誘導分化。Nat. Protoc. 7, 1836-46 (2012).
- Yu, D. X. et al. ヒト多能性幹細胞を用いた海馬神経新生のモデル化。Stem cell reports 2, 295-310 (2014).
- Erceg, S., Lukovic, D., Moreno-Manzano, V., Stojkovic, M. & Bhattacharya, S. S. ヒト多能性幹細胞からの小脳ニューロンの誘導。Curr. Stem Cell Biol. Stem Cell Biol. Chapter 1, Unit 1H.5 (2012).
- Krencik, R. & Zhang, S.-C. ヒト多能性幹細胞からの機能的アストログリアサブタイプの誘導分化。Nat. Protoc. 6, 1710-7 (2011).
- Wang, S. et al. ヒトiPSC由来オリゴデンドロサイト前駆細胞は骨髄化し、先天性低髄鞘症モデルマウスを救うことができる。セル幹細胞 12, 252-64 (2013).
- ヒト単球からの横紋ミクログリア様細胞の直接誘導:那須ハコラ病におけるダイナミックなミクログリア機能障害。Sci. Rep. 4, 4957 (2014).
- Lippmann, E. S. et al. ヒト多能性幹細胞からの血液脳関門内皮細胞の誘導。Nat. Biotechnol. 30, 783-91 (2012).
- Lgr5幹細胞は、間葉系ニッチを介さずに、in vitroで陰窩-絨毛構造を構築する。Nature 459, 262-5 (2009).
- Huch, M. et al. ヒト成体肝臓由来のゲノム安定二価幹細胞の長期培養。セル 160, 299-312 (2015).
- ヒトiPS細胞由来の腎臓オルガノイドは、複数の細胞系譜を封じ込め、ヒト腎発生をモデル化している。Nature 526, 564-8 (2015).
- Lancaster, M. A. et al. 大脳オルガノイドは、ヒトの脳発生と小頭症をモデル化する。Nature 501, 373-9 (2013).
- Garcez, P. P. et al. ジカウイルスは、ヒト神経球および脳オルガノイドの成長を阻害する。Science 352, 816-8 (2016).
- Trietsch, S. J., Israëls, G. D., Joore, J., Hankemeier, T. & Vulto, P. 成層3次元細胞培養用マイクロ流体タイタープレート。Lab Chip 13, 3548-54 (2013).
- 3Dマイクロ流体細胞培養における神経上皮幹細胞の機能的ドーパミン作動性ニューロンへの分化。Lab Chip 15, 2419-28 (2015).
- Jang, M., Neuzil, P., Volk, T., Manz, A. & Kleber, A. On-chip three-dimensional cell culture in phaseguides improves hepatocyte functions in vitro. Biomicrofluidics 9, 34113 (2015).
- Vulto, P. et al. Phaseguides: a paradigm shift in microfluidic priming and emptying. Lab Chip 11, 1596-602 (2011).
- 胚および新生児皮質スライスにおける興奮性GABA応答は、グラミシジン穿孔パッチ記録とカルシウムイメージングによって実証された。J. Neurosci. 16, 6414-23 (1996).
- Leinekugel, X. et al. GABAは新生児脳における主要な即効性興奮性伝達物質である。Adv. Neurol. 79, 189-201 (1999).
- Kiernan, M. C., Isbister, G. K., Lin, C. S.-Y., Burke, D. & Bostock, H. Acute tetrodotoxin-induced neurotoxicity after ingestion of puffer fish. Ann. Neurol. 57, 339-48 (2005).
- Yee, S. & Choi, B. H. メチル水銀中毒の神経毒性作用における酸化ストレス。Neurotoxicology 17, 17-26 (1996).
- Gant, D. B., Eldefrawi, M. E. & Eldefrawi, A. T. Cyclodiene insecticides inhibit GABAA receptor-regulated chloride transport. Toxicol. Appl. Pharmacol. 88, 313-21 (1987).
- 2,5-ヘキサンジオンとペルデウテリオ-2,5-ヘキサンジオンのラットにおける神経毒性とピロール形成能の比較。Toxicol. Appl. Pharmacol. 92, 75-85 (1988).
- 組織培養を二次元で行うか三次元で行うか、それが問題である。Stem Cells 11, 105-111 (1993).
- Cukierman, E., Pankov, R., Stevens, D. R. & Yamada, K. M. 細胞とマトリックスの接着を3次元に。Science 294, 1708-12 (2001).
- Pampaloni, F., Reynaud, E. G. & Stelzer, E. H. K. 第3の次元が細胞培養と生きた組織とのギャップを埋める。Nat. Rev. Mol. Cell Biol. 8, 839-45 (2007).
- Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E. & Solomon, F. D. P. 3次元細胞培養システム:利点と応用。J. Cell. Physiol. 230, 16-26 (2015).
- Peretz, H., Talpalar, A. E., Vago, R. & Baranes, D. Superior Survival and Durability of Neurons and Astrocytes on 3-Dimensional Aragonite Biomatrices. Tissue Eng. 13, 461-472 (2007).
- Zare-Mehrjardi, N. et al. 3次元ポリ(D, L-乳酸)スキャフォールド上での胚性幹細胞の神経細胞への分化と2次元培養の比較。Int. J. Artif. Organs 34, 1012-23 (2011).
- Kelava, I. & Lancaster, M. A. Dishing out mini-brains: 脳オルガノイド研究の現状と将来展望。Dev. Biol., 10.1016/j.ydbio.2016.06.037 (2016).
- Wevers, N. R. & de Vries, H. E. Morphogens and blood-brain barrier function in health and disease. Tissue barriers 4, 10.1080/21688370.2015.1090524 (2016).
- Schork, N. J. 個別化医療: 一人臨床試験の時。Nature 520, 609-11 (2015).
- Fiji:生物学の画像解析のためのオープンソースプラットフォーム。Nat. Methods 9, 676-82 (2012).
謝辞
本研究の一部は、NC3Rs(プロジェクト番号50308-372160)が資金提供するNeuratect CRACK-IT Challenge、および欧州連合(EU)の研究・イノベーションプログラム「Horizon 2020」の助成金協定第667375号、第668738号、第641639号の助成を受けたCoSTREAM、SysMedPD、BIOPOLコンソーシアムの支援を受けた。著者らは、ライデン大学分子細胞生物学部の顕微鏡設備を提供してくれたH.J. Tanke教授、画像取得を手伝ってくれたJ.C.A.G. WiegantとA.M.A. van der Laanに感謝する。R.H.S. Westerinkとそのチームには、神経毒性と電気生理学について助言をいただいた。また、Molecular Devices社のBen Haworth氏にはテクニカルサポートを、ライデン大学医療センター分子細胞イメージング科のS.H. Michel氏には貴重なテクニカルノートをいただいた。
著者の貢献
N.R.W.、R.V.、K.J.W.、C.C.、H.L.が実験を計画または実施した。A.N.とS.J.T.はカルシウムイメージングデータの定量化を設定した。N.R.W.、R.V.、P.V.は、全著者の意見を取り入れて本論文を執筆した。P.V.とJ.J.は、すべての面を監督した。
追加情報
本論文の補足情報はhttp://www.nature.com/srep。
競合する経済的利益: 著者は全員、オルガノプレート® を販売しているオランダのMIMETAS BV社の従業員である。
の従業員である。P.V.、J.J.、S.J.T.は同社の株主である。
この記事の引用方法 Wevers, N. R. et al. マイクロ流路プラットフォームにおけるニューロンおよびグリアの3Dネットワーク上でのハイスループット化合物評価。Sci. Rep. 6, 38856; doi: 10.1038/srep38856 (2016).
出版社注:シュプリンガー・ネイチャーは、出版された地図の管轄権主張および所属機関に関して中立を保っています。
本作品はクリエイティブ・コモンズ 表示 4.0 国際ライセンスの下でライセンスされています。本記事に掲載されている画像またはその他の第三者の素材は、クレジットラインに別段の記載がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。クリエイティブ・コモンズ・ライセンスに含まれていない素材の場合、ユーザー使用者はその素材を複製するためにライセンス保持者の許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
PDF版(英語)