Application Note がん治療薬スクリーニングのための
スフェロイドのハイスループット共焦点イメージング
- 倍率20倍でスフェロイド全体を1視野でキャプチャ
- 96ウェルまたは384ウェルフォーマットで生物製剤スフェロイドをスクリーニング
- 共焦点イメージングを使用して細胞応答を正確に検出
- z平面画像の2D再構成のみを保存することで、ストレージ容量を節約
PDF版(英語)
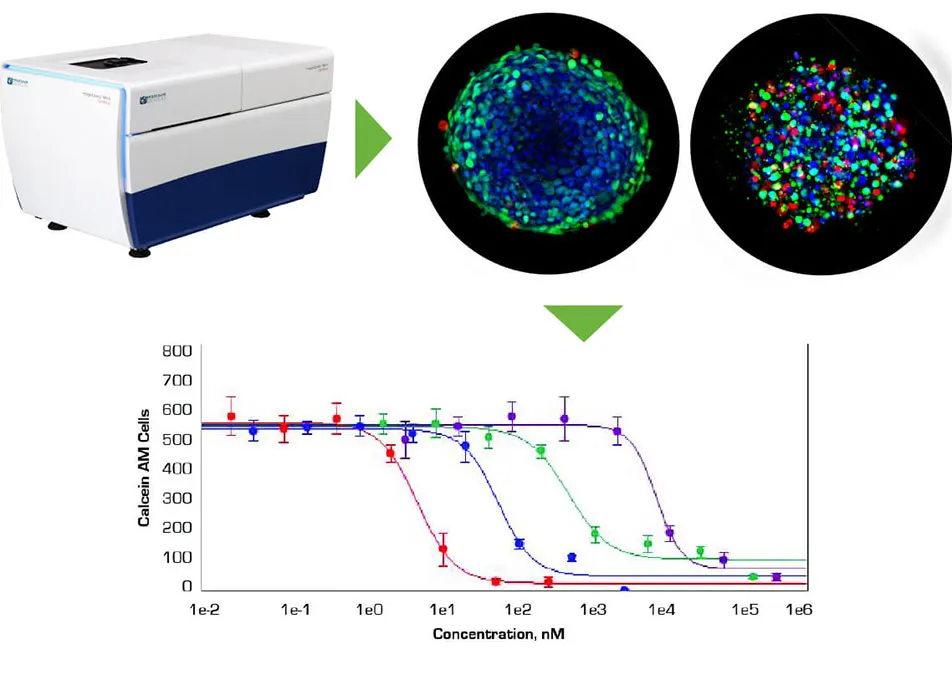
自動化されたハイスループット、ハイコンテントイメージャーにより、3Dスフェロイドの迅速な画像取得と解析が可能になった。
均一なサイズのヒトがん細胞スフェロイドを作製するin vivo 3D培養システムの能力と、自動化されたハイスループット、ハイコンテントイメージャーを使用して治療に対するスフェロイド応答をスクリーニングする能力は、化学療法薬候補のより適切な試験を容易にするための重要なステップです。ImageXpress®マイクロ共焦点システムとMetaXpressソフトウェア®は、マイクロプレート内の3Dスフェロイドの迅速なイメージングと解析を可能にし、抗がん剤の誘導アポトーシスとミトコンドリア毒性をモニタリングします。
- はじめに
- スフェロイドの形成と処理
- スフェロイドの染色とイメージング
- ImageXpress®マイクロ共焦点システムは、より正確なセグメンテーションのための鮮明な画像を生成します。
- アポトーシスアッセイによる抗がん剤スクリーニング
- ミトコンドリア膜電位アッセイのマルチプレックススクリーニング
- マイクロプレート内で3Dスフェロイドを迅速にスクリーニング
はじめに
近年、in vivoの組織環境のモデルとして用いる腫瘍細胞のin vitro凝集体の開発が大きく進展している。低付着性丸底マイクロプレートのウェルに播種すると、これらの凝集体はバラバラのスフェロイドを形成する。スフェロイドは、腫瘍と同じように、表面に露出した細胞と深く埋もれた細胞、増殖細胞と非増殖細胞、低酸素状態の中心部と十分に酸素化された外側の細胞層の両方を含むため、通常の2次元(2D)細胞培養よりも効果的に腫瘍の挙動を模倣できると考えられている。このような3Dスフェロイド・モデルは、潜在的ながん治療薬を同定するためのスクリーニング環境としてうまく利用されている。ロバスト性のスフェロイド・アッセイを開発する上での課題もある:
- スフェロイドを単一視野で画像化できるよう、すべてのウェルでスフェロイドの位置を特定し、焦点を合わせる。
- 色素を確実に浸透させ、スフェロイドの配置を妨げないように、化合物と染色処理を最適化する。
- 3D構造全体にわたって代表的な画像を取得し、撮像面の上下からのピンぼけやSB比のシグナルを最小限に抑える。
- 画像を迅速に解析し、結論を導き出すための有意義な結果を得ること
スフェロイドの形成と治療
がん細胞株HCT116、DU145、HepG2からスフェロイドを形成するために、以下の方法を用いた。細胞をフラスコで37℃、5%CO2で培養した後、剥離し、ウシ胎児血清(FBS)を添加した適切な培地中で、底が透明なU字型ウェル(それぞれCorning 4520および3830)を持つ96ウェルまたは384ウェルブラックプレートに1000~1500細胞/ウェルの密度でプレーティングした。24時間以内に、各ウェルの底に1個のスフェロイドが形成され、37℃、5% CO2条件下で2~4日後に実験に使用するまで、その大きさは成長し続けた(図1)。スフェロイドはもっと長く培養することもできるが、サイズが大きくなると、染色液の浸透や最中心部の細胞イメージングに支障をきたす可能性がある。このアプリケーションノートでは、抗がん化合物(エトポシド、パクリタキセル、マイトマイシンC)の効果を判定するために用いたアッセイについて説明する。スフェロイド処理は、まず10倍濃度の化合物をウェルに添加し、研究するメカニズムに応じて1~4日間インキュベートする。アポトーシスの研究にはより短い期間、マルチパラメーター細胞毒性研究にはより長い期間が用いられた。2日以上の薬物処理では、2日ごとに1倍濃度で化合物をリフレッシュした。
スフェロイドの染色とイメージング
ここに示した例は、ウェル中のアポトーシス細胞の発生率に加えて、スフェロイドの形態学的変化を評価するためのHCT116スフェロイドアッセイの開発から得られたものである。化合物処理終了後、染色剤を4-6倍濃度で1つのカクテルにまとめ、ウェル内の培地に直接添加した。スフェロイドの撹乱を避けるため、洗浄を必要としない染色剤が選ばれた。
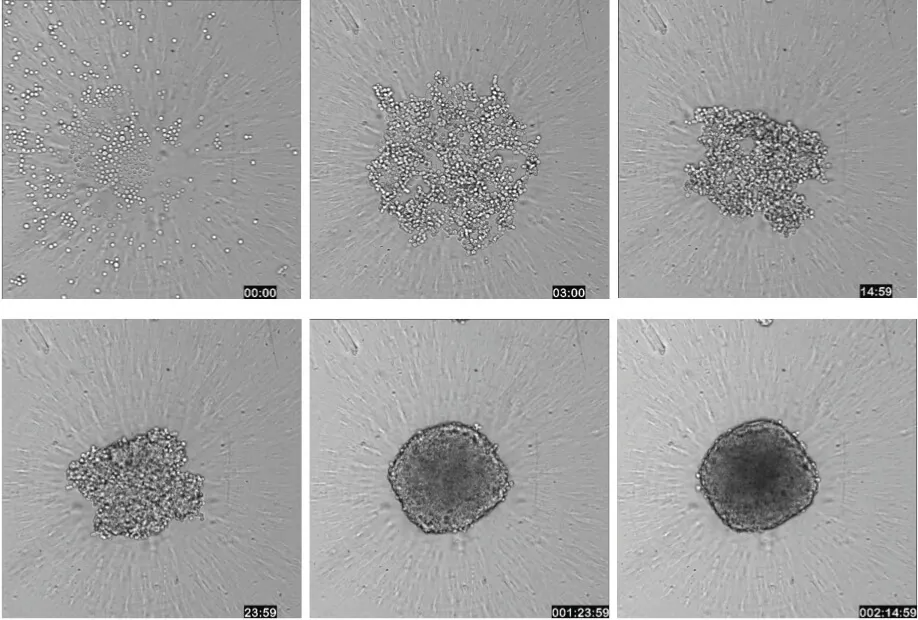
図1:ハイスループットスクリーニング環境におけるスフェロイド試験のワークフロー。単一のスフェロイドを96ウェルまたは384ウェルプレートで培養し、化合物で処理した後、色素のカクテルで染色し、プレーティングなしで画像化できる。スフェロイドは必要に応じて固定することもできる。(右)スフェロイドの形成を示すために、ImageXpress® Microコンフォーカルシステムのタイムラプス取得を用いて、63時間にわたってHCT116細胞の透過光イメージングを行った(対物レンズ10倍)。
スフェロイドは、ImageXpress® Microハイコンテントイメージングシステムを用い、10倍または20倍の倍率で可視化した。3D構造全体の細胞の反応を解析するため、スフェロイド体内の異なる深さから画像を収集し、画像の「スタック」を作成した。その画像のスタックを、数学的アルゴリズムを用いて、1つの2Dプロジェクション画像に結合または「コラプス」した。この場合、MetaXpress®ハイコンテント画像取得・解析ソフトウェアのMaximum Projection(最大投影)アルゴリズムを使用して、投影を生成するために、スタック内の最も明るい強度を持つピクセルを保持するコラプス画像が生成されました(図2)。

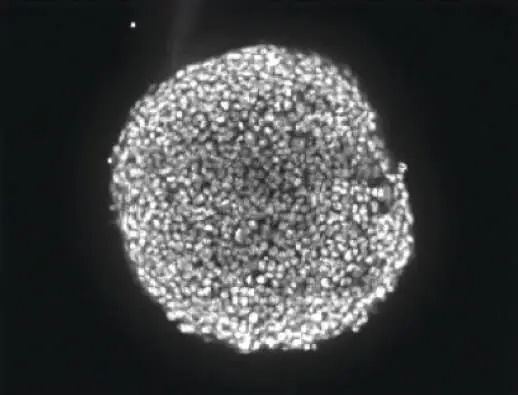
図2:スフェロイドの深さの約半分のZ平面で共焦点画像をZ-スタック取得した(左)。スフェロイドの一部のセルだけが任意の平面でピントが合っているため、解析を容易にするため、ピントが合っている領域を1つの2D画像に統合した(右)。
ImageXpress共焦点システムは、より正確なセグメンテーションのために、より鮮明な画像を生成する
共焦点光学系は、ワイドフィールド光学系よりもスフェロイドの光学断面を薄く結像させることができる。これにより、取得する平面の上下にある蛍光を発する対物レンズによって生じるバックグラウンドのボケを大幅に減らすことができる。また、細胞内レベルや、3D構造内にあるようなクラスタリングされた細胞間の微細なディテールの解像度が向上する。共焦点画像を使えば、より正確なセグメンテーションが可能な場合が多い。スフェロイドを用いた再現性のある実験では、ワイドフィールド画像から核をセグメンテーションした結果、共焦点画像でカウントした核よりも数がÍ~20%少なかった(図3)。
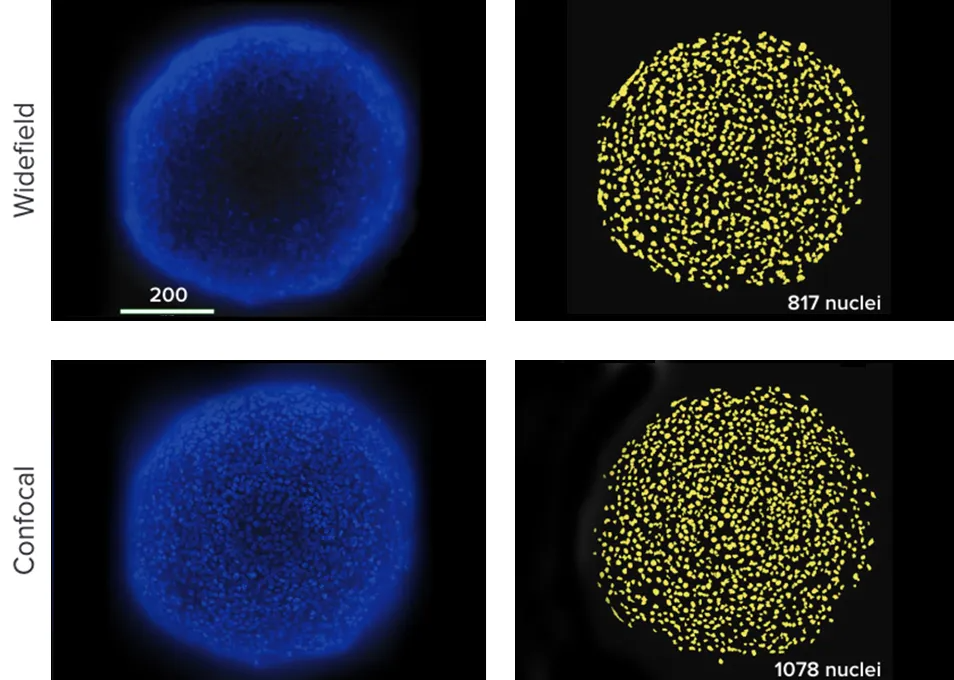
図3:(上)ワイドフィールド光学系で撮影したHCT116スフェロイドの15画像のベストフォーカス投影。ソフトウェアによるセグメンテーションで817個の核がカウントされた。核は、スフェロイドの縁の焦点の合っていない蛍光による歪みと、中央の薄暗い細胞の検出不良のために見逃された。(下)共焦点光学系で撮影したHCT116スフェロイドの15画像の最良焦点プロジェクション。より正確な数である1078個の核がカウントされた。
アポトーシスアッセイによる抗がん剤のスクリーニング
抗癌剤の一群は、アポトーシスの外因性経路を標的として細胞死を引き起こす。アポトーシスのアッセイを実証するために、96ウェルプレートで3日間培養したHCT116スフェロイドを、4種類の抗癌剤の希釈系列で24~48時間処理した。化合物処理終了後、Life Technologies社のCellEvent Caspase試薬とMitoTracker Orange試薬の両方を用いてアポトーシスを検出した。Hoechst核染色を含む、複合染色の4xカクテルをウェル内の培地に加えた。スフェロイドの邪魔にならないよう、洗い流しが不要な染色剤を選んだ(図4)。
| マルチパラメーター・アポトーシス測定用染色液 | 目的 | 最終濃度 |
|---|---|---|
| ヘキスト | 核マーカー | 16.2 µM (10 µg/mL) |
| セルイベント カスパーゼ3/7 | アポトーシスマーカー | 7.5 µM |
| ミトトラッカー オレンジ CMTMRos | ミトコンドリア電位マーカー | 200 nM |
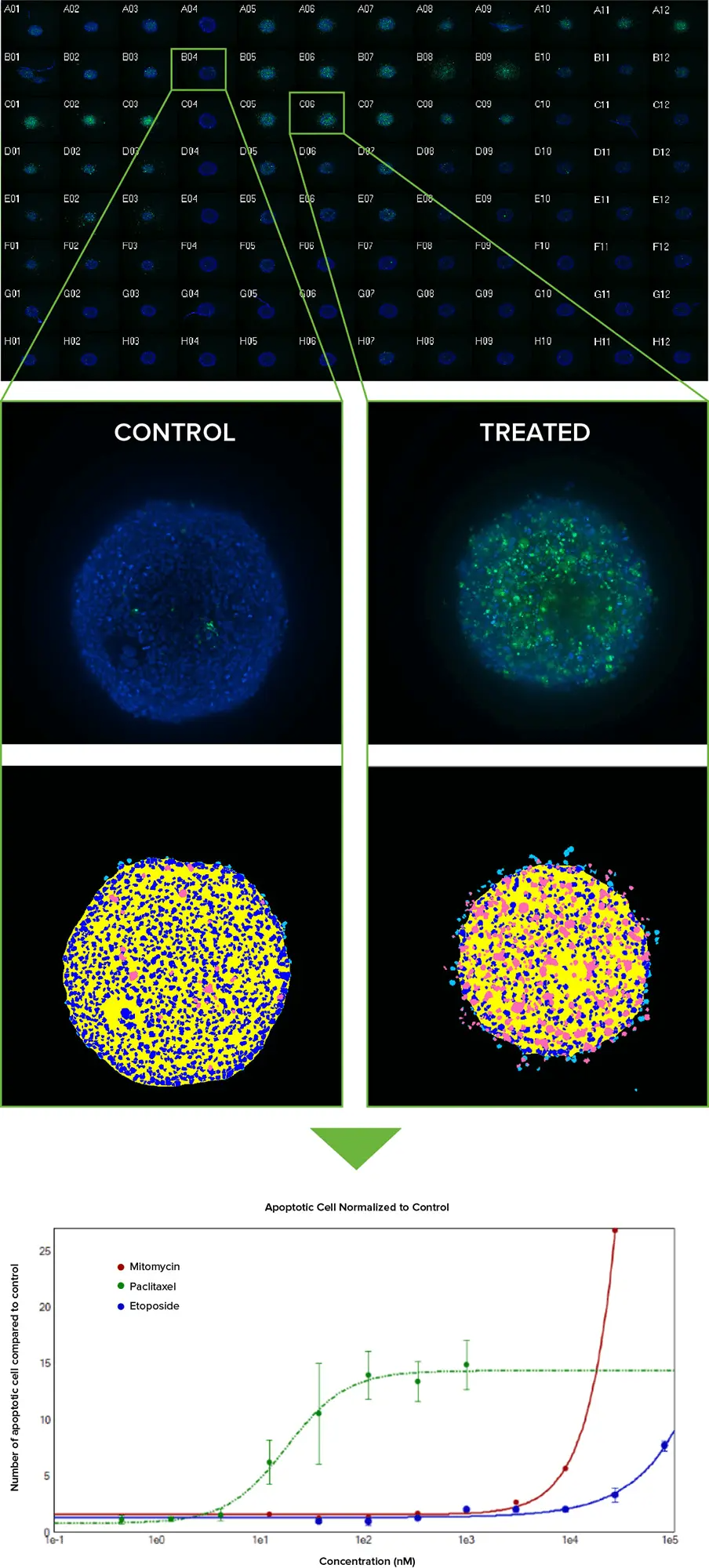
図4:(上)96ウェルプレート中のHCT116スフェロイドを化合物でプレーティングし、10倍のPlan Fluor対物レンズで撮像した画像サムネイルのモンタージュ。Hoechst染色した核(青)をCellEvent Caspase 3/7アポトーシスマーカー(緑)で重ねている。未処理のコントロールは4列目にあり、Caspase 3/7反応はA列の1uMから1:3にパクリタキセルを連続希釈した5~7列目に明らかである(全体で3反復)。(中)11枚のz平面を2D最大プロジェクション画像に合成し、シンプルなカスタムモジュールで解析した。アポトーシスの程度が低い場合と高い場合の生画像と、それに対応するセグメンテーションマスクを示す(ロイヤルブルー=核、ピンク=アポトーシス細胞)。(下)アポトーシスの量を未処理のスフェロイドと比較して正規化し、グラフにプロットすると、パクリタキセル(緑線)はマイトマイシンCやエトポシドよりもはるかに低い濃度でアポトーシスを誘導することがわかる。
スクリーニングにおけるミトコンドリア膜電位アッセイのマルチプレックス
上記のアポトーシススクリーンでは、色素カクテルにMitoTracker Orangeを加えることにより、ミトコンドリア膜電位を評価することもできる。あるいは、ミトコンドリアの代謝に影響を与えることによって腫瘍の成長を阻害する薬剤を別々に調べることもできる。以下に、ミトコンドリア膜電位の強力な破壊因子であるアンチマイシンAを用いたアッセイを示す。4時間の処理後、ミトコンドリアの健全性はスフェロイド細胞内のMitoTracker Orangeの強度に基づいて検出可能であった。ミトトラッカーは大きなスフェロイドの中心部まで完全に浸透しなかったか、あるいは中心部の細胞は健全なミトコンドリアを持っていなかった。
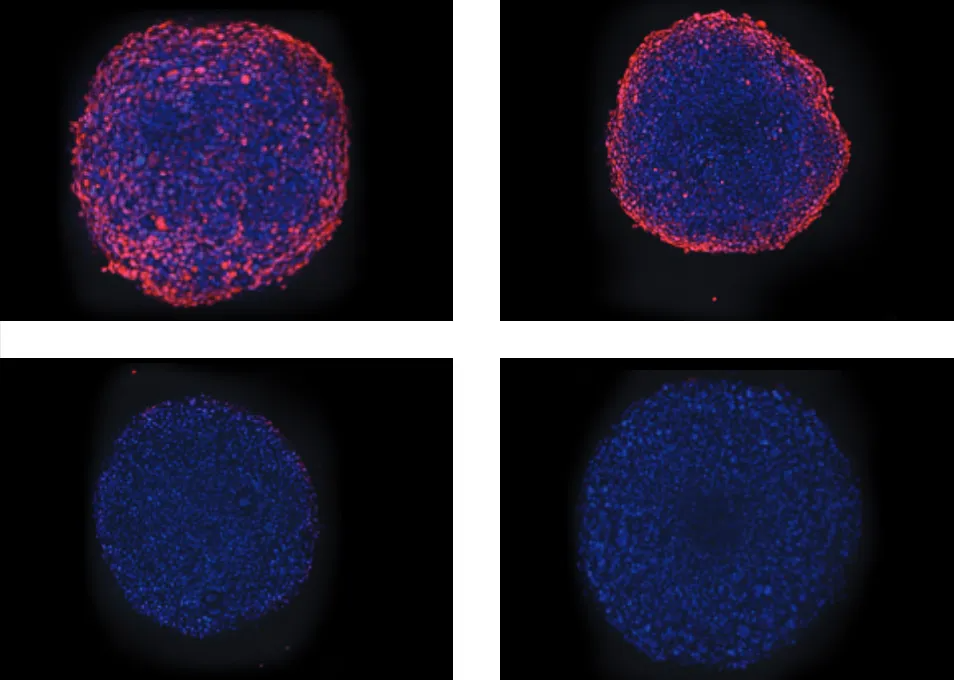
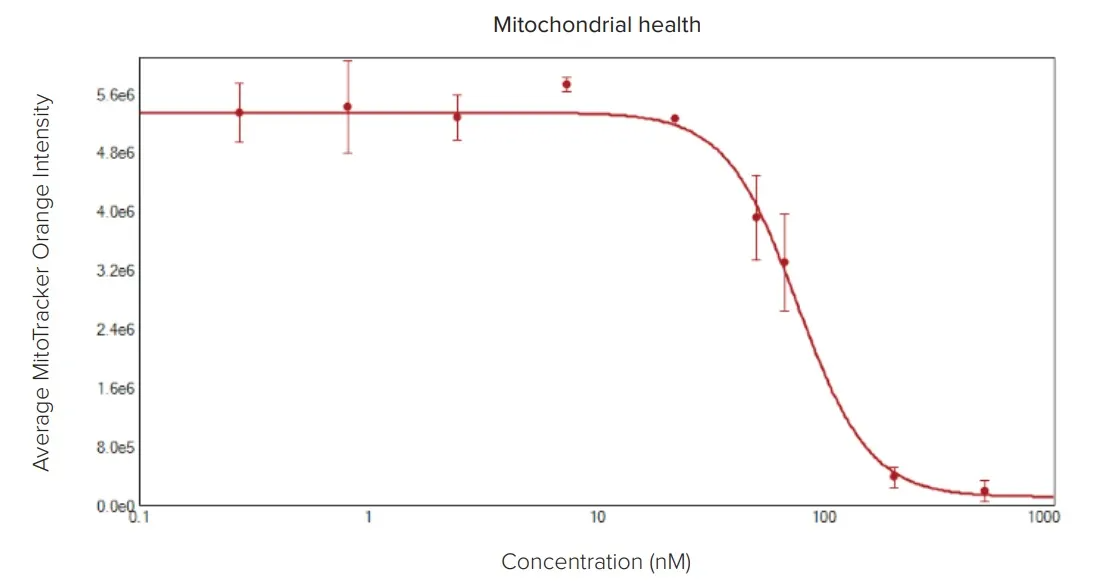
図5:ミトコンドリアに対するアンチマイシンAの毒性効果。(上)濃度1、22、67、200 nMのアンチマイシンAで処理したスフェロイドのHoechst(青)とMitoTracker(オレンジ)画像の重ね合わせ。(下)スフェロイド内で同定されたミトコンドリアの平均強度値をプロットし、薬剤の効果を示す。
マイクロプレート内で3Dスフェロイドを高速スクリーニング
均一なサイズのヒトがん細胞スフェロイドを作製するin vivo 3D培養システムの能力と、自動化されたハイスループット、ハイコンテントイメージャーを使用して治療に対するスフェロイド応答をスクリーニングする能力は、化学療法薬候補のより適切な試験を容易にするための重要なステップです。ImageXpress®マイクロ共焦点システムとMetaXpressソフトウェア®は、抗癌剤の誘導アポトーシスとミトコンドリア毒性をモニタリングするために、マイクロプレート内の3Dスフェロイドの迅速なイメージングと解析を可能にします。
これらのスフェロイド・スクリーニング・アッセイの撮影パラメーターの最適化に関する詳細は、論文を参照ください: Sirenko, O. et al., High-Content Assays for Characterizing the Viability and Morphology of 3D Cancer Spheroid Cultures. Assay and Drug Development Technologies, 2015 In Press.
PDF版(英語)