Application Note リアルタイムの流体の流れ、動的な細胞培養反応、
コンパートメント間のシグナリングなどをモニターする。
- マイクロ流路を利用して、臓器や生体組織系における流体の流れをモデル化
- 単一の96ウェルフォーマットで、さまざまなウェル深度にわたるインフォーカス画像を取得
- リアルタイムの流体の流れ、動的な細胞培養応答、コンパートメント間のシグナリングなどをモニターする。
PDF版(英語)
はじめに
生体内環境をよりよく模倣した細胞ベースアッセイへの継続的な取り組みにより、SciFlow™ 1000流体培養システムのような革新的な細胞培養システムが誕生しました。このアプリケーションノートでは、ImageXpress® Microハイコンテントイメージングシステムを用いてこの新しい培養システムのウェルを正確に画像化し、細胞毒性曝露カイネティクスを可視化および定量化する能力を紹介します。
SciFlow 1000システム(図1)は、プレートリーダー、イメージングシステム、自動リキッドハンドリングシステムに適合性のあるSBSフォーマットの96ウェル装置である。液体の効率的な流れを可能にするため、システムは左から右へとウェルの高さが下がるように設計されており、後続の各ウェルの底は列の前のウェルより500ミクロン低くなっている(すなわち、z-高さが変化している)。これにより、外部ポンプや接続チューブを必要とすることなく、システム全体で流体をカスケードフローさせることができる。
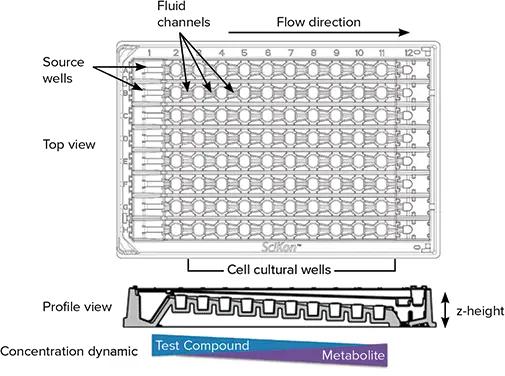
図 1. SciFlow 1000 システムの特徴。SciFlow の上面図と側面図は、流体力学とマルチウェルの主な特徴を示している。プロファイル図では、各ウェルの z-高さの違いに注意してください。ソースウェル(カラム1)に試験薬液を塗布し、後続のウェルに連続的に暴露すると、化学薬液濃度が低下する勾配が生じ、リンクされたウェルの直線配列全体にわたって代謝物と細胞反応が同時に増加する。
しかし、このようにプレート全体でz-heightが変化すると、各ウェルの焦点位置を正確に決めることができないため、ほとんどのイメージングシステムにとって課題となります。このアプリケーションノートでは、ImageXpress マイクロシステムが、4000 µm の垂直範囲にフォーカス位置をダイナミックに適応させることができ、定量用にクリアでフォーカスされた画像を迅速に提供できることを紹介します。
使用材料
- SciFlow 1000 流動培養システム (SciKon Cat. No. AA-1-50)
- HepaRGセル(Triangle Research Labs社、カタログ番号NSHPRG)
- 培地 MH100、MHTAP、MHMET (Triangle Research Labs)
- CellTox™ Green(Promega Cat. No.)
- Hoechst DNA Dye(Sigma Cat. No.)
- タモキシフェン(Sigma Cat.)
- フルオレセイン塩(Sigma Cat.)
- インストゥルメンテーション ImageXpress Micro HighContentイメージングシステム(Molecular Devices社製)
ImageXpress Microシステムを用いたフォーカス位置の最適化方法
各ウェルのz-フォーカス位置を決定するために、HepaRG細胞をSciFlow 1000システムにプレーティングし、Hoechstによる核DNA染色で分析した。システムのz-高さ調整を表1に示し、7列目はイメージング中のレーザーオートフォーカスの設定に使用するシステムの中間点またはゼロ基準点である。
実験
我々の方法ワークフロー(図3)は、HepaRG細胞のタモキシフェン処理に関する実験デザイン(図2)の概要を示している。HepaRG細胞を50μL培地にプレーティングした。細胞接着後、培地を細胞毒性指標 CellTox™Green の 1:2000 希釈液および 0.5 μg/ml Hoechst を含む培地と交換した(100 μL/ウェル)。その後、CellTox Green を封じ込め た培地 400 μL をソースウェルに添加した。プレートを 30 分間インキュベートし、流体の流れを活性化させ、流体チャネ ルの接続を可能にした。完全に接続されたら、100 μL の試験化合物、ビヒクルコントロール、または 1 μM フルオレセイン(流体トレーサーコントロール)をそれぞれのソースウェルに添加した。複数日にわたって流体の流れを維持するため、100μLをカラム11のウェルから手動で抜き取り、新鮮な薬物、ビヒクル、またはフルオレセイン標準物質を1日3回、ソースウェルに添加した。この結果、4日間にわたって培地が完全に交換される一方、各治療群では試薬が常に注入された。
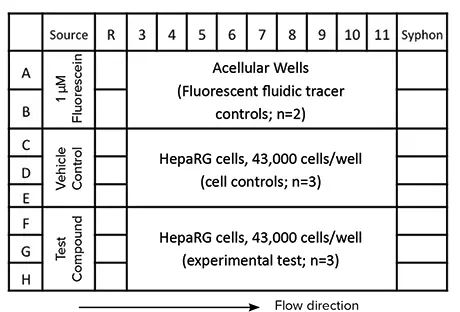
図 2. SciFlow 1000 システム 1 台と実験レイアウトの例。細胞の播種と接着(50 µL)はカラム 3-11 で行う。その後、ウェル容積を 100 µL に増やし、ウェル間の流体連通を可能にする。最後に、カラム 1 のソースウェルに試験化合物を添加します。

図3. メソッドのワークフロー。
ウェルの深さが変わっても対応できるよう、Z-heightフォーカルアジャストメントを使用した自動イメージング
Hoechst 染色(全細胞)と CellTox Green 染色(死細胞)は、複数の時点でプレート全体をイメージングすることによりモニターした。プレーティングは、化合物添加前と、その後4日間にわたる12回の時点で読み取った。イメージング実行の間は、プレートをインキュベーターに保管することで環境制御を維持した。画像はMetaXpress® ソフトウェアのLive Deadアプリケーションモジュールまたはカスタムアプリケーションモジュールを用いて解析し、細胞生存率を定量した。
SciFlow 1000システムは96ウェル培養フォーマットと同様に構成されている。SciFlowはまた、隣接するカラム間に500ミクロンのz-heightステップを組み込み、ウェル3と11の間のz-height変化を最大4 mmにした(表1)。ImageXpress Micro システムはワイドフィールドモードで使用され、レーザーオートフォーカス(4X)およびオプションで画像ベースオートフォーカス(20X)を使用して、SciFlow 1000 システム全体の大きな z-height変化に対応した。ImageXpress Micro システムは、4X で 90 秒、20X で 5 分で 72 ウェル(1 ウェルあたり 1 視野)すべてをイメージングした。20X でのイメージングでは、イメージオートフォーカスを使用した。
| SciFlow 1000 System z-height adjustments | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| カラム | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| ミクロン | + 2000 | + 1500 | + 1000 | + 500 | 0 | - 500 | - 1000 | - 1500 | - 2000 |
表 1. ImageXpressマイクロシステムを使用したSciFlow 1000システムのZ高さ
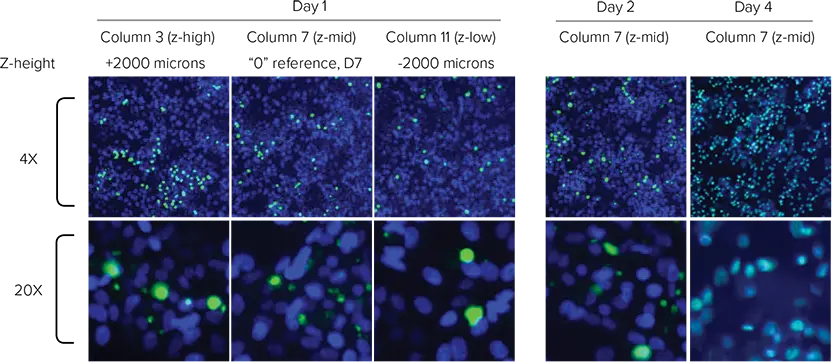
図4. 4倍および20倍での細胞のイメージング。青=全細胞、緑=死細胞。(左)1日目、タモキシフェンフロー開始前のD列(ビヒクルコントロール)を横切る濃度勾配。(右)2-4日目、濃度対時間のリアルタイムタモキシフェン露光カイネティクス(G行)。
まとめ
ハイコンテントイメージャーの将来は、より複雑で生理学的に適切な培養フォーマットに対応できるようになることである。非標準フォーマットのイメージングにより、研究ニーズに対応した高画質な画像を生成しながら、ワークフローに柔軟性が生まれます。SciFlow 1000 Fluidics Culture Systemはそのようなフォーマットの一つであり、リアルタイムの流体の流れ、直接的な細胞培養応答、細胞応答のコンパートメント間の動的シグナリングをモニターするために使用することができます。我々は、ImageXpress Microシステムが、SciFlow 1000システムのような可変z-heightフォーマットのプレートと互換性があることを示すことができた。4mmを超えるz-heightの変化で自動イメージングが達成され、高品質で再現性のあるデータが迅速に生成された。
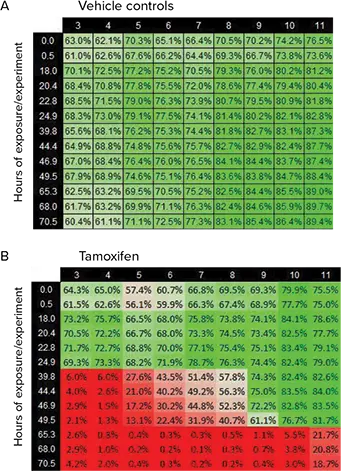
図5. タモキシフェン細胞毒性測定。表データは、SciFlow 1000 システムの行全体の細胞生存率を示す。表の列は SciFlow 1000 システムの対応する列(3-11)を示す。表の行は実験が測定された時点。値は4倍画像から作成した。(A) この表は、経時的なビヒクル対照細胞の生存率を示す。値はC、D、Eの行の平均値である。(B)この表はタモキシフェンの細胞生存率を示す。F、G、H行の平均値。
PDF版(英語)