Application Note がん毒性研究のための複数の高密度スキャフォールドフリースフェロイドを用いた
3次元細胞培養のハイスループットスクリーニング
- 実験条件ごとにスフェロイドの数を簡単に増やせる
- 多数のスフェロイドを同時に増殖、染色、画像化
- ハイコンテントイメージャーを使用して、複数のスフェロイドやオルガノイドの3D解析を同時に実施
PDF版(英語)
はじめに
アンジェリン・リム博士|アプリケーションサイエンティスト|モレキュラー・デバイス
がん研究のための3Dスフェロイドモデルは、従来の2D培養モデルと比較して、腫瘍のin vivo組織構造、遺伝子発現、代謝プロファイルをよりよく模倣できるため、人気が高まっている1,5,6。これまでの研究で、3D培養は、セル-細胞/ECM相互作用、薬剤の浸透性、用量反応性、抵抗性など、いくつかのin vivo腫瘍の特徴を示すことが示されている7。固形腫瘍と同様に、スフェロイドは外側の細胞増殖ゾーン、中間の静止細胞層、そして細胞が低酸素状態にさらされる内側の壊死コアから構成されている。これらの類似性から、3Dモデルは薬剤の安全性をよりよく評価し、抗がん化合物の同定に成功することが示唆される4。
スフェロイド作製には様々な技術が開発されている。基本的に、これらのアプローチは、細胞接着抵抗性表面か、細胞間相互作用を促進する物理的な力のいずれかを使用する。スピナーフラスコ/NASAバイオリアクターシステムは、細胞がフラスコ表面に接着しないように連続的な運動を利用し、細胞間接着を促進する。磁気浮上法は、磁場を利用して酸化鉄ナノ粒子を封じ込めた細胞をクラスタリングし、スフェロイドを形成する。スピナーフラスコ法と磁気浮上法は、大量のスフェロイドを生成することができるが、均一性が悪く、球状のスフェロイドの比率は低い2。ハンギングドロップ法では、培養皿の底から細胞懸濁液を滴下する。この液滴で形成されたスフェロイドを細胞培養プレートに移し、さらにアッセイを行う。
自動化なしでは、この手法は労力と時間がかかるため、小規模な研究に限定される。スフェロイドを作製する一般的な方法は、付着性の低い材料でコーティングされた丸底のU字型ウェルを持つプレートを用いるものである。スキャフォールドを使わないこの方法は、ワークフローが比較的簡単で、ハイコンテントイメージャーに適合する。加えて、スフェロイドのサイズを容易に制御でき、スフェロイドの均一性も高い2。アッセイ時間を短縮し、ばらつきを最小化するワンステップ染色手順で、丸底プレートでのワークフローを最適化する研究がこれまでに行われている3。しかし、Uボトムプレートを使用する際の欠点は、各ウェルで単一のスフェロイドしか作製できないことである。データポイントを増やすには、ウェルの複製が必要となり、時間がかかり、試薬や試験化合物の使用量が増えるため、最終的にスクリーニングコストが上昇する。
複数の安定したサイズのスフェロイドを作製するためのソリューションとして、付着性の低い表面にパターニングされたマイクロウェルのアレイが登場しました。Corning® Elplasia® プレートは、標準的な培養プレート(6ウェル、24ウェル、96ウェル)内にマイクロキャビティを設けたデザインです。各ウェルは、スフェロイド形成を可能にする超低付着面でコーティングされている。1ウェルあたり1個のスフェロイドを形成するU底プレートでの標準的なワークフローと比較して、エルプラシア・プレートは96ウェルプレートで1ウェルあたり平均78個のスフェロイドを形成することができる。これにより、複数のスフェロイドを同じ条件下で成長させ、処理することができ、データ出力を最大化することができる。さらにこの方法は、腫瘍組織のクローン不均一性を研究したり、遺伝子発現やメタボローム・プロファイリング用の材料を増やしたりするのにも応用できる5,8。
ここでは、スフェロイド作製、化合物処理、細胞毒性アッセイ、ImageXpress® マイクロコンフォーカルハイコンテントイメージングシステムでのハイコンテントイメージング、MetaXpress® ハイコンテント画像取得・解析ソフトウェアを用いた3D画像解析を含む3D培養ワークフローで、エルプラシア96ウェルプレートの使用を実証する。複数のスフェロイドを容易に作製し、ハイコンテントイメージャーとシームレスなワークフローを統合する能力は、創薬や化合物の毒性学において重要な応用が期待される。
方法
セル培養
スフェロイドの作製にはHCT116細胞株(ATCC)を用いた。Elplasiaプレートはあらかじめ湿潤させ、メーカーのプロトコールに従ってハンドリングした。細胞をElplasia 96ウェルプレート(#4442)に50,000個、合計100μLのMcCoy培地(10%FBS添加)にプレーティングした。細胞を37℃で24時間インキュベートし、化合物処理前にスフェロイドを形成させた。
化合物を添加する前に、スフェロイドの形成を確認するため、セルを組織培養顕微鏡で目視検査した。ここでは以下の化合物を用いた: シタラビン、ドキソルビシン(Dox)、エトポシド、スタウロスポリン、タキソール。化合物は、7点、1:5希釈系列とコントロールの二重ウェルで試験した。スフェロイドは化合物と合計6日間インキュベートし、3日目に新しい化合物を加えた。
染色
生細胞毒性アッセイのために、スフェロイドは以下の色素の混合物で染色した: 3 µM Calcein AM(Life Technologies)、2 µM Ethidium Homodimer III(EthD-III)(Molecular Devices)、33 µM Hoechst 33342(Life Technologies)。色素溶液は使用直前に調製し、各ウェルに合計 10 µL 添加した。スフェロイドを色素とともに37℃で2時間半インキュベートした後、イメージングを行った。
画像取得
ImageXpress® Micro Confocalシステム(Molecular Devices社製)を用い、10X対物レンズで画像を取得した。共焦点ピンホールサイズ=60μm。スフェロイドの体積の少なくとも半分をカバーするように、5 µmのステップサイズで12枚の画像をスタックした。
解析
MetaXpress®ソフトウェアのカスタムモジュールエディターを用いて3D画像解析を行った。解析では、3D機能Find Spherical Objectsアルゴリズムを用いて、Hoechst染色画像を用いてスフェロイドを同定した。Count Nucleiモジュールは、Hoechst染色に基づいて細胞の総数を特定するために使用した。Live/deadモジュールは、死細胞(EthD陽性)と生細胞(Hoechst陽性、Eth陰性)の数を定量化するために使用した。死細胞はもはやHoechst染色を示さない可能性があるため、Cell Scoringモジュールを使用して、すべてのEthD陽性細胞を同定した。全平面における全細胞、生細胞、死細胞の対物レンズは、Connect by Best Matchアルゴリズムを用いて3Dオブジェクトを形成するために連結された。用量反応解析は、SoftMax® Proソフトウェアで4パラメータロジスティックカーブフィットを用いて行った。統計解析とグラフはMicrosoft Excelで行った。
結果
代表的なスキャフォールドを使用しないスフェロイド作製法では、1ウェルに1個のスフェロイドを作製する超低吸着Uボトムプレートを使用する。データポイントを増やすには、ウェルの複製が必要となり、多くの場合、手間がかかり、結果的にスクリーニングコストを押し上げることになる。エルプラシア96ウェルプレートは、1ウェルに78個ものスフェロイドを形成することができ、各スフェロイドはマイクロウェルに入れられる。このマイクロウェルで形成されたスフェロイドは、サイズと形状が一定であるため、再現性が向上する(図1)。このプレートはImageXpressハイコンテントイメージングシステムと互換性があり、使用するアッセイによって異なる生物学の出力が可能です。
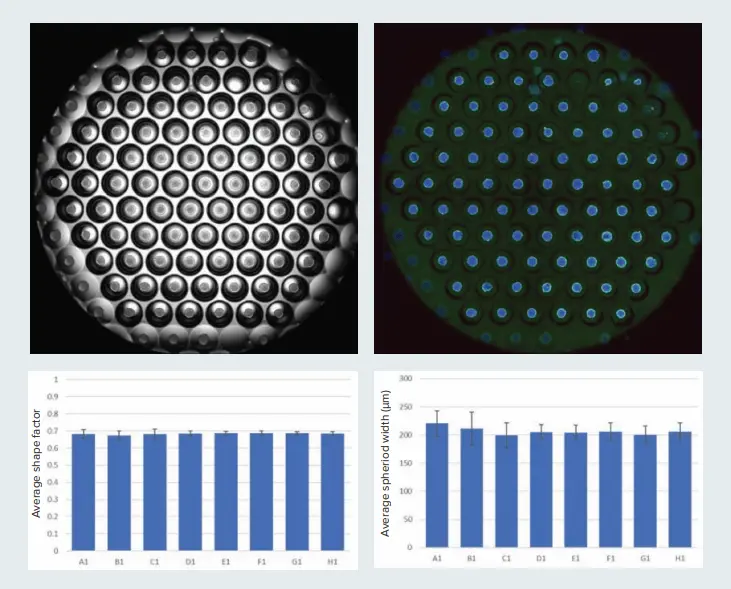
図1. 複数のスフェロイドをコーニングElplasiaプレートで作製できる。96ウェルElplasiaプレートの1ウェルの図を示す。画像は4X対物レンズを用いて取得した(4カ所、その後スティッチ)。透過光と蛍光イメージを示す。スフェロイドのサイズや形状のばらつきは、しばしば結果の再現性に影響する。スフェロイドの均一性を評価するために、スフェロイドの直径とシェイプファクター(1が真円を示す円形度の尺度)を測定した。グラフは、8つのコントロールウェルからの平均シェイプファクターと平均スフェロイド直径(標準誤差を含む)を示す。
スフェロイドを異なるクラスの抗がん化合物で6日間処理し、細胞生存率を評価した。スフェロイドはHoechst(核)、Calcein AM(生細胞)、EthD(死細胞)で染色した(図2および3)。スフェロイドへの妨害を最小限にし、染色プロセスを簡略化するため、色素はインキュベーション後も洗い流さず、ウェルに残した。
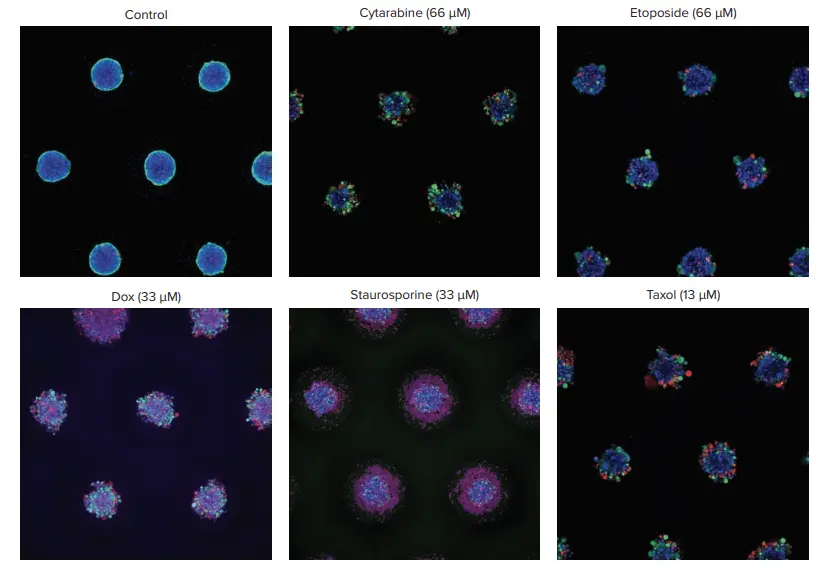
図2. コントロール対処理スフェロイドの代表画像。スフェロイドはHoechst核色素(青)、生細胞はCalcein AM(緑)、死細胞はEthD(赤)で染色した。画像は10倍の対物レンズでZ-スタック機能を用いて取得。最大プロジェクション画像。処理されたスフェロイドは様々な表現型効果を示したが、そのほとんどは、主スフェロイドから細胞が剥離し、コンパクトなスフェロイド構造を失った。
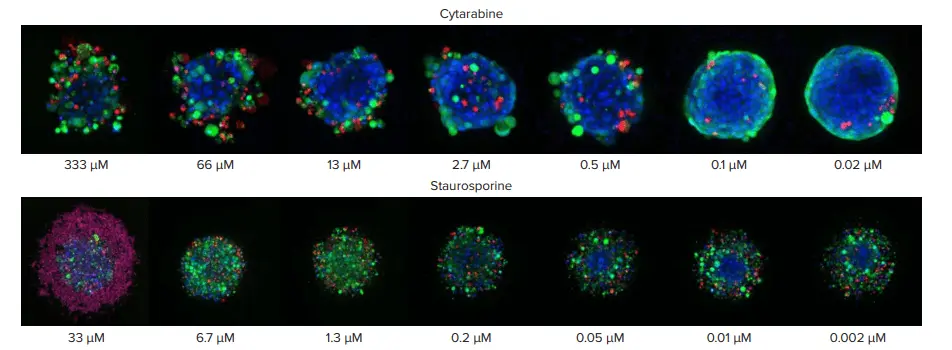
図3. 異なる濃度のシタラビンとスタウロスポインで処理したスフェロイド。二つの異なる化合物に対するスフェロイド構造の違いに注意。シタラビン処理では、スフェロイドから細胞が剥離し、コンパクトな構造ではなくなる。スタウロスポリン処理では、スフェロイドの形態が分散し扁平になり、特に高濃度では多数の死細胞を伴う。
細胞生存率に対する化合物処理の影響を定量化するために、MetaXpressソフトウェアでカスタムモジュールエディター(CME)を用いて画像を3D解析した。スフェロイドの直径、体積、死細胞と生細胞の数を測定した。
化合物処理の結果、細胞毒性および細胞静止効果が観察された。全体として、全ての化合物において生細胞数(EthD陰性)の減少が観察された。死細胞(EtHD陽性細胞)の数は、特にスタウロスポリンとドキソルビシンでの処理の結果増加し、細胞毒性効果を示した。細胞の総数は、タキソールおよびエトポシドで処理した結果減少し、試験した濃度におけるこれらの化合物の細胞毒性効果の大部分を示した(図4Cおよび4D)。
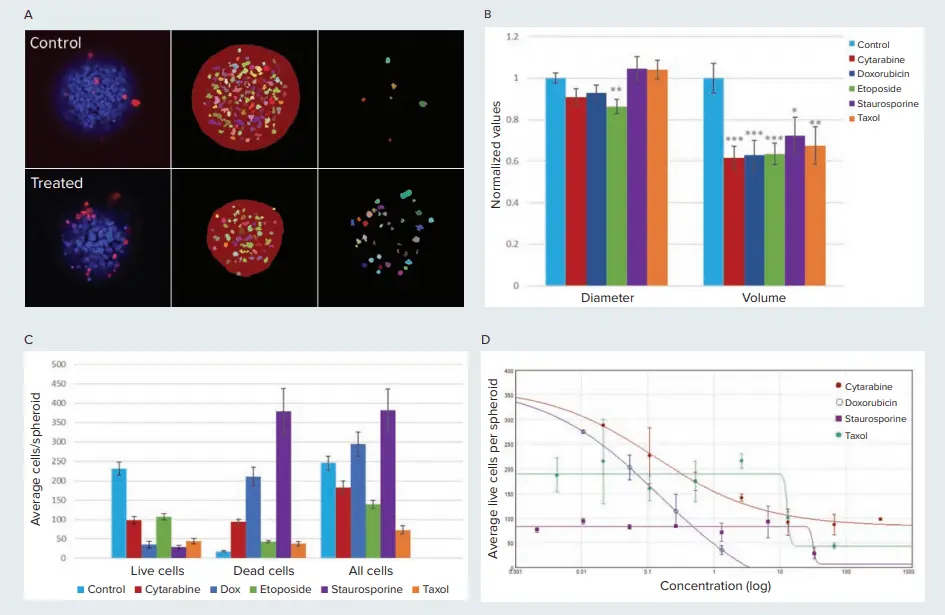
図4. コントロールと化合物処理細胞のスフェロイドに対する細胞毒性効果を示す。A) コントロールとシタラビン処理(13.3 µM)スフェロイドの単一平面における画像解析マスク。中列はスフェロイドと生細胞(EthD陰性)のマスク。右列は死細胞(EthD陽性)のマスク。B) エトポシドを除き、処理したスフェロイドは未処理のスフェロイドと比較して、スフェロイド径に有意な変化は見られなかった。対照的に、処理したスフェロイドは体積が20%から40%減少した。* p<0.05, **p<0.01, ***p<0.001。シタラビン(333μM)、ドキソルビシン(1.3μM)、エトポシド(333μM)、スタウロスポリン(33.3μM)、タキソール(67μM)。C) 化合物処理した細胞は、スフェロイドあたり平均して生細胞数が少なく、死細胞数が多い(p<0.001)。D) スフェロイドあたりの平均生細胞数を化合物濃度に対してプロットし、4パラメータカーブフィット処理を行った。EC値は以下の通りである: シタラビン=0.128μM、ドキソルビシン=0.156μM、スタウロスポリン=31.78μM、タキソール=13μM。スタウロスポリンとタキソールのEC値が高いことは、細胞毒性が観察される前に、これらの化合物が細胞静止効果を示すことを示唆している。
処理したスフェロイドでは、濃度依存的に生細胞の減少が観察された。シタラビン、ドキソルビシンおよびシタラビンで処理すると、濃度依存的に生細胞数が減少し、それに対応して死細胞数が増加した。タキソールで処理したスフェロイドはスフェロイドサイズの減少を示したが、生細胞数は減少しなかったことから、細胞毒性作用が示唆された。細胞毒性はタキソールの濃度が高い場合(13.3μM)に認められ、生細胞数は3倍減少した。
また、直径と体積を測定することで、スフェロイドの大きさに対する化合物の影響も評価した(図4B)。興味深いことに、化合物で処理したスフェロイド(シタラビン、ドキソルビシン、スタウロスポリン、タキソール)は、コントロールサンプルと比較して、観察された直径に有意差を示さなかった。しかし、処理したスフェロイドは、コントロールと比較してスフェロイド体積の有意な減少を示した。直径の減少を伴わないスフェロイド体積の減少は、3D形態がもはや維持されていない崩壊したスフェロイド構造を示している。直径は2D解析だけで測定できるため、体積と直径の違いは、スフェロイドに対する化合物の毒性の影響を調べるには、3D解析を用いる方がより代表的であることを示唆している。
スフェロイド中の生細胞数は、表現型変化を引き起こす化合物の有効濃度を決定するために使用できるが、3D解析による他の測定値から、特異性効果に関する追加情報(死細胞数、総細胞数、強度など)を得ることができる。
結論
複数のスフェロイドをCorning Elplasia 96ウェルマイクロプレートで容易に作製し、化合物で処理、染色した後、ImageXpress® Micro Confocalシステムでイメージングできることを示す。MetaXpress®ソフトウェアを用いたスフェロイドの3D画像解析により、スフェロイドに対する化合物の効果を定量的に評価することができる。開始から終了までのワークフローは、3D培養を用いた迅速な薬剤スクリーニングのために最適化されている。
参考文献
- Nath, S. & Devi, G. R. がん研究における3次元培養システム: 腫瘍スフェロイドモデルを中心に。Pharmacol. Ther. 163, 94-108 (2016).
- Zanoni, M., Piccinini, F., Arienti, C. et al. in vitro治療スクリーニングのための3D腫瘍スフェロイドモデル:得られたデータの生物学的関連性を高める体系的アプローチ。Sci Rep 6, 19103 (2016).
- Sirenko O, Mitlo T, Hesley J, Luke S, Owens W, Cromwell EF. 3D 癌スフェロイド培養の生存率と形態を特徴付けるハイコンテントアッセイ。Assay Drug Dev Technol. 2015;13(7):402-414.
- Kimlin LC, Casagrande G, Virador VM. がん研究におけるin vitro三次元(3D)モデル:最新情報。Mol Carcinog. 2013;52(3):167-182.
- ラット肝組織、単層およびスフェロイド培養肝細胞における遺伝子発現の比較解析。細胞 組織 臓器. 2010;191(4):281-288.
- 単層培養と三次元スフェロイド培養で異なる代謝プロファイルを示すMG-63ヒト骨肉腫細胞:(1)H NMR研究。FEBS Lett.
- Fischbach C, Chen R, Matsumoto T, et al. 3Dスキャフォールドを用いた腫瘍エンジニアリング。Nat Methods. 2007;4(10):855-860.
- Greaves M, Maley CC. 癌におけるクローン進化。Nature. 2012;481(7381):306-313. 2012年1月18日発行。
PDF版(英語)