Application Note ハイスループット2色有糸分裂指標アッセイ
PDF版(英語)
はじめに

有糸分裂数(検証済みアッセイ)
ブルーシフト・バイオテクノロジーズ社(BBI)は、レーザー散乱と蛍光測定を用いたマルチウェルプレート内の細胞のハイスループットなマルチパラメトリックスクリーニングのための強力な新しいスクリーニングプラットフォーム、ImageXpress® Velosシステムを開発しました。接着細胞のマルチパラメトリー分析は、研究者にとってますます重要になってきている。BBIは研究コミュニティと密接に協力し、ハイスループットなアッセイを可能にする画像解析手順の開発、実行、検証に重要な柔軟性を備えた、画像取得と解析モジュールが統合されたプラットフォームを開発してきました。Active Motif社(カリフォルニア州カールスバッド)と共同開発した最初の検証済みアッセイは、ToxCountTM細胞生存率アッセイキットである。ここでは、リン酸化ヒストンH3とDNA含量の免疫蛍光検出によって有糸分裂細胞を同定する、自動画像取得と解析を用いた迅速で簡便な有糸分裂指標アッセイの開発について報告する。
アッセイ手順
細胞と培養条件 HeL.細胞は10% FCS添加MEMで培養した。細胞を96ウェル、黒壁の透明底ポリスチレンプレートに、50μlの増殖培地中2,500細胞/ウェルの密度でプレーティングし、5%CO2インキュベーター中37℃で一晩培養した。増殖培地を除去し、細胞を50μlの完全培地中、様々な濃度のパクリタキセルで処理した。
ImageXpress Velos Systemによる有糸分裂細胞の検出。パクリタキセル処理後、細胞を固定、透過処理し、ヒストンH3のSer10のリン酸化(phospho-H3)に対する有糸分裂マーカー抗体で免疫染色した。ウサギ抗ホスホヒストンH3抗体はMillipore社から贈られた(Upstate Cat # 06-570)。抗ウサギAlexa Fluor-488(AF488、Invitrogen)標識二次抗体で一次抗体を検出し、ヨウ化プロピジウム(PI)ですべての核を同定した。ホールウェル画像は、赤色チャンネルで細胞を同定し、緑色と赤色チャンネルのバックグラウンド補正積分蛍光強度を用いて、細胞ごとに解析した。ImageXpress Velosシステムレーザースキャニングプラットフォームは、以下のバンドパスフィルターで2チャンネル取得用にセットアップされた。Ch1:510-540nm(緑)、Ch3:600nmロングパス(赤)。画像取得は5 x 5ミクロンサンプリングで行われた。
結果と考案
4 h パクリタキセル治療
1μMパクリタキセルで4時間処理した細胞のホスホH3(PH3)とPI染色のホールウェル画像結果を図1に示す。画像取得と2色画像処理による有糸分裂細胞の自動定量を図示した。
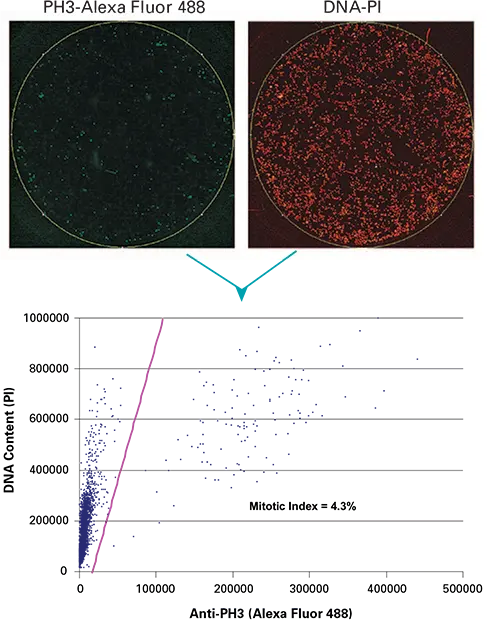
図1. 1μMパクリタキセルで4時間処理した細胞のウェル全体像。Th.画像はAF488で染色した抗ホスホH3(抗PH3)(左)と核染色PI(右)。下の2パラメータドットプロットは、x軸に抗PH3積分強度(Ch1)、y軸にDNA含量積分強度(Ch3)を示す。紫色の分割線は Ch1/Ch3 比を表し、x 軸の切片は自動有糸分裂指数定量に使用する設定を定義します。示されたサンプルの有糸分裂指数(MI)は4.3%であった。コントロール試料とパクリタキセル処理試料のMIは、それぞれ0.9±0.2%と3.4±0.8%であった(n=4)。
17 h パクリタキセル治療
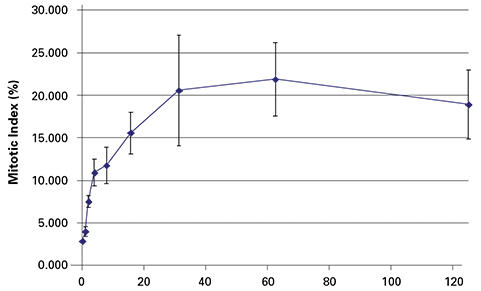
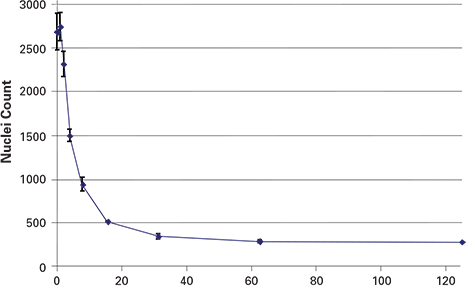
指示濃度のパクリタキセルで17時間処理した細胞のPH3とPI染色の結果を以下に示す。画像取得と2色画像処理によるMIの自動定量により、図2に示す結果が得られた。パクリタキセルは予想されたように用量依存的にMIを増加させ、最大効果を示した。図3に示すように、細胞数に対するパクリタキセル処理の効果は、ウェルに残った細胞数の減少を示した。細胞数の減少は、高濃度のパクリタキセルで観察された高いMIエラーバーの一因と考えられる(図2)。画像取得は5×5ミクロンサンプリングで行われ、スキャンと解析の合計時間は4分であった。
パクリタキセル(nM)
図2. パクリタキセルを17時間処理すると、有糸分裂細胞数は濃度依存的に増加した。各データ点はn = 4ウェルを表す。
パクリタキセル(nM)
図3. パクリタキセルを17時間処理すると、細胞数は濃度依存的に減少した。各データ点はn = 4ウェルを表す。
17時間パクリタキセル処理と細胞周期ヒストグラム
Ch3(PI)積分強度を用いたPI染色細胞の蛍光分布のヒストグラムは、BBIが開発したExcelマクロを用いて作成した。指示濃度のパクリタキセルで17時間処理した細胞のPI染色の結果を図4に示す。
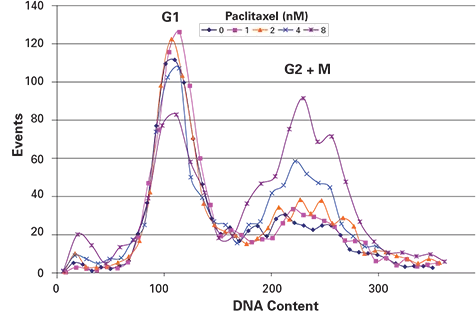
図4. パクリタキセルを17時間処理すると、濃度依存的に有糸分裂細胞数が増加し、G1細胞数が減少した。DNA含量の測定は、G1ピークを約100として正規化した。
結論
本報告では、ユニークな光学系と電子回路を備えたImageXpress Velos System.レーザースキャニングプラットフォームが、MI定量用のハイスループット2色アッセイをどのように可能にしたかを示した。パクリタキセル(タキソールTM)をモデル化合物として用い、4時間および17時間の処理後にG2/M後期ブロックとMIの増加をもたらした。画像解析はスキャンと同時に行われ、結果はスキャン後すぐに見ることができる。結果は、各ウェルの細胞ごとのデータを列挙したリストファイル(.csv)、および有糸分裂の割合、非有糸分裂の割合、有糸分裂細胞数と非有糸分裂細胞数をプレートレイアウト形式で示した要約テキストファイルとして保存される。各96ウェルプレートは、5×5ミクロンサンプリングで4分、10×10サンプリングで2分でスキャンされる。このアッセイを推進するためのこのプラットフォームの重要な特徴は以下の通りである:
- 既存のMIアッセイをシンプルなハイスループットで実行できるように設計されている。
- 蛍光バックグラウンドを低減し、このアッセイをシングルステップかつ均質な非洗浄形式に変換する能力を提供する限定された検出領域を持つコレクション光学系。
- ウェル全体および細胞ごとの分析により、測定値を全細胞数に正規化し、薬剤による細胞の損失を補正する。
- DNA含量も同時に測定されるため、細胞周期解析が可能。
- 本プラットフォームは、ウォークアウェイ操作用のプレートハンドラー(Twister II)を内蔵しています(最大160プレート)。
PDF版(英語)