Application Note SpectraMax DuoLucレポーターアッセイキットによる
高感度デュアルルシフェラーゼ検出
- ウェルあたり10細胞以下でホタルおよびレニラ・ルシフェラーゼ発現を検出
- レポーター発現をコントロールに正規化することにより、結果の精度を向上
- SoftMax Proの設定済みプロトコールにより、迅速なデータ解析が可能
PDF版(英語)
はじめに
ホタルルシフェラーゼは、遺伝子の制御と機能を研究するために広く使われているレポーターである。哺乳類の細胞や組織には内因性のルシフェラーゼ活性がないため、非常に感度の高いレポーターである。ホタルルシフェラーゼは62kDaのタンパク質であり、単量体として活性を持ち、活性のためにその後のプロセシングを必要としない。D-ルシフェリンのATP依存的酸化を触媒し、その結果発光する(図1A)。海パンジーRenilla reniformis由来のルシフェラーゼは、トランスフェクション効率を正規化し、遺伝子制御と機能を研究するための第二のレポーターとして、多重ルシフェラーゼアッセイでしばしば使用される。レニラ・ルシフェラーゼは、酸素によるコエレテラジン酸化を触媒して光を生成する(図1B)。
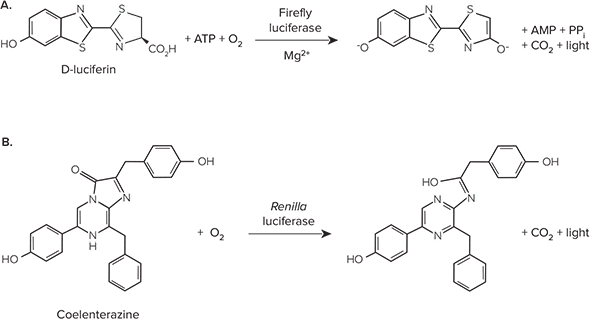
図1. (A)ホタルルシフェラーゼと(B)レニラルシフェラーゼが触媒する生物発光反応。
SpectraMax® DuoLuc™ リポーターアッセイキットは、哺乳動物細胞中のホタルおよびレニラのルシフェラーゼを高感度に定量することができます。最適化された2種類の検出試薬を連続注入することにより、同じマイクロプレートウェル内でルシフェラーゼをアッセイすることができます。ホタルの作用液をインジェクションで自動添加すると、ホタルルシフェラーゼの発光反応が開始され、その後2回目のインジェクションでレニラの作用液を添加すると、ホタルの発光が消光され、Aquaphile™ コエンテラジンが添加されてレニラの反応が開始されます。その結果、2シグナルアッセイシステムとなり、コントロールに対する実験シグナルの標準化が可能となる。このアッセイはSpectraMax® i3x Multi-Mode Microplate Reader with Injector Cartridge and SmartInject™との使用に最適です。
材料
- SpectraMax DuoLucレポーターアッセイキット(Molecular Devices社、カタログ番号R8361)
- HeLa細胞 (ATCC cat. #CCL-2)
- pGL4.13[luc2/SV40] ホタルルシフェラーゼ発現ベクター (Promega cat. #E668A)
- pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター (Promega cat. #E693A)
- ViaFect™ Transfection Reagent (プロメガ社、商品番号E4981)
- Opti-MEM 還元血清培地(サーモフィッシャーサイエンティフィック cat.)
- SpectraMax i3x マルチモードマイクロプレートリーダー
◦SmartInject付きSpectraMaxインジェクターカートリッジ
方法
細胞トランスフェクション
HeLa細胞を6ウェル組織培養処理プレートに1ウェルあたり2x105細胞で播種し、トランスフェクションの前に37℃/5% CO2で24時間インキュベートした。pGL4.13[luc2/SV40]ホタルルシフェラーゼ発現ベクターをOptiMEM培地で1μg/μLに希釈し、pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクターを100ng/μLに希釈した。3本のチューブを以下のようにセットし、穏やかに混合した: 400μLのOpti-MEM培地+2μL(2μg)のpGL4.13[luc2/SV40]ホタルルシフェラーゼ発現ベクター+2μL(2ng)のpGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター。各チューブに6μLのViaFect試薬を加え、内容物を軽く叩いて混合した。チューブを室温で10分間インキュベートし、複合体を形成させた。200µLのトランスフェクション複合体を6ウェルプレートの各ウェルに滴下し、軽く振り混ぜた。
細胞はトランスフェクション後48時間、37℃/5% CO2でインキュベートされ、その後アッセイのために採取された。
細胞溶解物の調製
6ウェルプレートにトランスフェクトした細胞をトリプシン処理し、10個のアリコートに分け、1500rpmで5分間ペレット化し、PBSで1回洗浄した。PBSを除去し、細胞ペレットをアッセイ時まで-80℃で保存した。
アッセイ準備のため、Passive Lysis Bufferと細胞ペレットを室温に温め、各細胞ペレットを150μLのPassive Lysis Bufferで溶解した。細胞溶解は室温で15分間行った。その後、溶解液を Passive Lysis Buffer で 1:2 に連続希釈し、ウェルあたり 12~8700 個の細胞に相当する濃度の標準曲線を作成した。各濃度の細胞溶解液20 µLを白色96ウェルプレートの3連ウェルにピペッティングした。
ルシフェラーゼアッセイのセットアップ
キットの全成分を室温まで解凍した。Firefly Substrateは、2.2mgの凍結乾燥基質を含むバイアルに220μLの水を加えて再構成した。Aquaphile coelenterazineは、440 µgの凍結乾燥基質を含むバイアルに220 µLの水を加えて再構成した。注:記載されている再構成量はExplorer Kitのものです。他のキットサイズについては、製品添付文書をご参照ください。
ホタル作業液は、ホタル基質をホタルアッセイバッファーで1:50に希釈して調製した。レニラ作業溶液は、Aquaphile coelenterazineをレニラアッセイバッファーで1:50に希釈して調製した。96ウェルプレート1枚につき、220μLのそれぞれの基質を加えて11mLの作業溶液を作製した。
SoftMax® Proソフトウェアであらかじめ設定されたSpectraMax DuoLucアッセイプロトコルを用いて、以下のパラメータでアッセイを実行し、結果を解析した:
- テキストインジェクター 1 を使用し、100 µL のホタルワーキング溶液をウェルに添加します。
- 2秒遅らせて反応を発現させる。
- 積分時間 5 秒でホタルの発光を測定する。
- インジェクター 2 を使用し、100 µL のレニラ作業溶液をウェルに添加します。
- 2秒間遅延させて反応を展開させる。
- 積算時間 5 秒でレニラ発光を測定する。
- 各アッセイウェルについて、1 回目の測定値(ホタルルシフェラーゼ)と 2 回目の測定値(レニ ラルシフェラーゼ)の RLU 値を正規化する。
SpectraMax DuoLuc Reporter Assay Kit の性能を競合他社のデュアルルシフェラーゼレポーターアッセイと比較した。
細胞溶解物の調製
6ウェルプレートにトランスフェクトした細胞をトリプシン処理し、10個のアリコートに分け、1500rpmで5分間ペレット化し、PBSで1回洗浄した。PBSを除去し、細胞ペレットをアッセイ時まで-80℃で保存した。
アッセイ準備のため、Passive Lysis Bufferと細胞ペレットを室温に温め、各細胞ペレットを150μLのPassive Lysis Bufferで溶解した。細胞溶解は室温で15分間行った。その後、溶解液を Passive Lysis Buffer で 1:2 に連続希釈し、ウェルあたり 12~8700 個の細胞に相当する濃度の標準曲線を作成した。各濃度の細胞溶解液20 µLを白色96ウェルプレートの3連ウェルにピペッティングした。
アッセイ性能
SpectraMax DuoLuc Reporter Assay Kitを用いた細胞サンプルの相対発光単位は、試験した全範囲においてサンプル濃度に直線的に比例し、得られた標準曲線のr2値は1.0であった(図2)。CV値はすべての反復測定で4%以下であった(n=3)。直線性の高いデータと低い%CV値の利点は、幅広い細胞応答におけるルシフェラーゼ発現の違いを正確に検出できることである。これにより、シグナル伝達、タンパク質間相互作用、その他多くの分野での科学的発見につながる、実験的細胞条件に対する小さな応答の同定が可能になる
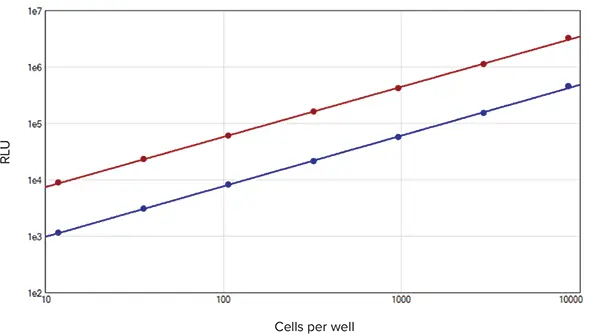
図2. セルベースアッセイ標準曲線。
ホタル(赤プロット)とレニラ(青プロット)の標準曲線は、SoftMax Proソフトウェアの対数-対数曲線フィットを用いてプロットした(それぞれr2 = 1.0)。各細胞数でN=3反復。
SpectraMax DuoLucレポーターアッセイキットを用いて得られた標準曲線は、競合他社のデュアルルシフェラーゼレポーターアッセイの標準曲線と同等である(図3)。低い%CV値、インジェクターチューブへの試薬の非吸収、レニラ基質添加時のホタルシグナルの適切な消光など、デュアルルシフェラーゼアッセイに使用される装置に要求される性能基準は、SpectraMax DuoLucレポーターアッセイキットを使用したインジェクターカートリッジ付きSpectraMax i3xで満たされています(データは示されていません)。
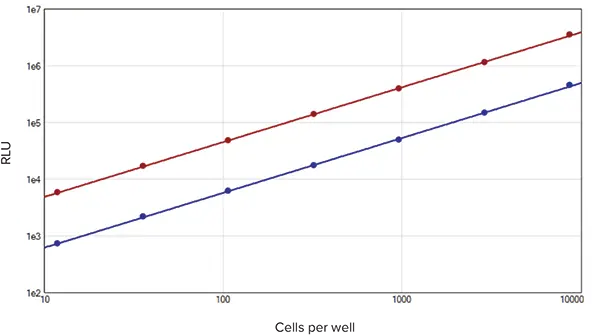
図3. 競合他社のデュアルルシフェラーゼレポーターアッセイのデータ。
RFU値および直線性は、SpectraMax DuoLucレポーターアッセイキットで示されたものと同等である。各細胞数でN=3反復。
SoftMax Proソフトウェアには、あらかじめ設定されたアッセイプロトコルが用意されており、各ウェルのホタル発光をレニラ発光で割ることにより、正規化されたルシフェラーゼ値を計算するという利点があります。結果はグループ表に表示され、結果の共有や発表のために簡単にグラフ化することができます。ここでテストした細胞溶解物の正規化値を図4に示す。これらは、今回アッセイした濃度範囲で一貫しており、ウェル内の細胞数が変動しても、アッセイ結果は一貫していることが実証された。
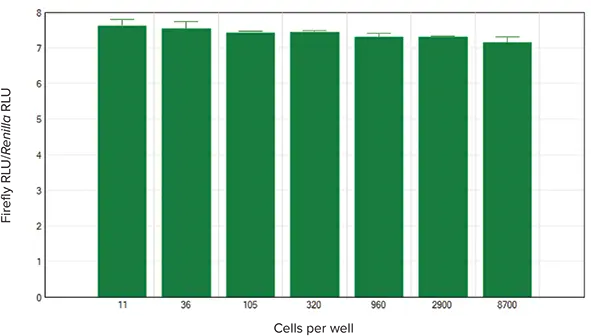
図4. 正規化ホタル発光単位対細胞濃度。
細胞濃度。SoftMax Proソフトウェアが自動的に計算し、ホタルルシフェラーゼの発光値をレニラの値に対して正規化してグラフ化した。各細胞数でN=3反復。
結論
SpectraMax DuoLucレポーターアッセイは、インジェクターカートリッジ付きSpectraMax i3xリーダー上で性能が最適化されています。データ取得と解析を簡略化するための設定済みプロトコールと、SoftMax Proソフトウェアにより、高速、高感度、高信頼性のデュアルルシフェラーゼレポーターアッセイ結果を得るためのトータルソリューションが完成します。
参考文献
- Alam, J. and J.L. Cook. 1990. Anal. Biochem. 188:245-254.
- Bronstein, I., et al. 1994. Anal. Biochem. 219:169-181.
- Gould, S.J. and S. Subramani. 1988. Anal. Biochem. 175:5-13.
- Brasier, A.R., et al. 1989. BioTechniques. 7:1116- 1122
- Bhaumik, S., et. al. (2004) J Biomed Opt. 9, 578-86.
- Matijasevic, Z., et. al.(2001) Carcinogeneis. 22, 661-4.
- Nieuwenhuijsen BW., et.al. (2004) J Biomol Screen. 8, 676-84
- Matthews, J.C., Hori, K. and Cormier, M.J. (1977) Biochemistry 16, 85-91
PDF版(英語)