Application Note ハイコンテンツイメージングによる均一抗体結合アッセイ
- nowashアッセイで効率を上げ、無駄を省く
- 接着細胞、浮遊細胞、ビーズを用いたアッセイを実施可能
- あらゆる波長の蛍光ラベルを使用可能
- 低濃度の抗原を検出するための優れた感度
はじめに

均一な抗体結合アッセイの開発により、細胞およびビーズアッセイのハイスループット、高含量分析の効率が向上しました。このような洗浄不要のフルオロメトリック・マイクロボリューム・アッセイ技術(FMAT)ベースのアッセイでは、従来のアッセイで必要であった複数の洗浄工程が不要になるため、細胞損失が減少し、少ない細胞数で迅速なスクリーニングが可能になります。
診断、ワクチン、治療開発における抗体探索プロセスの一環として、研究者はハイブリドーマ細胞やコロニーをスクリーニングし、高発現クローンを選択したり、細胞表面でのリガンド結合を測定したり、細胞内でのリガンドや抗体の内在化を観察したりします。従来のFMATアッセイの利点に加え、ImageXpress® Micro Widefield High Content Screening Systemで実施する均一抗体結合アッセイでは、細胞表面でのリガンド結合を検出し、同一プレートウェル内で異なる細胞をマルチプレックスすることができます。このシステムはまた、1536ウェルプレートへのスケールアップの道筋を提供します。必要なサンプル量はわずか2~3μLであり、既存の検出限界を維持またはさらに向上させながら、より低い二次抗体濃度を使用できます。
アッセイ形式
抗体はビーズ表面に捕捉され、蛍光標識二次抗体でタグ付けされる。蛍光イメージングを用いて、捕捉された抗体の量を測定する。同様のアッセイは、細胞表面でのリガンド結合や、リガンドや抗体の内在化を測定するために行うことができる。
ホモジニアス抗体結合アッセイ(図1)では、接着細胞、浮遊細胞、 抗体固相化ビーズを96、384、1536ウェルプレートに添加する。次に、目的のマーカーに対する一次抗体を添加し、続いて、細胞やビーズに結合した一次抗体を検出するための二次抗体を添加する。
図1. 均一抗体結合アッセイ
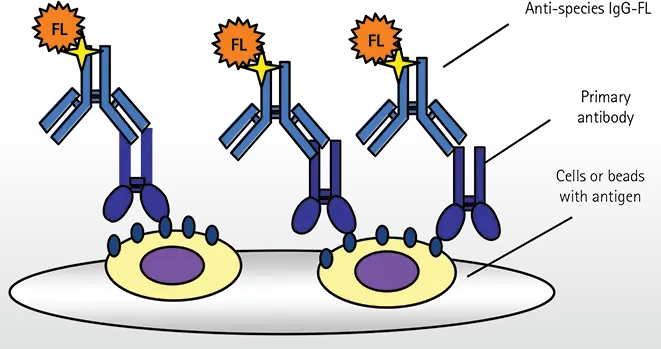
底が透明なポリスチレンプレート 全てのアッセイ試薬はマイクロプレートウェルに添加され、その間洗浄工程はありません。プレートウェルの底面に位置する細胞や抗体コートビーズは、バックグラウンド蛍光が高いウェルでも同定され、測定されます。
直線性と検出限界
この最初の実験では、一次抗体を様々な濃度で滴定し、7 µmビーズに結合させた。次に分析物を添加し、続いて二次抗体を添加し、ビーズをImageXpress Micro Systemで画像化した。従来のFMATアッセイでは、検出は赤(Cy5)チャンネルに限られていました。ImageXpress Micro Systemで行う均一アッセイでは、複数の波長を検出できるため、どのような二次抗体タグでも使用できます。この滴定実験では、二次抗体は DyLight 488 で標識した。
MetaXpress® High Content Image Acquisition and Analysis SoftwareのCount Nuclei Moduleを用いた画像解析により、検出下限(LLD)は0.5 ng/mL(30 pg/well)、直線応答は約1-31 ng/mLであった。この一次抗体滴定実験の曲線は、均質抗体結合アッセイに関連するよく知られたプロゾーンまたは「フック効果」を示す。この曲線上部のシグナルの落ち込みは、培地中の過剰な未結合の一次抗体が二次抗体と結合し、細胞やビーズに結合できなくなるために起こる(図2)
Figure 2. Primary antibody titration curve
図2. 一次抗体滴定曲線
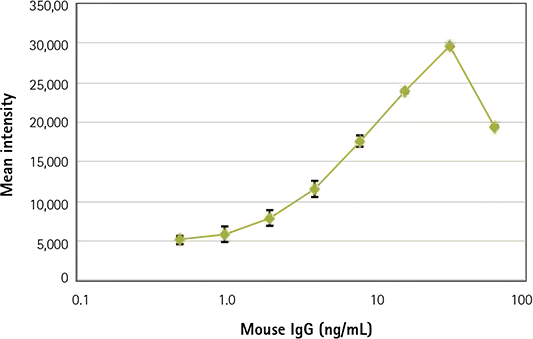
ビーズホモジニアスアッセイの一次抗体結合曲線(上)。ウェルは4重反復で行い、12列目にアイソタイプ抗体コントロールを入れた。ヤギ抗マウス抗体でコートした 7 µm のビーズを様々な濃度のマウス IgG 分析物と結合させ、マイクロプレートのウェルに添加した後、AlexaFluor488 標識二次抗体を添加し、室温で 1~2 時間インキュベートした。プレートを10倍のPlanFluor対物レンズで撮像した。ウェルのサムネイル画像(下)は、結合の用量反応を明確に示している。解析の結果、0.5ng/mL(30pg/ウェル)のLLDが得られ、1~31ng/mLの間で直線的な反応が見られた。
細胞応答をより正確に決定するための多波長分析
蛍光画像に加えて、ImageXpress Micro System は透過光(TL)画像も取得でき、細胞をより正確に同定することができる。このセルベースアッセイの例では、細胞のTL画像と蛍光画像の両方を取得し、MetaXpressソフトウェアのカスタムモジュールを使用して細胞を同定した。
同じウェルの蛍光画像から、抗体 が細胞表面に結合している場所が特定できるが、蛍光画像と透過光画 像を重ね合わせると、すべての細胞に抗体が結合しているわけでは ないことがわかる(図3左上)。その後の画像解析により、抗体結合が陽性であった細胞は適切に同定された(図3右上)。別のウェルで撮影したCy5画像は高い蛍光シグナルを示し、抗体結合が陽性であることを示している。しかし、透過光と蛍光画像を重ね合わせると、このウェルの蛍光は細胞と関連していないことがわかる(図3左下)。完全な画像解析により、検出された蛍光シグナルは細胞に関連しないアーチファクトによるものであることが確認されたため、これらの細胞は陰性と判定された(図3右下)
図3. 透過光を用いたより正確な画像解析

上:Cy5(赤)画像と透過光(半透明)画像を重ね合わせると、抗体結合陽性と陰性両方の細胞が存在することがわかる(左)。解析セグメンテーションにより、抗体結合陰性細胞は黄色、抗体結合陽性細胞(Cy5チャンネル)は青色で表示され、重複部分は白色で表示される(右)。下: Cy5(赤)と透過光(半透明)画像の重ね合わせにより、細胞とは無関係な蛍光アーチファクト(左)の存在を示す。解析の結果、抗体結合が陰性であった細胞は黄色、Cy5が陽性であったが関連する細胞がなかったもの(右)はピンク色で、アーチファクトであることがわかる。
アッセイ開発実験は、二次抗体濃度の最適化のために簡単に行うことができます。この例では、3つの異なる濃度の二次抗体を、広い範囲の一次抗体濃度で実施した。プロットされた結果も、前回のビーズアッセイと同じ「フック効果」を示している(図4、上)。二次抗体濃度0.25 µg/mLでの検出下限は0.5 ng/mLで、標準的なFMATの測定値と同じでした。3種類の二次抗体濃度とも、滴定範囲にわたって直線的であることが確認された(図4、下)
図4. 最高の感度を得るための検出試薬の最適化
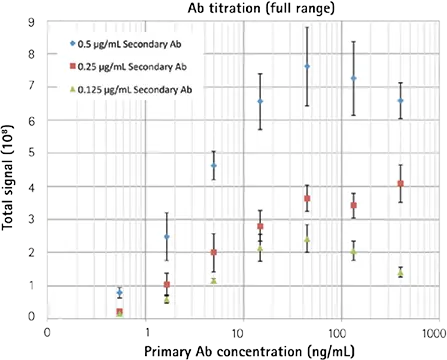
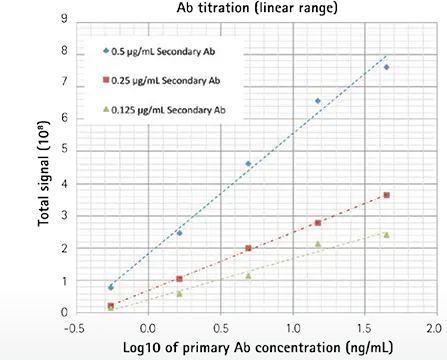
上:3種類の二次抗体濃度を用いた一次抗体の滴定(x軸)。下: 結果は、分析対象物(一次抗体)の5希釈にわたって直線的な反応を示し、LLDは0.5 ng/mLとなった。
ホモジニアスアッセイのイメージングにより、より柔軟な対応が可能になる
ImageXpress Micro SystemとMetaXpress Softwareを用いた均一抗体結合アッセイのハイコンテントイメージングは、従来のFMATアッセイよりもさらに多くの情報を提供します。一般的なアッセイのアーチファクトを除去することで、細胞応答を迅速かつ明確に同定することができ、よりクリーンで正確な結果が得られます。さらに、細胞表面上のリガンド結合を検出する能力を維持しながら、任意の波長での二次標識の検出、同一プレートウェル内での異なる細胞の多重化、アッセイ感度を損なうことなく1536ウェルプレートまでスケールアップする柔軟性を得ることができる。
ImageXpress Microについて詳しくはこちら >>