Application Note 均一性ハイスループット生細胞GPCR結合アッセイ
PDF版(英語)
はじめに
ライブセルスクリーニングのために

Molecular Devices社は、蛍光測定を用いたマルチウェルプレート内の細胞のマルチパラメトリックスクリーニングのための強力な新しいスクリーニングプラットフォーム、ImageXpress® Velosシステムを開発しました。ImageXpress Velos システムの光学系は、検出領域が限定されているため、蛍光が収集される領域が、接着細胞が存在するサンプルプレーン近傍に限定されます。これにより、バックグラウンド蛍光が減少し、細胞結合シグナルの測定が向上します。このシステムは、フォーカスを合わせる必要なく、プレート全体にわたって鮮明な画像を収集することができ、プレートのウェル密度に関係なく、10ミクロンの解像度でプレート全体を120秒でスキャンします。これらの特長により、ImageXpress Velosシステムは、ハイスループットのライブセル結合アッセイに理想的です。
本報告では、ImageXpress Velosシステムレーザースキャニングプラットフォームを用いて、M1ムスカリン性アセチルコリン受容体を発現するチャイニーズハムスター卵巣(CHO)細胞へのCy3標識テレンゼピン(Cy3-TP)のライブセルバインディングアッセイを実証した。この重要なGタンパク質共役型受容体(GPCR)からの特異的結合、Cy3標識非ペプチドリガンドの競合および置換を示すために、アトロピンを用いて選択性を評価した。
アッセイ手順
セル播種とCy3-TP結合アッセイ手順。ライブセル結合アッセイは96ウェル黒壁Packard Viewプレートで行った。プレートには、M1ムスカリン性アセチルコリン受容体を発現するCHO細胞(セルおよび試薬はAmgen社(Thousand Oaks)から提供)を播種した。マルチウェルプレートは、使用前に5% CO2インキュベーター内で37℃でインキュベートした。細胞結合反応は、96ウェルプレートを用いて室温で行った。
オンレート手順。オンレート研究では、細胞を40μlの2μMアトロピン単独または併用封じ込め、続いて40μlの10nM(最終濃度)のCy3-TPに曝露した。なお、最終アトロピン濃度は1μMであった。プレートは、最初の30分間は5分ごとに、その後135分までは10分ごとにスキャンした。
Cy3-TP結合の選択性。セルを40μlの指示濃度のアトロピン、続いて40μlの8nM Cy3-TPに曝露した。この結果、競合試験の最終濃度は4nMとなった。結合の60分後にプレートをスキャンした。
Cy3-TP結合の検出。ImageXpress Velosシステムレーザースキャニングプラットフォームは、560-610nm(オレンジ)バンドパスフィルターを用いたCh3によるCy3蛍光の1チャンネル取得用にセットアップされた。画像取得は5×5ミクロンサンプリングで行い、96ウェルプレート全体をスキャンした。
生細胞染色とCMFDAの検出。生細胞蛍光色素5-クロロメチルフルオレセインジアセテート(CMFDA)はInvitrogen社(Carlsbad, CA)から入手し、結合反応後の細胞を標識するために0.1μMで使用した。簡単に言うと、CMFDAの2X溶液をバッファーで調製し、80μlを各ウェルの結合反応に添加した;この結果、0.1μMのCMFDAの最終容量は160μl/ウェルとなった。細胞をCMFDAとともに室温で30分間インキュベートした後、Ch1 510-540nm(緑)バンドパスフィルターを用いてスキャンした。画像取得は5×5ミクロンサンプリングで行い、96ウェルディッシュ全体をスキャンした。
結果と考察
オンレートの結果。細胞を5000個/ウェルで播種し、選択したウェルに40μlの結合バッファー単独または2μMのアトロピンを封じ込め、その後40μlの終濃度10nMのCy3-TPを作用させた。プレートはImageXpress Velosシステムで均一性フォーマットで複数の時点でスキャンした。10nMのCy3-TPでインキュベートした細胞の結合時間コースの代表的な画像を図1(トップパネル)に示す。Cy3-TP応答は、各ウェルの中心に直径4 mmの関心領域(ROI)を定義し、そのROI内のCy3シグナルを閾値処理し、Cy3蛍光の総量を積分し、バックグラウンドシグナル値(ROI内の閾値を超えないシグナル)を差し引くことで評価した。結合反応に10 nM Cy3-TPを用いた場合、陽性コントロール(アトロピン(Atr)なし)と陰性コントロール(1 μM Atr)の間で優れた識別が観察された(図1)。
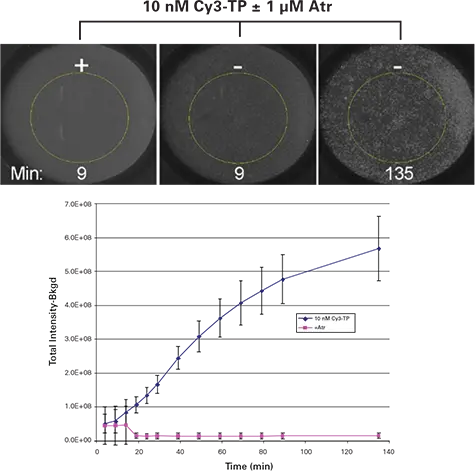
図1.
トップパネル: 表示濃度のCy3-TPでインキュベートしたウェルのホモジニアスCy3-TP結合アッセイのImageXpress Velosシステム画像。黄色の円は、画像解析に使用した 4 mm ROI。下のグラフ: ホモジニアスCy3-TP結合アッセイの結果。数値は各条件における4反復の平均値と標準偏差を表す。(Atr = アトロピン)
Cy3-TP結合の選択性。ホモジニアスCy3-TP結合アッセイにおけるアトロピン濃度応答曲線をホモジニアスアッセイフォーマットで評価した。アトロピン濃度による明確な傾向が観察されたが、低アトロピン濃度でのシグナルの飽和は認められず、細胞正規化の方法が結合アッセイを改善することが示唆された。全細胞数に正規化するため、細胞を3.7%ホルムアルデヒドを封じ込め たPBSで固定し、0.1μg/mlのヨウ化プロピジウム(PI)で染色した。プレートをスキャンし、650nmのロングパスフィルターを用いてPIシグナルを別チャンネルに集めた。これにより、Cy3シグナルとの優れた識別が可能となった。PIシグナルを閾値処理することでセルを同定し、SB比を差し引いた平均Cy3反応を算出した。これにより、ウェル全体の正規化されたCy3-TP応答が得られる。この方法で決定されたアトロピン応答曲線を、10種類のアトロピン濃度と1種類のブランク(明瞭化のため0.016nMでプロット)について図2に示す。
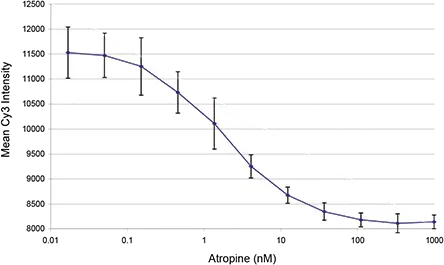
図2.
固定・染色細胞を用いたCy3-TP結合アッセイにおけるアトロピン濃度応答曲線。値は各条件における8反復の平均値と標準偏差を表す。明瞭化のため、アトロピン無添加のウェル値を0.016nMで示す。
セル正常化のためのCMFDA染色。2倍濃度のCMFDAを封じ込めた等容量のバッファーを加える、より効率的なワンステッププロセスが示された(図3)。結合反応後、細胞を0.1μMのCMFDAで室温で30分間標識し、510-540nmのバンドパスフィルターを用いてCMFDAシグナルを別のチャンネルに集めた。図3に示すように、CMFDA標識細胞はCMFDAシグナルの閾値処理によって同定された。このように、シンプルなワンステッププロセスにより、バックグラウンド減算した平均Cy3応答を計算し、ROI全体の細胞について正規化することができる。
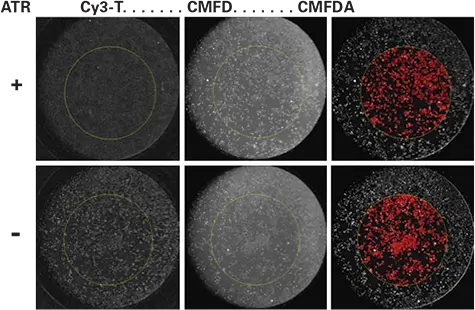
図3.
全細胞数に対するCy3-TP結合の正規化。上のパネルは、2μMのアトロピンを投与したウェルと、8nMのCy3-TPを封じ込めた溶液を添加する直前のバッファーのみのウェル(下のパネル)を示している。結合反応の最終濃度は1μMアトロピンと4nM Cy3-TPである。Cy3-TPを標識した画像は、結合反応後にプレートをスキャンして得られた。中央の画像は、30分間の室温インキュベーション後、画像処理前のCMFDA標識セルである。右の画像は画像処理後のCMFDA標識セルで、赤色は4 mm ROI内の閾値対物レンズ。Cy3-TP結合の正規化には総面積値を用いた。
Off-Rateの結果 2500細胞/ウェルで播種したセルを用いてOff-Rate試験を行った。細胞は4nM Cy3-TPで1.5時間インキュベートされ、その後100nMアトロピンから始まる連続1:3希釈液が添加された。オフレート試験はホモジニアスで行われ、データは2時間にわたって一定間隔で収集された。Cy3-TPシグナルの変化率(5分時点との相対値)が計算され、オフレート値は予想通りアトロピン濃度とともに増加することがわかった。Cy3-TPシグナル減少の線形反応は、高アトロピン濃度で認められた(データは示さず、原稿準備中)。
結論
本報告では、ImageXpress Velosシステムレーザースキャニングプラットフォームを用いて、M1ムスカリン性アセチルコリン受容体を発現するCHO細胞へのCy3-TPのライブセルバインディングアッセイを実証した。Cy3-TPの特異的結合、競合、置換を示すためにアトロピンを用いた。ホールウェルの画像は、統合された画像解析プログラムによって処理され、競合結合曲線、オンレート、オフレートの結果が生成された。ROI内のセルカバレッジのウェル間差に起因するデータの質を改善するために、全細胞面積に正規化する簡単なワンステップ手順が示された。ここで発表された結果は、ImageXpress Velosシステムが、マルチウェルプレート中のライブセル中のGPCRをスクリーニングするためのハイスループットプラットフォームの基盤を提供することを示している。このプラットフォームのユニークな光学系とスキャニング・エンジンにより、シンプルな "プラグ・アンド・プレイ "アプリケーションが可能になり、以下のような要求に応えることができる。
PDF版(英語)