Application Note FLIPRカルシウム5アッセイキットによる
GPCRアッセイ用ホモジニアス溶液
- 競合染料やキットを凌駕するシグナル対ノイズ比
- Zファクター > 0.9
- 凍結細胞でもウェル間のばらつきが少ない
- 真のホモジニアスプロトコール、混ぜて読むだけ
PDF版(英語)
はじめに
細胞ベースアッセイは、初期の創薬プロセスにおけるスクリーニングや化合物プロファイリングに不可欠な手法となっている。今日まで、このようなアッセイは、受容体の特性評価研究、一次スクリーニング・キャンペーン、化合物プロファイリング・プログラムにおいて、最も信頼性が高く、再現性の高い手法の一つであることが証明されている。
特にGq共役型GPCRターゲットに対しては、マスキング技術を用いた均一性蛍光カルシウム流動アッセイが選択される方法である。FLIPR®カルシウム5アッセイキットのようなこれらのアッセイは、図1に見られるように、マスキング技術により細胞外バックグラウンドが減少するため、色素ロード後の洗浄が不要である。市販されているアッセイの中には、洗浄不要のアッセイとして指定されているものもあります。しかし、マスキング技術を使用していないため、バックグラウ ンドが非常に高く、シグナルウィンドウが乏しい傾向があり、内因性あるいは低発現レベルの系からの小さな反応を検出することが困難である。アロステリックモジュレーターの研究に必要なアゴニストのEC30濃度を算出したり、受容体発現量の低い内在性セル株を使用したりするには、ホモジニアスアッセイで得られるシグナルウィンドウを大きくすることが望ましい。
無洗浄アッセイに加え、多くの研究者は蛍光色素を使用しているが、この蛍光色素は色素負荷ステップの後に洗浄しなければならない。一部の標的はこの洗浄ステップの後に良好な反応を示すが、これらのアッセイは高輝度であり、時間がかかり、ウェル間変動や日間変動が大きい。さらに、このような洗浄法をハイスループットスクリーニングモードにスケールアップするには大きな課題がある。
FLIPRカルシウム5アッセイキット
FLIPRカルシウム5アッセイキットは均一性蛍光試薬キットで、従来の洗浄法アッセイやバックグラウンドの高い他の無洗浄色素を使用する際の課題を解決します。このアッセイキットは、マスキング技術が細胞外に留まり、バックグラウンド蛍光を抑制する一方で、色素ロードステップ中に細胞質内に取り込まれるカルシウム蛍光色素を使用することで機能する。レセプターとリガンドが結合すると、カルシウムは細胞質に放出され、色素と結合して蛍光シグナルを増加させる(図1)。
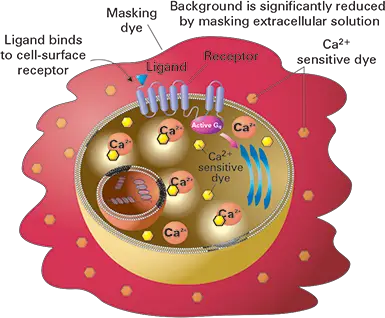
図1. FLIPRカルシウム5アッセイキットの原理。GPCR活性化反応中、放出されたカルシウムが新規蛍光団に結合すると、細胞内の蛍光シグナルが増加する。バックグラウンドシグナルは細胞外マスキング技術により最小化され、SB比が向上する。
FLIPR Calcium 5 Assay Kitのマスキングテクノロジーは、ダイナミックレンジと優れたシグナル/バックグラウンド比を提供し、アッセイデータの忠実性の向上に貢献します。洗浄が不要なため、ウェル間のばらつきが減少し、アッセイの品質(Zファクター)と信頼性(CV %)が向上します。その結果、FLIPRカルシウム5アッセイキットは、レセプターの発現が低いセル株を用いたアッセイ、内因性に発現するレセプターを調べるアッセイ、およびカルシウム応答が小さいその他のターゲットを調べるアッセイに特に有益です。
材料と方法
FLIPR Tetra®システムを用いたカルシウム流動アッセイ
ここに示した実験データでは、1321N1セル(ECACCカタログ番号86030402)に低レベルで発現している内因性ムスカリン受容体を調べるアッセイ法をFLIPRカルシウム5アッセイキットを用いて開発し、他の入手可能なキットと比較した。アッセイ準備の整った "凍結細胞は、多くの生物学的アッセイにおいて、培養細胞の代わりに適しており、頻繁に使用されている。FLIPR Calcium 5 Assay Kitと凍結細胞を組み合わせることで、アッセイワークフローが加速され、より少ない実験ステップと少ない作業時間でスループットがさらに向上します。
1321N1細胞を急速に解凍し、黒壁透明底384ウェルマイクロプレートにウェル当たり約13,000個プレーティングし、37℃、湿度95%、CO2 5%で一晩培養した。翌日、セルプレートに、メーカーの推奨に従って適切なカルシウム試薬(水溶性プロベネシドを含む)をプレーティングし、60分間インキュベートした。
比較に使われたカルシウム指標は以下の通り:
- FLIPRカルシウム5アッセイキット(Molecular Devices社製)
- Fluo-4 AM カルシウムインジケーター(ライフテクノロジーズ社製)
- Fluo-4 NWカルシウムアッセイキット(Life Technologies社製)
- Fluo-4 ダイレクトカルシウムアッセイキット(Life Technologies社製)
- FluoForteカルシウムアッセイキット(Enzo Life Sciences社製)
- Screen Quest Rhod-4 No Washカルシウムアッセイキット(AAT Bioquest社製)
Fluo-4 AM を添加したセルプレートは、60 分間のインキュベーション後、HBSS/HEPES で 3 回洗浄した。
FLIPR Tetraシステムのセットアップ
セルプレートはFLIPR Tetraシステム内で37℃に保った。化合物はコーニング製384ウェルポリスチレンプレートに調製し、化合物の移動にはFLIPR Tetra Pipette Tips(黒)を使用した。FLIPR Tetraシステムの特異性パラメータを表1に示す。
| アセチルコリン | アトロピン | ||||
|---|---|---|---|---|---|
| EC50 | Z at EC80 | S/B | IC50 | Z | |
| FLIPR Calcium 5 |
1.2 x 10 -7 M |
0.93 | 331 | 9.8 x 10
-9 M |
0.94 |
| Fluo-4 AM |
4.5 x 10 -7 M |
0.42 | 232 | 該当なし | 該当なし |
| Fluo-4 NW |
1.8 x 10 -7 M |
0.53 |
245 | 6.9 x 10
-9 M |
0.34 |
| Fluo-4 Direct |
1.2 x 10 -7 M |
0.65 |
282 | 8.6 x 10
-9 M |
0.74 |
| FluoForte |
1.6 x 10 -7 M |
0.53 | 270 | 8.3 x 10
-9 M |
0.69 |
| Rhod-4 NW |
3.8 x 10 -7 M |
0.72 | 177 | 該当なし | 該当なし |
結果
より短い時間でより大きな信号ウィンドウ
アセチルコリンの単一濃度に対する個々のカルシウム色素の平均カイネティック応答は、図2に見ることができる。このデータから、新規の蛍光色素とマスキング色素の技術が、類似の競合アッセイキットやFluo-4 AMのような従来の色素、マスキング技術を利用しない無洗浄試薬と比較して、いかに多くの利点をもたらすかがわかる。シグナルの大きさはFLIPRカルシウム5測定キットの方が有意に高く、他の試薬とは異なり、添加アーチファクトは観察されなかった。さらに、標準誤差バーは小さく、より最適化されたプロトコールであることが示唆された。
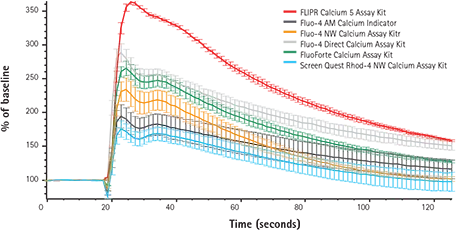
図2. FLIPR Tetraシステムのカイネティックトレース。FLIPRテトラシステムによるアセチルコリンによる内因性ムスカリンM3-受容体のアゴニズムの代表的なシグナルトレースを、異なるカルシウムアッセイキットを用いて比較したもの。
図3は、FLIPR Tetraシステムで各種カルシウム測定キットを用いて作成したアセチルコリン濃度反応曲線を示している。Fluo-4 AMカルシウムインジケータとRhod-4 NWカルシウムアッセイキットを用いた場合、わずかに右方シフトが観察されたものの、試験したすべてのアッセイキットでほぼ一貫したEC50値が得られた。EC50値、Z値、シグナル/ベースライン(S/B)値を表2に示す。FLIPRカルシウム5アッセイキットは、他の試薬と比較してシグナルウィンドウが大きく、薬理作用が一貫しており、Zファクターが改善されている。
| パラメータ | FLIPR Calcium 5 Assay Kit* | Rhod-4 NW Calcium Assay Kit |
|---|---|---|
| 励起波長 | 470–495 nm | 510–545 nm |
| 発光波長 | 515–575 nm | 565–625 nm |
| LEDインテンシティ | 80 % | 30 % |
| カメラゲイン | 2000 | 2000 |
| 露出 | 0.53秒 | 0.53秒 |
|
ゲート |
6.00 % | 6.00 % |
| インターバル | 1 秒 | 1 秒 |
| 分注量 | 12.5 µL | 12.5 µL |
| ディスペンス高さ | 35.0 µL | 35.0 µL |
| 吐出速度 | 30.0 µL/秒 | 30.0 µL/秒 |
| チップアップ・スピード | 20mm/秒 | 20mm/秒 |
| よく入るヒント | No | 発光波長 |
* Fluo-4 AM Calcium Indicator、Fluo-4 NW Calcium Assay Kit、Fluo-4 Direct Calcium Assay Kit、FluoForte Calcium Assay Kit も同じパラメータです。
表1. カルシウムアッセイ比較のためのFLIPR Tetraシステムパラメータ。
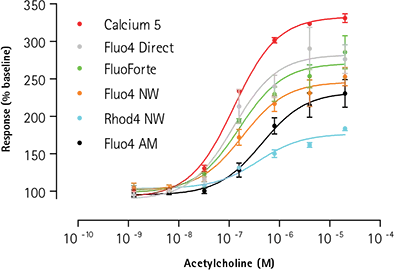
図3. カルシウムアッセイシグナルウィンドウの比較:アゴニズム。アゴニストアッセイ: 内因性ムスカリンM3受容体のアセチルコリン刺激時の「アッセイ準備完了」1321N1細胞の蛍光シグナルの比較。実績のあるマスキング技術を用いたFLIPRカルシウム5アッセイキットのSB比の向上が示されている。
同様の状況は、EC80濃度のアセチルコリンに対する反応を抑制するためにアトロピンを用いてアンタゴニストアッセイを行った場合にも観察される(図4)。表2にIC50とZ値の計算値を示すが、アゴニストアッセイと同様、FLIPRカルシウム5試薬はこれまでの研究と一致した薬理作用を示し、競合製品と比較してZファクターが改善されている。今回のアンタゴニスト試験で用いた実験条件下では、Fluo-4 AMとRhod-4 NWを負荷した細胞はアセチルコリンチャレンジに対して期待された反応を示さなかった。
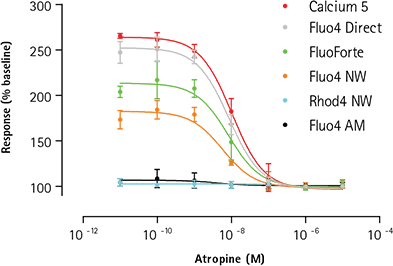
図4. カルシウムアッセイシグナルウィンドウの比較:拮抗作用。アンタゴニストアッセイ: FLIPRテトラシステムで6種類のカルシウム試薬を用いて評価した、「アッセイ準備完了」1321N1セルにおけるアセチルコリンのEC80チャレンジに対するカルシウム流動アッセイのアトロピン阻害。
結論
FLIPR Calcium 5 Assay Kitは、新規の蛍光色素と実績のあるマスキング技術を組み合わせることで、信頼性の高い薬理作用、より広いシグナルウィンドウ、アッセイ性能の向上を実現しています。FLIPR Calcium 5 Assay KitとFLIPR Tetraシステムを使用することで、様々なレセプターやターゲット、特にカルシウムシグナル応答が小さいレセプターの一貫したスクリーニングを、使いやすいホモジニアスフォーマットで行うことができます。FLIPR Calcium 5 Assay Kitは、96、384、1536ウェルフォーマットの接着細胞と非接着細胞の両方に対応しています。
PDF版(英語)