Application Note SpectraMax M5eリーダーを用いた
HTRF cAMPダイナミック2とIP-Oneアッセイ
- デュアルモノクロメーターベースのシステムの柔軟性
- 広いダイナミックレンジと優れたZ'ファクター
- SoftMax Proソフトウェアで設定済みのHTRFプロトコル
PDF版(英語)
はじめに
SpectraMax®M5eマルチモードマイクロプレートリーダーは、蛍光、時間分解蛍光(TRF)、蛍光偏光、吸光度、発光アッセイが可能なデュアルモノクロメーターです。また、HTRF®(ホモジニアス時間分解蛍光)認証も取得しており、ライフサイエンスや創薬研究の研究者は、TRF検出の柔軟性を高めることで生産性を向上させることができます。
HTRFは、蛍光共鳴エネルギー移動(FRET)とTRFの特徴を併せ持ち、ドナー蛍光体としてユーロピウム(Eu)クリプテートを、アクセプター蛍光体として修飾アロフィコシアニン(XL665)または低分子d2を使用します。相互作用する生体分子をクリプ酸ユーロピウムとd2で標識すると、ドナー蛍光体とアクセプター蛍光体の間でFRETが起こり、665 nmでモニターされる蛍光発光が生じるが、クリプ酸の励起エネルギーの大部分は620 nmの蛍光発光として放出される。ウェル間のばらつきは、665 nm と 620 nm の蛍光シグナルの比を利用するシスビオの特許取得済み HTRF 比計算を使用することで補正される。
SpectraMax M5ereader での HTRF アッセイ性能は、2 種類の HTRF アッセイキット、cAMP ダイナミック 2 と IP-One で実証されています。G タンパク質共役型受容体は、cAMP の調節と IP3 を介した細胞内カルシウムレベルの上昇という 2 つの主要な経路を通じてシグナルを伝達する。cAMP dynamic 2キットでは、Euクリプテート標識抗cAMPモノクローナル抗体とd2標識cAMPを用いてcAMPレベルを検出する。セルが産生するネイティブcAMPは、抗cAMP抗体クリプテートとの結合においてcAMP-d2と競合する。細胞内cAMPの増加はFRETの減少につながり、それは665 nmにおける蛍光の減少として検出可能である。IP-Oneアッセイも同様のフォーマットで、塩化リチウム存在下でシグナリング細胞内に蓄積するIP3のより安定な下流代謝物であるIP1に特異的なモノクローナル抗体を用いる。665nmにおける蛍光は、キャリブレーターまたは細胞溶解液中のIP1濃度に反比例する。本アプリケーションノートでは、cAMP dynamic 2およびIP-Oneキットを用いて作成した細胞ベースアッセイデータと標準曲線の両方を紹介します。これらのHTRFデータは、SpectraMax M5eリーダーで得られる優れたダイナミックレンジとZ'ファクター2を示している。
材料
- cAMPダイナミック2キット、1000テスト (Cisbio cat. #62AM4PEB)
- IP-Oneキット、1000テスト(Cisbio cat.)
- セルライン CHO-M1 (M1WT3; ATCC cat. #CRL-1985)
- フォルスコリン(Sigma cat.)
- 3-イソブチル-1-メチルキサンチン(IBMX;Sigma cat.)
- 塩化カルバモイルコリン(カルバコール;Sigma cat.)
- 白色384ウェルマイクロプレート(コーニング社製、カタログ番号3705)
- SpectraMax M5e マルチモードマイクロプレートリーダー (Molecular Devices)
注: SpectraMax M5eリーダーでHTRFアッセイを行う場合は、必ず白色マイクロプレートを使用してください。シグナルの検出を最適化するには、底が透明なマイクロプレートではなく、ソリッド白色マイクロプレートを使用してください。
方法
cAMPダイナミック2アッセイ
CHO-M1セルは、10%FBS、1%ペニシリン/ストレプトマイシン/L-グルタミン、200μg/mL G418を添加したHam's F12培地で培養した。cAMP dynamic 2アッセイは、懸濁状態のセルに対して行った。アッセイ当日に細胞をトリプシン処理し、添加物を含まないハムF12培地に再懸濁し、白色384ウェルマイクロプレートに1ウェル当たり10μLの容量で4,000個播種した。cAMP産生を刺激するため、検出試薬を添加する前に、細胞を最終濃度3 nM~1 mMのフォルスコリン10 µLで1時間処理した。ホスホジエステラーゼによるcAMP分解を阻害するため、IBMXを0.5 mMでアッセイウェルに添加した。
フォルスコリン処理1時間後、クリプテートコンジュゲートと溶解バッファー中のcAMP-d2、および抗cAMP抗体クリプテートを、製品添付文書に記載されているようにセルに添加した。未処理細胞を含むネガティブコントロールには、cAMP-d2を含まない抗cAMP抗体-クリプテートコンジュゲートと溶解バッファーを添加した。この FRET 陰性コントロールは、HTRF の添付文書に概説されているデルタ F 値を算出するために必要であった3。全サンプルおよび標準品の最終アッセイ量は 40 µL であったが、アッセイ量はマイクロプレートの種類に応じて調整することができる。
cAMPの標準品はHTRFダイナミック2の添付文書に記載されている方法で調製しました。cAMPの最終濃度は0.17~712 nMであり、cAMPを含まない陽性対照(FRETが最大)も含まれた。遊離cAMPからなるcAMPコントロールはアッセイ活性をモニターするために使用し、cAMPまたはcAMP-d2を含まない陰性(FRETなし)コントロールはΔFを計算するために使用した。抗cAMP抗体クリプテートをすべての標準品とコントロールに添加した。室温で1時間インキュベートした後、SpectraMax M5eリーダーでマイクロプレートを読み取った。(インストゥルメンテーションの設定は表1を参照)。
IP-Oneアッセイ
CHO-M1細胞は上記のように培養した。アッセイ前日、完全増殖培地中で、1ウェルあたり10,000~40,000個のセルを384ウェルマイクロプレートに播種した。翌日、細胞をカルバコール濃度15 nM~33 μMで刺激した(カルバコール濃度の調製には、塩化リチウムを封じ込めた刺激バッファーが用いられた)。1時間の刺激後、コンジュゲートと溶解バッファー中のIP1-d2、および抗IP1抗体クリプテートをウェルに添加した。未処理細胞を含むネガティブコントロールには、IP1-d2を含まない抗IP1抗体クリプテートとクリプテートコンジュゲートおよび溶解バッファーを添加した。最終的なアッセイ量は40μLであったが、cAMPアッセイと同様に、この量はマイクロプレートの種類に応じて調整することができる。
最終濃度 21.5~22,000 nM の IP1 標準物質は、IP-One HTRF の添付文書に記載されているように、再構成 IP1 標準物質を刺激バッファーで希釈して調製した。IP1-d2 はすべての標準品と IP1 陽性対照に添加し、陰性対照には IP1-d2 を含まないコンジュゲートと溶解バッファー を添加した。抗IP1抗体-クリプテートを全サンプルに添加した。室温で1時間インキュベートした後、マイクロプレートをSpectraMax M5eリーダーで表1に示す設定で読み取った。
| タイプを読む | エンドポイント | ||
|---|---|---|---|
| Read mode | 時間 解決 遅延 50 統合 400 トップ |
||
| 波長 | テーブル | ||
| Ex | Em | Cutoff | |
| 314 | 620 | 570 | |
| 314 | 668 | 630 | |
| 感度 | 読書: 100 PMT:オート |
||
| オートキャリブレーション | On | ||
| セトリング時間 | Off | ||
| キャリッジ速度 | Normal | ||
表1. SpectraMax M5eリーダーのインストゥルメンテーション設定
データ分析
cAMPアッセイとIP-Oneアッセイのデータは、Cisbio社のガイドラインに従い、SoftMax® Proソフトウェアを用いて解析されました。SoftMax Proソフトウェアの4種類のHTRFプロトコールは、現在利用可能なあらゆるタイプのHTRFアッセイのデータ取得と解析を簡素化するように設計されています。
FRETは以下のように計算された:
比=(シグナル665nm/シグナル620nm)×10000
デルタ比=標準またはサンプル比-Rationeg
(ここでRationegは陰性コントロールの比率)
デルタF%=(デルタR/Rationeg)×100
インストゥルメンテーション
デュアルモノクロメーターベースの SpectraMax M5e リーダー用に、波長、遅延、積分設定が最適化された。特に、XL665/d2 ドナーの最適な Emission 波長は、HTRF 製品情報に記載されている 665 nm ではなく、668 nm と決定された。
結果
cAMP細胞ベースアッセイでは、384ウェルマイクロプ レート(最終アッセイ容量40μL)に1ウェルあたり約4,000個のCHOM1セルを用いて最良の結果が得られた。最適な細胞密度は、細胞の種類や特異性アッセイ条件によって異なる可能性がある。細胞をフォルスコリンで1時間処理すると、EC50が11.4μM、Z'ファクターが0.86の用量反応曲線が得られた(図1)。シスビオのレシオメトリック公式を用いて算出したデルタF%値は47~707の範囲であり(表2)、cAMP標準曲線で観察された範囲と同様であった(図2、表3)。
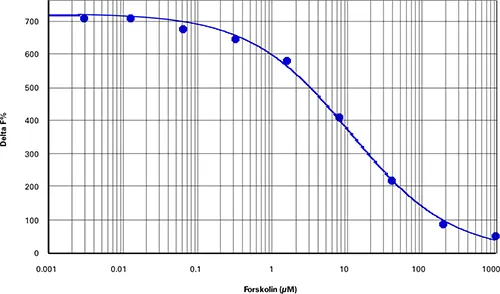
図1. cAMP細胞ベースアッセイ。CHO-M1細胞におけるフォルスコリンの用量反応(Z'=0.86、EC50=11.4μM)。
| フォルスコリン (µM) | 平均比率 | SDレシオ | CV % レシオ | 平均デルタF |
|---|---|---|---|---|
| 1000.000 | 762 | 30.7 | 4.0 | 47 |
| 200.000 | 951 | 29.2 | 3.1 | 83 |
| 40.000 | 1633 | 84.3 | 5.2 | 215 |
| 8.000 | 2623 | 137.7 | 5.3 | 406 |
| 1.600 | 3508 | 134.5 | 3.8 | 576 |
| 0.320 | 3854 | 303.3 | 7.9 | 643 |
| 0.064 | 4008 | 106.7 | 2.7 | 673 |
| 0.013 | 4186 | 154.0 | 3.7 | 707 |
| 0.003 | 4185 | 133.6 | 3.2 | 707 |
| 0 | 4459 | 204.3 | 4.6 | 760 |
表2. cAMP細胞ベースアッセイデータのまとめ
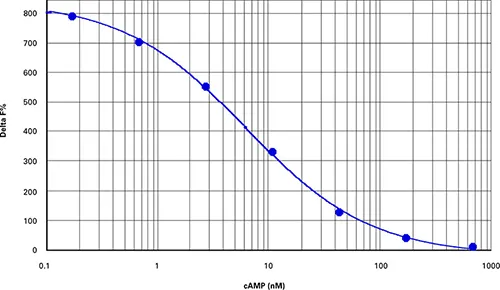
図2. cAMP標準曲線 cAMP標準曲線(Z'=0.84、EC50=6.3 nM、添付文書に記載された値と同等)。
| cAMP (nM) | 平均比率 | SDレシオ | CV % レシオ | 平均デルタF |
|---|---|---|---|---|
| 712.0 | 515.2 | 22.8 | 4.4 | 5.4 |
| 178.0 | 674.9 | 12.6 | 1.9 | 38 |
| 44.5 | 1089.9 | 59.8 | 5.5 | 122.9 |
| 11.1 | 2088.7 | 149.5 | 7.2 | 327.2 |
| 2.8 | 3166.8 | 83.6 | 2.6 | 547.7 |
| 0.7 | 3910.1 | 190.9 | 4.9 | 699.7 |
| 0.2 | 4341 | 98.6 | 2.3 | 787.8 |
| 0 | 4610.1 | 227.9 | 4.9 | 842.9 |
表3. cAMPダイナミック2アッセイ標準曲線データのまとめ。
IP-One細胞ベースアッセイでは、至適細胞密度は384ウェルマイクロプ レートの1ウェルあたりCHOM1細胞10,000個と決定された(最終アッセイ容 量は40μL)。カルバコールで1時間刺激すると、EC50が0.64μM、Z'ファクターが0.91の用量反応曲線が得られた(図3)。シスビオのレシオメトリック式を用いて計算したデルタF%値は3402から12539の範囲であった(表4)。(表4)。
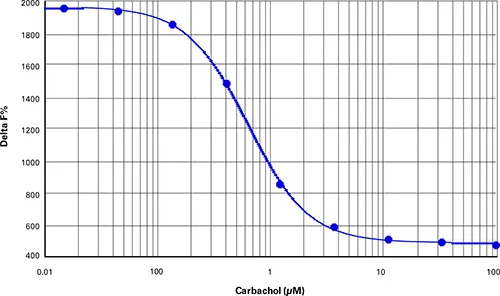
***図3. IP1細胞ベースアッセイ。
CHO-M1細胞におけるカルバコール用量反応曲線(Z'=0.91、EC50=0.64 µMカルバコール)。
| カルバコール (µM) | 平均比率 | SDレシオ | CV % レシオ | 平均デルタF |
|---|---|---|---|---|
| 100.00 | 3402 | 141.5 | 4.2 | 463 |
| 33.33 | 3538 | 68.8 | 1.9 | 486 |
| 11.11 | 3646 | 42.7 | 1.2 | 503 |
| 3.7 | 4105 | 25.5 | 0.6 | 579 |
| 1.23 | 5720 | 120.3 | 2.1 | 847 |
| 0.41 | 9517 | 143.6 | 1.5 | 1476 |
| 0.14 | 11733 | 397.9 | 3.4 | 1843 |
| 0.05 | 12234 | 424.1 | 3.5 | 1926 |
| 0.02 | 12357 | 139.2 | 1.1 | 1946 |
| 0 | 12539 | 102.1 | 0.8 | 1976 |
表4. IP-One細胞ベースアッセイデータの要約。
IP-One HTRF の添付文書の指示に従って IP1 標準物質を調製したところ、Z'ファクターが 0.84(図 4)、 デルタ F%値が 820 から 11883 の範囲の検量線が得られた(表 5)。
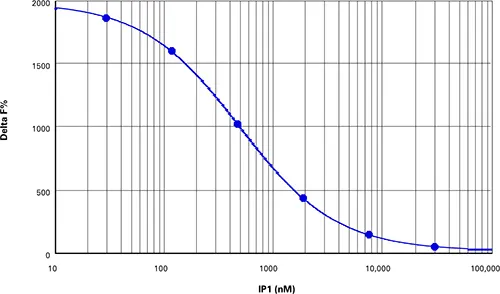
図4. IP1標準曲線。Z'=0.84、EC50=501 nM、添付文書に記載された値と同等。
| IP1 (µM) | 平均比率 | SDレシオ | CV % レシオ | 平均デルタF |
|---|---|---|---|---|
| 30800 | 820 | 28.6 | 3.5 | 44 |
| 7700 | 1389 | 71.0 | 5.1 | 144 |
| 1925 | 3011 | 127.7 | 4.2 | 429 |
| 481 | 6348 | 238.7 | 3.8 | 1015 |
| 120 | 9668 | 334.6 | 3.5 | 1598 |
| 30 | 11157 | 551.1 | 4.9 | 1860 |
| 0 | 11883 | 566.3 | 4.8 | 1987 |
表5. IP-one標準曲線データのまとめ。
結論
HTRF認証を取得したSpectraMax M5eマルチモードマイクロプレートリーダーは、デュアルモノクロメーターベースのシステムの柔軟性と複数の検出モードの汎用性を求める研究者が利用できるアッセイ法の幅を広げます。IP-OneおよびcAMP HTRFアッセイをSpectraMax M5eリーダーで実行すると、広いダイナミックレンジと0.78~0.91の優れたZ'ファクターを示す。データ解析は、HTRFプロトコルがあらかじめ設定された SoftMax Proソフトウェアを使用することで簡便化されます。
参考文献
- TR-FRET Basics (HTRF Technology)
- Zhang, J. H., Chung, T. D. Y., and Oldenburg, K. R. (1999). A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol Scrn 4(2): 67-73.
- cAMP dynamic 2 HTRF kit package insert (Cisbio international, France).
- IP-One HTRF kit package insert (Cisbio international, France).
PDF版(英語)