Application Note SpectraMaxマルチモードマイクロプレートリーダーでの
HTRF cAMP HiRangeアッセイ
- ロバスト性の高いホモジニアスアッセイ
- Z' factor ≥ 0.9
- HTSのための合理化と安定性
- SoftMax Proソフトウェアプロトコルによる結果までの時間の短縮
PDF版(英語)
はじめに
このアプリケーションノートでは、SpectraMax®i3、SpectraMax®Paradigm®、SpectraMax®M5eマルチモードマイクロプレートリーダーを使用して、優れたZ'ファクターと再現性の高いEC50値を持つロバストでハイスループットなHTRF® アッセイを実行する方法を紹介します。
HTRFは、蛍光共鳴エネルギー移動(FRET)技術と時間分解(TR)蛍光測定を組み合わせたもので、短寿命のバックグラウンド蛍光を除去することができる。このアッセイではドナー蛍光体とアクセプター蛍光体を用いる。ドナーとアクセプターが十分に近接すると、エネルギー源(フラッシュランプなど)によるドナーの励起がアクセプターへのエネルギー移動を引き起こし、アクセプターは所定の波長で特異性蛍光を発する。
HTRFは、ドナー-アクセプターTR-FRETペアを形成するために組み合わせることができる4つの特異性蛍光体を使用する。ドナーは、ユーロピウムクリプテート(Eu3+)とテルビウム(Lumi4™-Tb)クリプテートであり、その長寿命蛍光は時間分解蛍光アッセイでの使用を可能にする1。HTRFアッセイでは、XL665とd2の2種類のアクセプターが開発されている。どちらも、HTRF ドナーの Emission スペクトルと重なる励起スペクトルを持つ。それぞれ665 nmに発光ピークがあり、この発光ピークはドナーが発光しない、あるいは非常に弱く発光する領域に含まれる。オリジナルのHTRFアクセプターであるXL665は、紅藻類から精製されたフィコビリタンパク質色素である。第二世代のアクセプターであるd2は、XL665より100倍小さい修飾アロフィコシアニンであり、XL665ベースのアッセイで起こりうる立体障害の問題を軽減するために開発された。
HTRF cAMP HiRangeキットは、細胞サンプル中の環状AMP(cAMP、cyclic adenosine 3', 5'-一リン酸)の定量を可能にする。GPCRにリガンドが結合すると、構造変化が起こり、受容体が活性化され、Gタンパク質が活性化される。さらなるシグナル伝達は、活性化されるGタンパク質のタイプによって異なる。Gsの活性化は、アデニル酸シクラーゼによるcAMPのアップレギュレーションにつながる。セルが産生する遊離cAMPは、抗cAMPクリプテートへの結合においてd2標識cAMPと競合するため、細胞内cAMPの増加はFRETの減少につながり、これは665nmで放出される蛍光の減少として検出可能である(図1)。
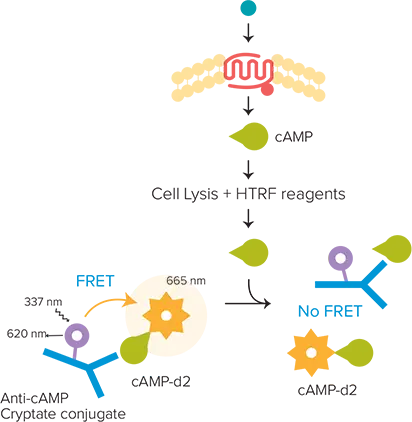
図1.細胞で産生された未標識cAMPは、抗cAMPクリプテートコンジュゲートとの結合においてd2標識cAMPと競合する。したがって、細胞内cAMPの増加はFRETの減少につながる。
材料
- cAMP HiRange 1000 テスト(Cisbio P/N 62AM6PEB)
- 白黒低容量384ウェルマイクロプレート(Greiner P/N 784076および784075)
- SpectraMax i3 マルチモードマイクロプレートリーダー(Molecular Devices社製)
- SpectraMax Paradigmマルチモードマイクロプレートリーダー(Molecular Devices社製)
- SpectraMax M5eマルチモードマイクロプレートリーダー(Molecular Devices社製)
- HTRF検出カートリッジ(Molecular Devices P/N 0200-7011)
方法
HTRF cAMP HiRangeキットはCisbio Bioassays社から提供された。cAMP HiRange HTRFの添付文書に記載されているように、最終濃度0.17 nM~2,800 nMのcAMP標準物質を調製した。cAMPを含まない陽性対照(最大FRET)と、cAMPまたはcAMP-d2を含まない陰性対照が含まれた。試薬は、表 1 に示すように、1 ウェルあたり 20 μL となるように分注した。
| 陰性コントロール | 陽性コントロール | 標準曲線 | アッセイコントロール |
|---|---|---|---|
| 5 µL 希釈液 | 5 µL 希釈液 | 5 µL cAMPスタンダード | 5 µL cAMP コントロール |
| 5 µL 希釈液 | |||
| 5 µL コンジュゲート&溶解バッファー | 5 µL cAMP-d2 | ||
| 5 µL 抗cAMP-クリプテート | |||
表1. 384ウェル低容量プレートのアッセイセットアップ。プレートに蓋をし、室温で1時間インキュベートした。時間分解蛍光は、SpectraMaxマルチモードマイクロプレートリーダーで測定した(インストゥルメンテーションは表2を参照)。SpectraMax i3およびSpectraMaxマイクロプレートリーダーでは、アッセイ感度とダイナミックレンジを最適化するために、マイクロプレート最適化とリードハイト調整の両方を実施しました。
データ分析
HTRFアッセイの分析には、検出された2つのEmission波長に基づくシスビオの特許取得済みレシオメトリックエミッション法が使用されます。616 nmのドナーエミッションは内部参照として使用され、665 nmのアクセプターエミッションはアッセイされる生物学的反応の指標として使用されます。このレシオメトリック測定は、ウェル間のばらつきを低減し、化合物の干渉を排除します。以下のステップ4で算出されるデルタFは、アッセイのSB比を反映し、アッセイ間の比較に有用です。
結果は665nm/616nmの比から計算され、以下のようにデルタFで表される:

Z'因子の値は陰性対照(cAMPなし、cAMP-d2なし)および陽性対照(cAMPなし)を用いて算出した2。
データの作成と解析には、検出と解析を簡略化するためにあらかじめ設定されたHTRFプロトコルがいくつか含まれているSoftMax® Proソフトウェアを使用した。
結果
データは上記のように分析され、SoftMax Proソフトウェアで4パラメータカーブフィットを用いてグラフ化された。表2に示すリーダー設定で最良の結果が得られた。遅延時間、積分時間、パルス数を増加させると、DF %の顕著な減少が観察された。同じデザインの白色マイクロプレートと比較して、黒色低容量 384 ウェルマイクロプ レートを使用すると、アッセイウインドウが 3020 から 3253 に増加した(図 2)。しかし、アッセイウインドウと陽性対照と陰性対照の標準偏差の両方を考慮したZ'ファクターとEC50値は、両方のプレートタイプで非常によく似ていた(表3)。(注:SpectraMax M5eMulti-Modeマイクロプレートリーダーを使用する場合は、白色プレートが必要です)。
| SpectraMax i3およびSpectraMax Paradigm | |
|---|---|
| 光学構成 | HTRF検出カートリッジ |
| リードモード | TR-FRET |
| タイプを読む | エンドポイント |
| 波長 |
Ex 340 nm Em 616 nm Em 665 nm |
| PMTと光学系 |
パルス数: 30 励起時間: 0.05 ms 測定ディレイ 0.02 ms 積分時間:0.2 ms 読み取り高さ: 7.5-7.7 mm*. |
| SpectraMax M5e | |
|---|---|
| リードモード | TRF |
| タイプを読む | エンドポイント |
| 波長 |
Ex 314 nm Em 620 nm Em cutoff 570 nm Em 665 nm Em cutoff 630 nm |
| TRFの設定 |
積分遅延: 50 µs 積分時間: 400 µs |
| PMTと光学系 | 読み取りごとのフラッシュ数:100 |
*最適な読み取り高さは、マイクロプレート、アッセイ量、およびリーダーの光学系に依存します。SpectraMax i3、SpectraMax Paradigm、SpectraMax M5eリーダーの最適なインストゥルメンテーション設定。
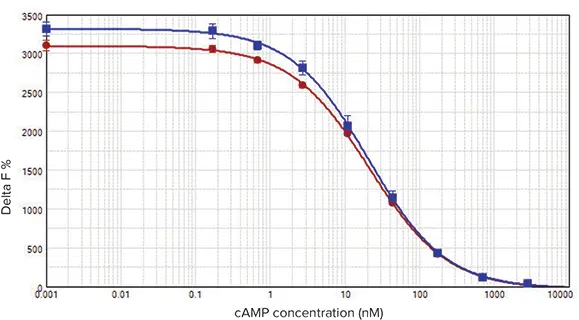
図2. 白色マイクロプレートと黒色マイクロプレートの比較。
SpectraMax Paradigmリーダーで測定したHTRF cAMPキャリブレーション曲線。赤丸: グライナーホワイトプレート: グライナーブラックプレート。この例では、ブラックプレートを使用することで、アッセイウインドウが3020から3253に増加した(単位はデルタF%)。
| 測定 | SpectraMax i3リーダー | SpectraMaxパラダイムリーダー | SpectraMax M5eリーダー |
|---|---|---|---|
|
cAMP EC 50 (nM) |
19.1 | 19.0 | 17.5 |
| Z'因子 | 0.92 | 0.90 | 0.90 |
| 読み取り時間(384ウェル) | 5:03 | 2:17 | 14:00 |
表3. cAMPHiRange標準曲線の結果概要。
SpectraMax i3 と SpectraMax Paradigm リーダーを同じアッセイプ レートで並べて比較したところ、ほぼ同じ結果が得られました(図 3)。このテストでは、白色マイクロプレートを使用した。アッセイウインドウは3004と3051で、Z'ファクターはそれぞれ0.92と0.90であった。EC50値は19.1 nMと20.0 nMで、公表値と同程度でした(表3)。SpectraMax M5eマルチモードマイクロプレートリーダーでも同様のZ'因子とEC50値が得られました。
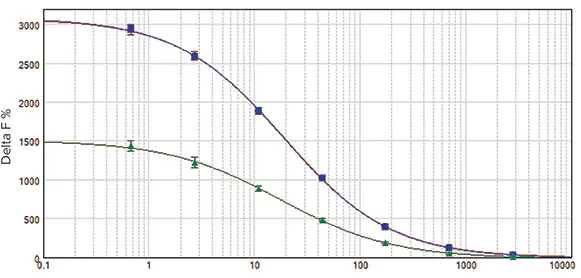
図3. HTRF cAMP検量線。
SpectraMax i3(赤丸)、SpectraMax Paradigm(青四 角)、SpectraMax M5e(緑三角)リーダーで測定したHTRF cAMP検量線。SpectraMax i3 と SpectraMax Paradigm リーダーの結果はほぼ同じであった。SpectraMax M5eリーダーのアッセイウインドウは小さかったが、アッセイの質は優れていた。
SpectraMax Paradigm リーダーの読み取り時間は、HTRF 発光波長を同時に読み取れるデュアル PMT 構成のため、他のリーダーよりも速い(表 3)。
結論
SpectraMax i3 および SpectraMax Paradigm リーダーには、ハイスループッ トスクリーニング機能を備えた HTRF 認定の検出カートリッジを装 備できます。SpectraMax Paradigmリーダーで使用する場合、このカートリッジは同時デュアルエミッション検出が可能で、読み取り時間を短縮できます。3機種すべてのリーダーで、cAMP HiRangeアッセイにおける優れたZ'ファクター値が、これらのマルチモードシステムのロバスト性アッセイ性能を実証している。データ収集・解析は、HTRFプロトコルがあらかじめ設定された SoftMax Proソフトウェアを用いて簡便に行うことができます。
参考文献
- http://www.htrf.com/htrf-technology
- Zhang, J. H., Chung, T. D. Y., and Oldenburg, K. R. (1999). ハイループットスクリーニングアッセイの評価とバリデーションに使用する簡単な統計パラメータ。J. Biomolecular Screening 4(2): 67-73.
以下のMolecular Devicesシステムと互換性があります。

PDF版(英語)