Application Note SpectraMaxリーダーでのHTRF IP-One Gqアッセイ
- 認定HTRF適合による確実な機器性能
- 高い感度と広いダイナミックレンジ
- HTSに適したファンクショナルアッセイのための強力なプラットフォーム
PDF版(英語)
はじめに
キャロライン・カルドネル|Sr.アプリケーションサイエンティスト|モレキュラーデバイス
(TR)蛍光測定を組み合わせたもので、短寿命のバックグラウンド蛍光を除去することができる。このアッセイでは、ドナー蛍光体としてクリプ酸ユーロピウム(Eu3+)またはクリプ酸テルビウム(Lumi4™-Tb)、アクセプター蛍光体としてXL665または低分子d2を用いる。ドナーとアクセプターが十分に近接すると、エネルギー源(フラッシュランプなど)によるドナーの励起がアクセプターへのエネルギー移動を引き起こし、アクセプターは所定の波長で特異性蛍光を発する。
ここでは、SpectraMax® i3x および SpectraMax® iD5 マルチモードマイクロプレートリーダーを使用して、HTRF テクノロジーを使用した Gq 共役レセプターアッセイを実施する方法を紹介します。G タンパク質共役型受容体は、cAMP の制御と IP3 を介した細胞内カルシウム濃度の上昇という 2 つの主要な経路を通じてシグナルを伝達します。シスビオのIP-One Gqキットは、IP3の安定な下流代謝産物であるイノシトール一リン酸(IP1)の蓄積を検出することにより、カルシウム流動アッセイに代わる方法を提供する(図1)。
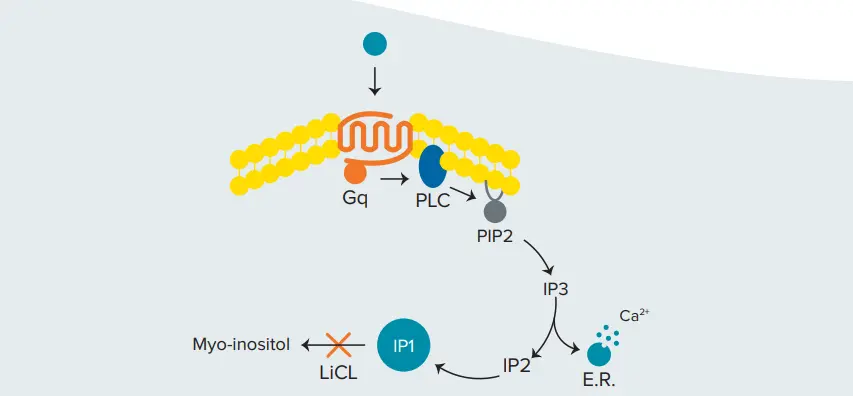
図1. Gq経路の活性化。セカンドメッセンジャーIP3の下流代謝産物であるIP1は、塩化リチウム存在下で蓄積する。
塩化リチウム(LiCl)存在下では、IP1の分解が阻害され、細胞シグナリングに蓄積する(図1)。IP-One HTRFアッセイでは、d2アクセプターで標識したIP1は、細胞で産生されたネイティブIP1と競合し、クリプテートドナーで標識したIP1特異性モノクローナル抗体と結合する。細胞による非標識IP1の産生が増加すると、TR-FRETが阻害され、HTRFシグナルが減少する(図2)2。IP-Oneアッセイは、接着細胞または浮遊細胞のいずれにおいても、Gq共役型レセプターに作用する化合物の特性評価に用いることができる。
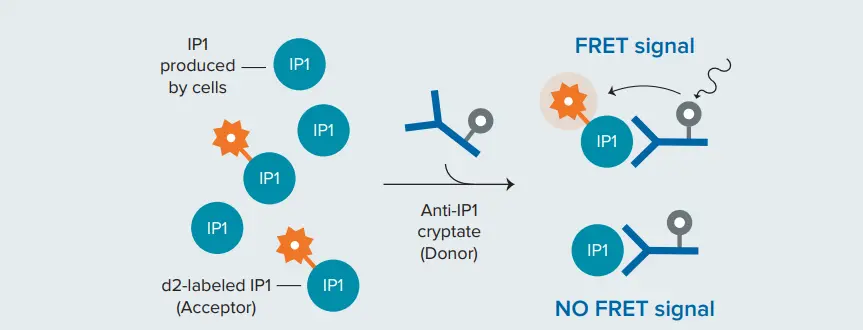
図 2. HTRF IP-One競合結合アッセイの原理。d2アクセプターで標識されたIP1は、ドナー標識IP1特異性モノクローナル抗体との結合においてネイティブ(非標識)IP1と競合する。非標識IP1が増加すると、TR-FRETが阻害され、HTRFシグナルが減少する。
材料
- IP-One Gqキット、1000テスト(Cisbio cat. #62IPAPEB
- iCell ® Neurons(Cellular Dynamics International社製)
- SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices 社 cat.)
- HTRF検出カートリッジ(Molecular Devices cat.)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(Molecular Devices cat.)
- HTRF検出システム(Molecular Devices cat. #6590-0144;改良TRFモジュール、励起および発光フィルターを含む)
メソッド
最終濃度1.9 nM~7700 nMのIP1標準品を、アッセイ製品添付文書に記載されているように調製した3。非標識IP1を含まないポジティブコントロール(最大FRET)と、IP1や抗IP1-d2抗体を含まないネガティブコントロールが含まれる。試薬は、図 3 に示すように、ウェルあたり 20 μL になるように分注した。プレートを室温で1時間インキュベートし、SpectraMax i3xおよびiD5リーダーで表1に示す最適化設定を用いて読み取った。
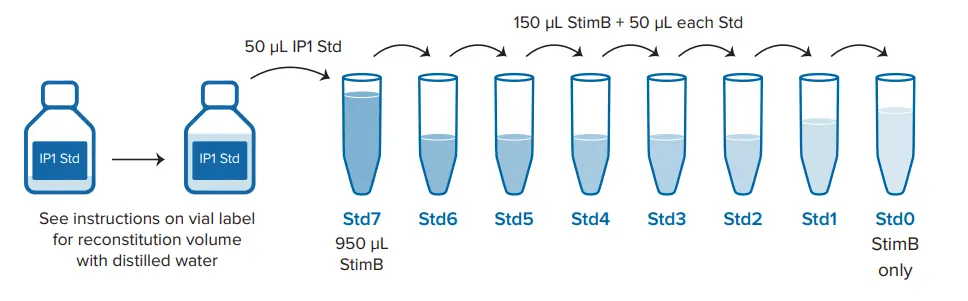
| 標準 | 溶液 | IP1 作業溶液 nM | IP1 最終濃度 nM |
|---|---|---|---|
| Std7 | 50 µL IP1 Std 再構成 + 950 µL StimB | 11000 | 7700 |
| Std6 | 50 µL Std7 + 150 µL StimB | 2750 | 1925 |
| Std5 | 50 µL Std6 + 150 µL StimB | 688 | 481.6 |
| Std4 | 50 µL Std5 + 150 µL StimB | 172 | 120.4 |
| Std3 | 50 µL Std4 + 150 µL StimB | 43 | 30.1 |
| Std2 | 50 µL Std3 + 150 µL StimB | 11 | 7.7 |
| Std1 | 50 µL Std2 + 150 µL StimB | 2.7 | 1.9 |
| Std0 |
150 µL StimB |
0 | 0 |
*StimB は蒸留水で 5 倍から 1 倍に希釈する必要があります。
図3. 384ウェル低容量プレートのアッセイセットアップ。StimB」はIP-One Gqキットに含まれるStimulation Buffer。
| SpectraMax i3x | SpectraMax iD5 | |
|---|---|---|
| Tbドナー/レッドアクセプター | Tbドナー/レッドアクセプター | |
| 必要なコンポーネント | HTRF検出カートリッジ | HTRF検出システム |
| 励起 | 340 nm | 340/70 nm |
| 発光 |
ドナー: 620 nm アクセプター: 665nm |
ドナー:616/10 nm アクセプター: 665/10 nm |
| フラッシュ数 | 30 | 30 |
| 積分遅延 | 30 µs | 20 µs |
| 積分時間 | 400 µs | 200 µs |
| その他 | アッセイを初めて実行する場合、および新しいロットのプレートや異なるアッセイ容量を使用する場合は、その他のマイクロプレート最適化および読み取り高さの調整を実行します(SoftMax® ProソフトウェアのSettings > More Settings > Show Pre-Read Optimization Options(設定 > その他の設定 > 読み取り前最適化オプションの表示))。 | |
表1. SpectraMax i3xおよびiD5リーダーのインストゥルメンテーション設定。これらの設定はIP-One Gqアッセイ用に最適化されたものであり、他のHTRFアッセイで使用する設定とは若干異なる場合があります。
設定を最適化するために、遅延時間、積分時間、パルス数を Delta F%(後述の「データ解析」参照)が顕著に増加するまで調整した。表1に示した最適化された設定は、同じモデルのどのプレートリーダーにも移植可能である。すなわち、以下に示すSpectraMax iD5リーダー用の設定は、どのSpectraMax iD5リーダーにも使用できる。ただし、マイクロプレートの最適化とリードハイトの調整は、新しいプレ ートタイプ、プレートロット、試薬量を使用するたびに行い、リーダーの光学系がアッセイプ レートにアライメントされるようにする必要があります。こうすることで、誤差を最小限に抑え、アッセイ感度とダイナミックレンジを最適化することができる。
データ解析
HTRFアッセイの解析には、検出された2つのEmission波長に基づくシスビオの特許取得済みレシオメトリックエミッション法が使用される。616 nmのドナーエミッションは内部参照として使用され、665 nmのアクセプターエミッションはアッセイされる生物学的反応の指標として使用されます。このレシオメトリック測定は、ウェル間のばらつきを低減し、化合物の干渉を排除します。以下のステップ 4 で計算されるデルタ F は、アッセイ の SB 比を反映し、アッセイ間の比較に有用です。結果は665nm/616nmの比から計算され、以下のようにデルタFで表されます:

データは、SoftMax® Proソフトウェアを用いて作成・解析した。SoftMax® Proソフトウェアには、検出と解析を簡略化するためにあらかじめ設定されたHTRFプロトコルが含まれている。
結果
SpectraMax i3x および iD5 リーダーの標準曲線を、SoftMax Pro ソフトウェアを使用し、4パラメータカーブフィットを適用してグラフ化した(図 4)。アッセイ適性は、150 nM以下であるべきEC50を用いて評価した。両リーダーのEC50値は85 nM以下であり、許容範囲内であった。シスビオは許容できるシグナル対ノイズ比を20以上と定義しており、どちらのリーダーもこの基準を満たしていた。これらの結果に加え、全標準物質の CV 値が 6%未満であったことから、SpectraMax i3x と SpectraMax iD5 の両リーダーは、IP-One アッセイにおいて高い感度と広いダイナミックレンジを示した。
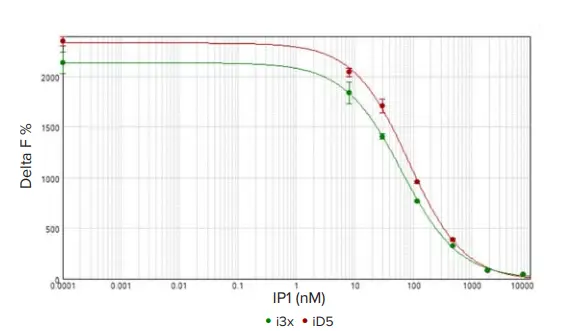
図 4. HTRF IP標準曲線。SpectraMax i3x(緑丸)および SpectraMax iD5(赤丸)リーダーで測定した HTRF IP1 標準曲線。SpectraMax iD5 のアッセイウインドウはやや大きめであったが、アッセイ品質はどちらのリーダーでも優れていた(CV < 6%)。
| パラメータ | 合格 | SpectraMaxi3x |
SpectraMaxiD5 |
|---|---|---|---|
| EC50 | ≤ 150nM | 63.1 nM | 84.1 nM |
| SN比 | ≥ 20 | 22.4 | 24.5 |
表2. HTRF IP1標準曲線の結果サマリー。
結論
SpectraMax i3x および iD5 リーダーはそれぞれ、HTRF 検出カートリッジまたは HTRF 検出システムを搭載することができる。どちらのリーダーも、シスビオの合格基準に従って IP1 濃度を検出する能力を実証した。データ収集・解析は、HTRFプロトコルがあらかじめ設定されたSoftMax Proソフトウェアを用いて簡便に行うことができる。
参考文献
- http://www.htrf.com/htrf-technology
- Garbison KE, Heinz BA, Lajiness ME. IP-3/IP-1 アッセイ。2012年5月1日。2012年5月1日: Sittampalam GS, Grossman A, Brimacombe K, et al. Assay Guidance Manual.
- https://www.cisbio.eu/media/asset/c/i/cisbio\\_dd\\_pi\\_62ipapeb-62ipapec-62ipapej.pdf
PDF版(英語)