Application Note ImageXpress Picoシステムを用いた神経突起伸長に対する
化合物特異的効果の同定
- 神経突起伸長に対する化合物特異性の評価
- マルチプレックス測定による神経ネットワークの広がりと複雑性の定量化
- 試験管内での神経細胞の発生と変性に関する研究へのアッセイの利用
PDF版(英語)
はじめに
オクサナ・シレンコ|シニア・リサーチ・サイエンティスト|モレキュラー・デバイス
神経突起伸長は、試験管内で神経細胞の発生と変性を研究するための一般的なアッセイ法である。神経突起の発達には、細胞外シグナルと細胞内シグナルの複雑な相互作用が必要である。神経突起の成長は、神経栄養因子によって刺激されたり抑制されたりする。重要なことは、神経突起の発達は神経毒性のある化学物質によって影響を受ける可能性があるということである。
我々は、発達中の神経系に悪影響を及ぼす化合物の能力を測定するために、ImageXpress® Pico自動細胞イメージングシステムを用いて神経突起伸長アッセイを評価した。このアッセイは、神経細胞が神経突起を伸ばして完全な神経ネットワークを形成するという、神経系の発達における重要なプロセスであることから選択された1,2。一般的に、神経突起伸長は最も一般的な指標として報告されているが3,4、総分岐や総過程などのパラメータは、化合物が神経突起伸長を阻害する可能性のある別の様式を表している可能性がある。
われわれは、神経突起伸長に対する化合物の特異性を評価した。この評価には、マルチプレックス測定による神経ネットワークの広がりと複雑さの定量的な特性評価も含まれる。神経突起伸長の表現型は、複数の測定値を用いて特徴づけられた。神経突起伸長は、神経突起の伸長範囲(全アウトグロースの長さまたはセルあたりの平均アウトグロース)、神経突起の数(全プロセス数)、および分岐の程度(全分岐数およびセルあたりの平均分岐数)によって特徴付けられた。
材料
- iPSC 由来ニューロン(Human Neuronal Kit, NEURO KIT, XK-001-1V, エクセルサイエンス社製)
- ポリ-D-リジンプレコート384ウェルプレート(Corning Biocoat)
ラミニン(Sigma-Aldrich) - Hoechst (ThermoFisher Scientific)
- Hank's Balanced Salt Solution(Life Technologies社製)
- ImageXpress Pico 自動細胞イメージングシステム(Molecular Devices社製)
- CellReporterXpress ® 画像取得および解析ソフトウェア(Molecular Devices社製)
方法
iPSC 由来のニューロンを、3.3 mg/mL のラミニンで処理したポリ-D-リジンでプレコートした 384 ウェルプレートにプレーティングした。ウェルあたり1万個のセルがプレーティングされ、化合物処理の48時間前からiCell Neuron Maintenance Mediumで維持された。これらのセルにおける神経突起ネットワークは通常、プレーティング後2時間で形成され始め、培養10-12日まで複雑さを増す。神経細胞はメーカー推奨の方法で14日間培養した後、384ウェルプレートで6段階の濃度範囲(0.3~100μM)で72時間処理した。神経突起伸長に対する効果は、総アウトグロース、枝、突起、およびウェルあたりの生存細胞数を定量することによって評価した。濃度反応依存性はEC50値を用いて評価した。
セルは37℃、5% CO2で72時間化合物に暴露された。次に培地を除去し、細胞を4%ホルムアルデヒドで固定し、2回洗浄した後、滅菌したハンク平衡塩溶液中で、AF-488結合ファロイジンと1μmのヘキスト33342の1:100混合液で2時間インキュベートした。インキュベーション後、染色液を0.1%のウシ胎児血清(FBS)を封じ込めたリン酸緩衝生理食塩水(PBS)に交換し、画像撮影を行った。
個々のウェルからの画像は、ImageXpress Picoシステムで10X対物レンズを使用して取得した。通常、384ウェルプレートの1ウェルにつき1枚の10X画像を取り込んだ。10X対物レンズは、ウェル総面積の約1/6に相当する比較的多数の細胞(>200)/画像の神経突起ネットワークと細胞内構造を識別するのに十分な解像度を提供する。解析は、神経突起トレーシングのための解析モジュールを封じ込めたCellReporterXpressソフトウェアを用いてOn-the-flyで行った。図1は、DMSOで処理した神経細胞の代表的な拡大画像と神経突起トレーシングのオーバーレイである。
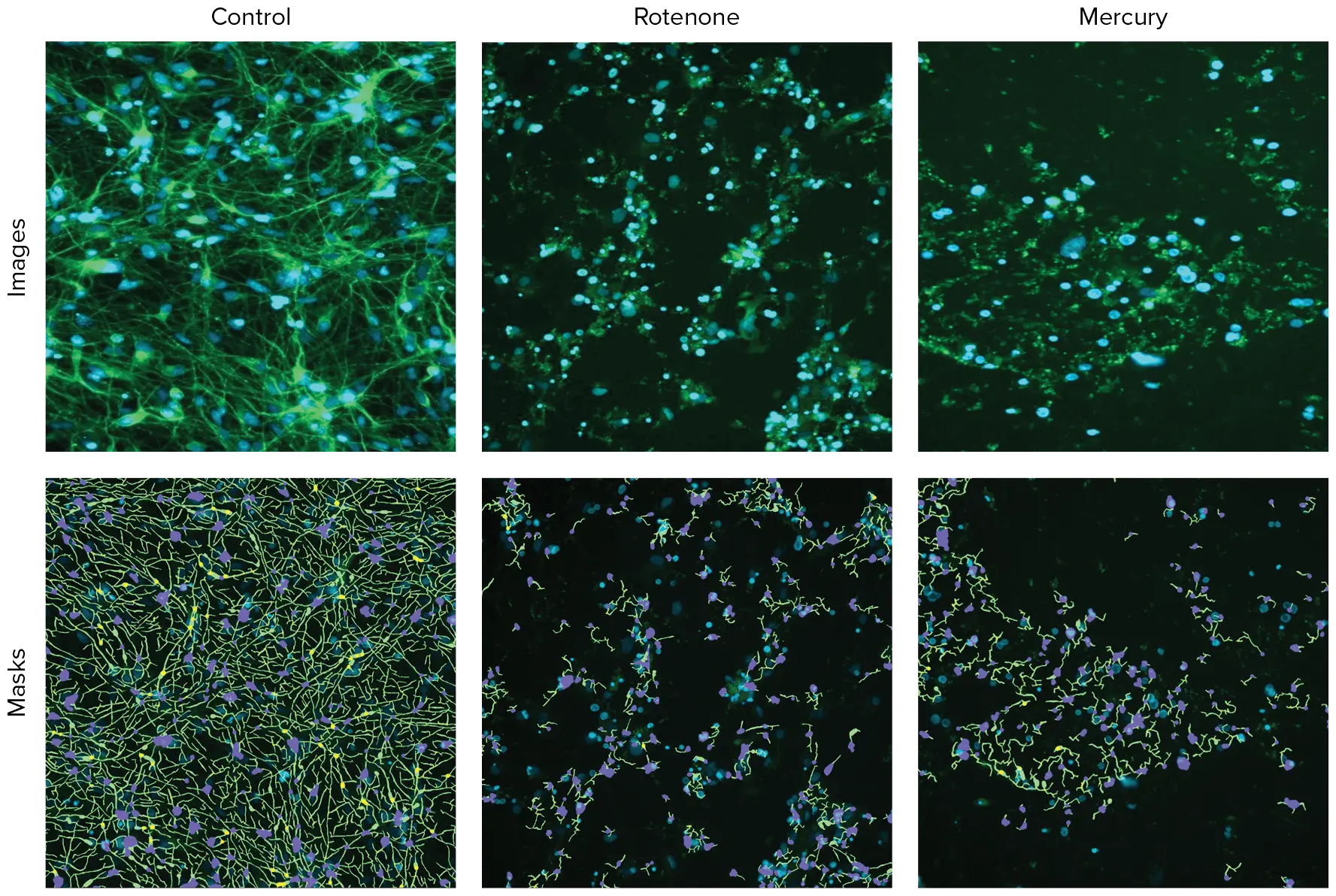
結果
化合物処理により、用量依存的な神経突起ネットワーク形成の阻害が観察された(図2)。これらの実験で撮影された画像の定量的解析では、培養ニューロンの形態学的特徴と神経細胞ネットワークの程度と複雑さの両方を評価できる複数のパラメーターを導出した。また、化合物による細胞毒性を推定するために、画像中の全細胞体の数も定量化した。細胞プレーティングと神経突起伸長は実験全体を通して非常に一貫性があり、均一であったため、統計解析には画像ごとの神経細胞の総数を用いた。セルあたりのアウトグロースの長さ、あるいは個々のセルあたりの突起や枝の数も測定したが、冗長なため統計解析には使用しなかった。化合物の毒性効果は、神経突起伸長、枝数、突起数、または生存細胞数の4パラメータカーブフィット処理から得られたEC50値(神経突起伸長を50%阻害する化合物の濃度)によって比較することができる。図2は、潜在的な神経毒性作用を評価し、さらなる毒性評価の優先順位をつけるために、さまざまな化合物(1μM濃度)における神経突起ネットワークの全長(全アウトグロース)の濃度依存性曲線を示したものである。図3および図4は、10μM濃度で試験した神経毒性化合物である。
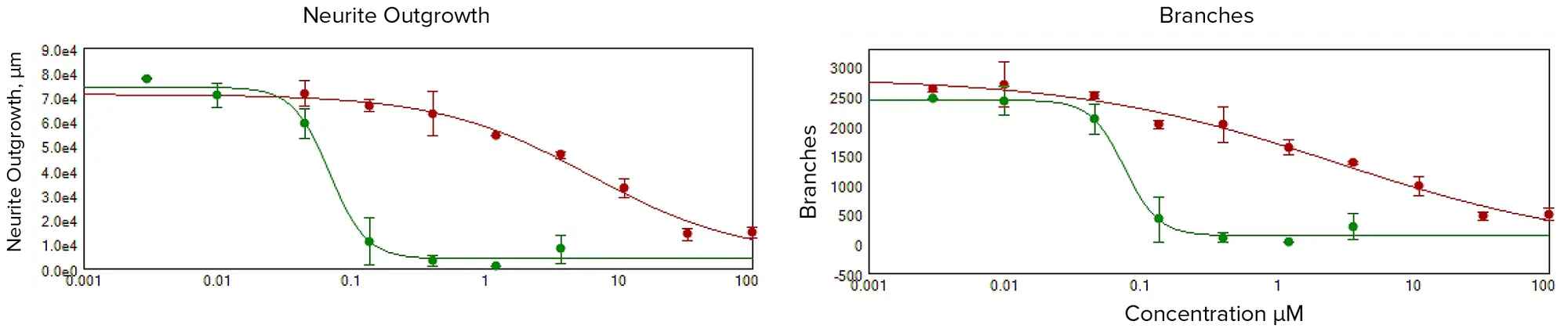
図2. 1μMの標記化合物で処理した神経細胞について、神経突起ネットワークの破壊を測定した。EC50値は全アウトグロースの減少で定義され、ロテノンは6μM、メチル水銀は0.07μMであった。EC50値は分岐点の減少で定義され、ロテノンは3μM、メチル水銀は0.07μMであった。
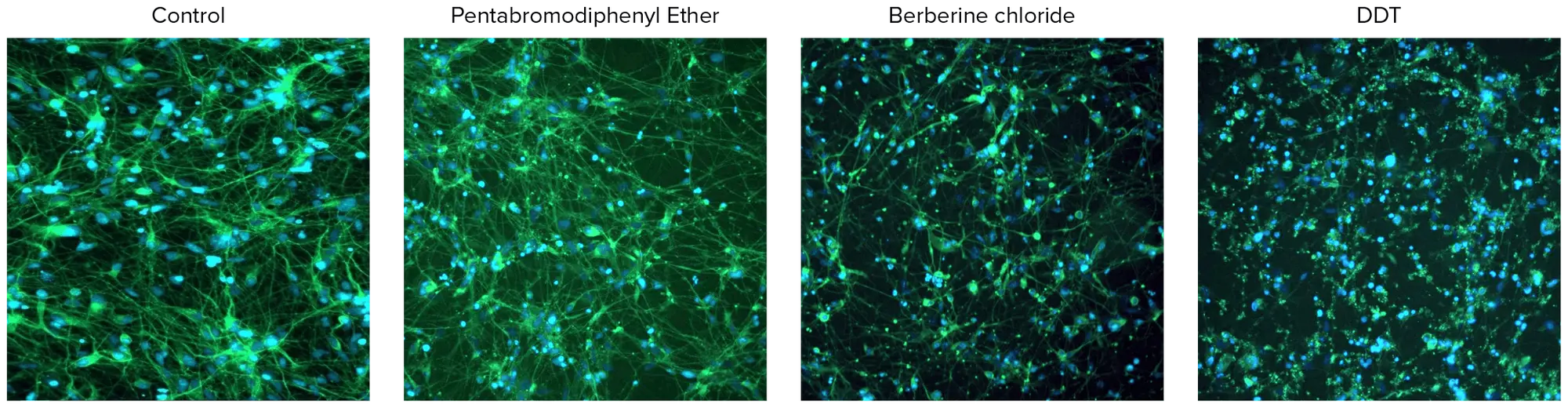
図3. 10μM濃度で試験した神経毒性化合物の画像。
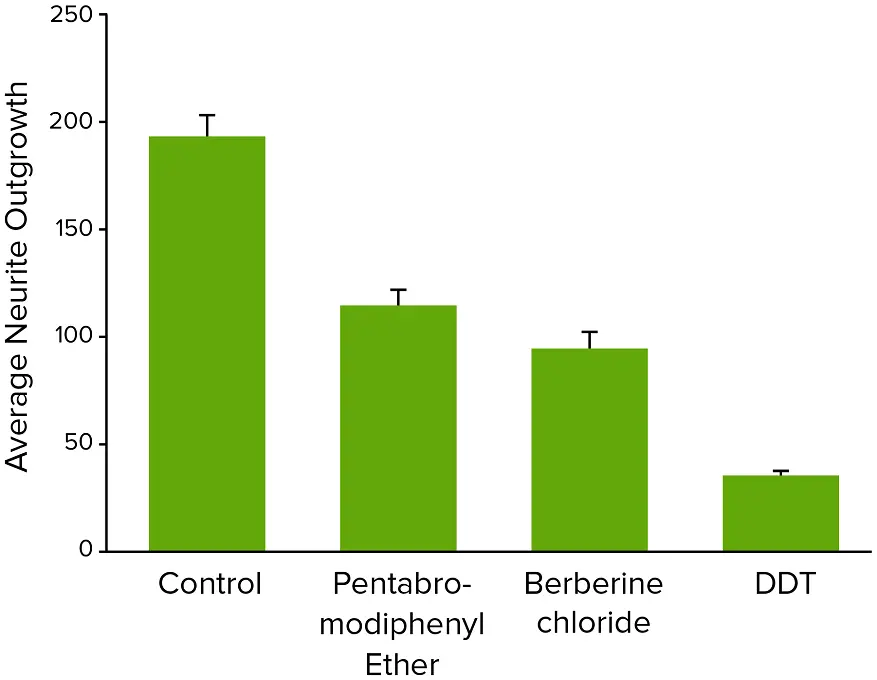
図4. 10μM濃度で試験した神経毒性化合物の平均神経突起伸長。
結論
このアッセイは、神経突起伸長のさまざまなモジュレーターやin vitro神経毒性作用の研究に有用である。
参考文献
- Harrill, J.A., Robinette, B.L., Freudenrich, T., Mundy, W.R., 2013. ラット大脳皮質初代ニューロンの神経突起亜集団に対する化学物質を介した影響を検出するためのハイコンテント画像分析の使用。Neurotoxicology 34, 61-73.
- Sanes, D.H., Reh, T.A., Harris, W.A., 2006. 神経系の発達。Elsevier Academic Press, Burlington, MA.
- Radio, N.M., Breier, J.M., Reif, D.M., Judson, R.S., Martin, M., Houck, K.A., et al., 2015. ToxCast フェーズ 1 ライブラリーにおける環境化学物質のスクリーニングに、増殖と神経突起伸長の神経モデルを使用。Appl. In Vitro Toxicol. 1 (2), 131-139.
- Stiegler, N.V., Krug, A.K., Matt, F., Leist, M., 2011. 高密度培養におけるマルチパラメトリック生細胞イメージングによる、化学物質によるヒト神経突起伸長障害の評価。Toxicol. 科学 121, 73-87
PDF版(英語)