Application Note 閾値システムを用いた細胞培養/発酵およびプロセス開発における
迅速イムノアッセイ(FAST ILA)のアプリケーション
PDF版(英語)
はじめに
バイオリアクター/発酵槽のモニタリング、下流プロセス、最終製品の品質管理において、生物学的産物の濃度を正確に測定することは重要である。現在、電気泳動法、クロマトグラフィー法、免疫化学法が最も一般的に使用されています。電気泳動法は通常、定性的な結果を提供する。クロマトグラフィー法は定量的で、すべてのサンプル成分に関する情報を提供するが、サンプル干渉の問題があり、また対象製品に特異的でない場合がある。従って、これら3つの方法は、所望のサンプル情報を提供するために、現在組み合わせて使用されている。目的の生成物または汚染物質の迅速かつ定量的な測定を提供できる分析物であれば、バイオリアクター/発酵槽および個々の精製工程のモニタリングおよび最適化に有用である。
Threshold Immunoligand Assay (ILA)システムを用いて最適な感度を得るための標準的なサンプル納期は約4時間です。これには、サンプル調製、インキュベーション、ろ過、読み取りのステップが含まれます。標準的なILAでは、サンプルのインキュベーション時間は2時間です。このインキュベーションは一般に、抗体-抗原反応が平衡に達するのに十分な時間を提供します。ほとんどの場合、抗体-抗原複合体の初期結合カイネティクスは比較的速い(1~1000秒)。より短いサンプルインキュベーション時間(1~10分)でも、反応が平衡に達していなくても、十分な抗体-抗原複合体形成時間が得られるはずです。一般的に、アッセイ性能の特性は、高親和性、高速結合抗体を使用した場合に最適となります。サンプルのインキュベーション時間の短縮により、総アッセイ時間が1時間未満になりました。
このアプリケーションノートでは、Threshold ILA システムを用いてマウス IgG を検出するために開発された迅速サンドイッチイムノアッセイ(FAST ILA)の一例について説明します。このアッセイでは、ピコグラムの感度が得られ、総アッセイ時間は1時間未満で、同じ実験で複数のサンプルをアッセイすることができます。
材料
- Molecular Devices Corporation(カタログ番号 0200-0500)、1311 Orleans Drive、Sunnyvale、CA 94089、Tel: 408-747-1700 または 800-635-5577 の Threshold® システム****。
- *Molecular Devices CorporationのImmuno-Ligand Assay Labeling Kit *(カタログ番号R9002)。
- *Molecular Devices Corporation(カタログ番号R9002)の *Immuno-Ligand Assay Labeling Kit。
- *Immunoaffinity purified goat anti-mouse IgG (Fc specific) *はSigma Chemical Company (catalog # M2650)から購入した。
- 免疫親和性精製ヤギ抗マウスIgG(Fab特異性)****は、ニューヨーク州ウェストベリーのAccurate Chemical & Scientific Corporation(カタログ番号JGM-0572)から購入した(Tel: 516-333-2221)。
- ***精製マウスIgG1***は、Zymed Laboratories, Inc.(カタログ番号 02-6100)、South San Francisco, CA, tel: 415-871-4494から購入した。
方法
結合タンパク質の標識
モル結合比(MCR)は、標識手順に使用した結合タンパク質1モルあたりのハプテン(ビオチンまたはフルオレセイン)のモル数として定義される(Threshold System Operator's ManualのILAセクションを参照)。モル取り込み比(MIR)は標識(タンパク質のハプテン化)の程度を示す尺度であり、結合タンパク質1モル当たり共有結合したハプテンの平均モル数として定義される。理論上の最大MIRは、結合タンパク質上の利用可能なアミン基の総数によって決定される。結合タンパク質の標識には、2時間のインキュベーションを含め、通常3時間を要する。
抗マウスIgG(Fab特異性、「抗Fab」)および抗マウスIgG(Fc特異性、「抗Fc」)を、Threshold System Operator's ManualのILAセクションに記載されたプロトコールに従って、それぞれフルオレセインおよびビオチンで20:1のMCRで定量的に標識した。その結果、MIRはフルオレッセイン標識抗Fabで5.0、ビオチン標識抗Fcで4.4となった。
抗体のローディング
抗体-抗原反応を複合体形成に向かわせるため、各抗体のローディングは標準的なILA(2時間インキュベーション)で使用するよりも増やしました。使用できる各標識抗体の上限は、陰性サンプルのバックグラウンドレベルによって決定されます。許容できるバックグラウンドレベルは、通常150μV/sec以下です。負荷試験には通常1~2回のアッセイ(半日から1日の実験)が必要です。
これらを考慮し、最適なローディング量は各標識抗体約50 ng/100μLと決定しました。過剰の蛍光標識抗体を使用するため、酵素試薬に含まれる一定量の抗フルオレセイン:ウレアーゼ結合体の飽和を避けるため、連続したフォーマットが必要となります(Threshold System Operator's ManualのILAセクションに概説されているように、最初の濾過捕捉ステップの後、2回目の濾過ステップで酵素試薬を加えるなど)。以下の手順は、シーケンシャル FAST ILA 形式で使用されるプロトコルの概要です。
シーケンシャル FAST ILA 用アッセイプロトコル
ステップ 1 サンプル希釈液と標準曲線をアッセイ緩衝液で調製します。
ステップ 2 ビオチン標識抗体とフルオレセイン標識抗体の混合液をポリプロピレンチューブに調製します。
ステップ3 100μLのサンプルと100μLの抗体混合液を合わせます。
ステップ4 室温で10分間インキュベートします。
ステップ 5 キャプチャー試薬を 25 mL のアッセイバッファーで希釈します。再構成Capture Reagentの1:5希釈液を調製します(Capture Reagent 1容量+Assay Buffer 4容量)。インキュベーションが完了したら、希釈した Capture Reagent を 0.5 mL ずつ、エッペンドルフのリピーターピペッターと Combitip を使って各チューブに分注します。
ステップ 6 反応混合物をろ過ユニットに移す。低真空でフィルタリングする。
ステップ 7 ウェルが空になったら、各ウェルに 2 mL の洗浄液を加え、高真空でろ過します。
ステップ 8 濾過ステップの間に、酵素試薬を 4 mL のアッセイバッファーで再構成します。再構成した酵素試薬の1:5希釈液を調製します(酵素試薬1容量+アッセイバッファー4容量)。
ステップ 9 真空を止め、リピーターピペッターとコンビチップを用いて希釈した酵素試薬を各ウェルに 0.5 mL ずつ分注します。低真空でフィルタリングする。
ステップ10 ウエルが空になったら、各ウエルに2mLの洗浄液を加え、高真空でフィルタリングします。
ステップ 11 ウエルが空になったら真空を止め、スティックを読み取ります。
総アッセイ時間:1時間
アッセイ特性
標準曲線
図 1 は、FAST ILA(10分インキュベーション)フォーマットと標準ILA(2時間インキュベーション)フォー マットを用いてマウスIgGについて作成した標準曲線を比較したものです。FAST ILA のダイナミックレンジは 200 pg - 10 ng マウス IgG1/test、または 2 - 100 ng マウス IgG1/mLですが、標準 ILA のダイナミックレンジは 5 pg - 1 ng マウス IgG1/test、または 50 pg - 10 ng マウス IgG1/mLです。FAST ILAフォーマットで使用される負荷量は、1検査あたり各標識抗体50 ngです。以前に開発された他のサンドイッチILAと同様に、アッセイ精度はアッセイ内で5~8%の範囲です。アッセイ間のばらつきは通常10%以下です。
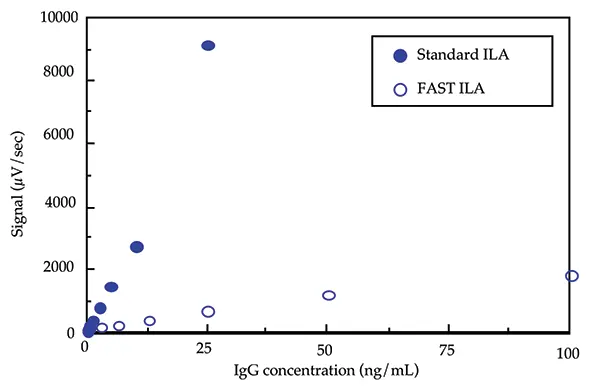
図1:
FAST ILAフォーマットと標準ILAフォーマットを用いて作成したマウスIgGの標準曲線の比較。
アプリケーション
FAST ILA フォーマットの特性は、定量性、感度、リアルタイムまたは同日結果が重要な、培地最適化、クローン選択、バイオリアクター・モニタリング、プロセス開発におけるアプリケーションに理想的です。
培地最適化
表 1 は、モノクローナル抗体産生に最適な培地条件を決定するため にデザインされた小規模細胞培養実験の比較である。セルは3日間培養し、その後上清を回収、希釈し、IgG濃度を測定した。2回目の実験では、細胞培養とイムノアッセイを繰り返した。FAST ILAフォーマットのマウスIgGアッセイを用いて得られた結果を、結果が出るまでに2~3日を要する従来のELISAを用いて得られた結果と比較した。結果はほぼ一致している。
| IgG1 濃度(µg/mL) | IgG1 濃度(µg/mL) | IgG1 濃度(µg/mL) | |
|---|---|---|---|
| 培地 | FAST ILA | ラン番号 | ELISA |
| A | 1 | 10.8 | 11.5 |
| A | 2 | 12.6 | 12.0 |
| B | 1 | 12.9 | 11.8 |
| B | 2 | 15.1 | 12.6 |
| C | 1 | 11.9 | 11.8 |
| C | 2 | 12.4 | 10.9 |
| D | 1 | 6.2 | 6.4 |
| D | 2 | 12.7 | 12.5 |
| E | 1 | 11.9 | 12.4 |
| E | 2 | 10.4 | 10.5 |
| F | 1 | 13.7 | 10.5 |
| F | 2 | 15.9 | 10.5 |
| G | 1 | 13.0 | 13.0 |
| G | 2 | 11.5 | 9.5 |
表1:培地の最適化を決定するためのFAST ILAとELISAアッセイの結果の比較
当初、FAST ILA フォーマットでは、外因的に添加された IgG(「スパイク」)の回収率が低く、サンプル希釈の関数として定量が変動することから、サンプルの干渉が明らかになりました。しかし、標識抗体の負荷を100 ng/testに増やし、非標識抗Fcおよび抗Fabを250 ng/testの濃度で添加することにより、干渉の問題は解決された。遊離軽鎖や他のタンパク質分解抗体フラグメントが細胞培養上清中に存在することが知られている。標識抗体が認識して結合する遊離軽鎖やその他のタンパク質分解産物が大量に過剰に存在するために、妨害が生じた可能性がある。これらのフラグメントは無傷のマウスIgGと標識抗体との間で効果的に競合する。標識抗体が過剰に存在しないと、スパイクの回復が阻害される。2つの標識抗体のローディングを増加させるだけで、陰性サンプルのSB比が増加し、全体的なシグナルが増加します。非標識抗体とより多くの標識抗体を添加することで、バックグランドを著しく増加させることなく(実際にはバックグランドシグナルは減少する)、効果的に過剰な全結合抗体を得ることができます。これにより、抗体フラグメントによる干渉を受けることなく、FAST ILA フォーマットを利用することができます。あるいは、サンプルをさらに希釈し、標準的なILAフォーマットで検査することもできます。
プロセス開発
FAST ILA フォーマットは、下流の処理工程で製品の回収率を迅速に定量するためにも使用できます。プロセスデザインと最適化における FAST ILA フォーマットの実用的な応用が可能になりました。表 2 は、TRIO™ 中空糸 IgG 精製システム(Sepracor, Inc.) この例では、2つの異なる細胞培養上清をTRIOシステムを用いて精製しています。各プロセスの各ステップにおけるIgG濃度は、FAST ILAとProtein A HPLCの両方を用いて測定した。得られた結果はほぼ一致している。
| IgG1濃度(µg/mL) | IgG1濃度(µg/mL) | IgG1濃度(µg/mL) | IgG1濃度(µg/mL) | |
|---|---|---|---|---|
|
サンプル |
|
FAST ILA |
HPLC |
容量 (mL) |
| クローン番号 1 | 培養上清 | 59.0 | 50.0 | 194 |
| ウォッシュ# 1 | 1.1 | 2.0 | 152 | |
| 洗浄#2 | 5.8 | 7.0 | 96 | |
| 洗浄#3 | 0.1 | 2.0 | 194 | |
| 溶出液 | 773.0 | ~700.0 | 7 | |
| 製品回収率 | 47.3% | 50.5% | ||
| クローン#2培 | 養上清 | 3.3 | 5.0 | 193 |
| 洗浄#1 | 0.7 | N/A | 194 | |
| 洗浄#2 | 1.2 | N/A | 84 | |
| 溶出液 | 51.0 | 58.0 | 12 | |
| 製品回収率 | 96.1% | 72.1% |
表 2: プロセス開発に使用するFAST ILA
これらの結果は、溶出液中の IgG1 の回収率(上清に対する)が 2 つの例で異なることを示しています。この違いは、プロテインAに対するIgG1の親和性の違い、採用した洗浄スキームの違い、または2つの上清中のIgGの開始濃度の違いによるものと考えられます。洗浄スキームと上清IgG濃度が抗体回収に及ぼす影響を調べることは、FAST ILAフォーマットを用いて迅速に実施できるようになりました。
概要
高親和性高速結合抗体を Threshold ILA システムと組み合わせると、迅速なイムノアッセイを数日で開発することができます。マウスIgG1のFAST ILAは、ダイナミックレンジが2 ng~100 ng IgG1/mL、総アッセイ時間が1時間以下であり、3日間で開発されました。開発およびルーチンアッセイの両方において、精度、正確さ、および迅速な納期を実現したFAST ILAフォーマットは、培地の最適化、プロセス開発、バリデーション、クローン選択、バイオリアクターの最適化とモニタリングなど、多くの実用的なバイオ医薬品アプリケーションに有用です。他の生物製剤や混入物(宿主細胞タンパク質、インスリン、トランスフェリンなど)の迅速アッセイも同様に開発できます。このように、Threshold FAST ILA フォーマットは、電気泳動やクロマトグラフィーなどの既存の方法と組み合わせて使用できる有用な新しい分析物です。
PDF版(英語)