Application Note 汚染ヒトトランスフェリンアッセイ
PDF版(英語)
はじめに
ヒトトランスフェリンは、ヒト血清中に存在する80,000ダルトンの糖タンパク質で、細胞間の鉄の輸送を促進する。鉄に乏しい形のアポトランスフェリンは、Fe2+イオンと結合して鉄飽和形のホロトランスフェリンになる。通常血清中に存在するトランスフェリンの約3分の1は、Fe2+飽和型である。ヒトトランスフェリンは、バイオ医薬品の生産に使われる哺乳類細胞培養の培地成分として含まれることがある。これらのバイオ医薬品を精製する際、ヒトトランスフェリンがコンタミ物質として製品タンパク質と一緒に精製されることがあります。これは製品の臨床使用における危険性を示すため、最終製品中のヒトトランスフェリンの存在をアッセイすることが必要な場合がある。このアッセイはまた、精製プロセスを通してヒトトランスフェリンのクリアランスをモニターするためにも使用できます。
このアプリケーションノートでは、市販の抗ヒトトランスフェリン抗体を用いたヒトトランスフェリンアッセイの一般的なプロトコールと性能試験について説明します。このノートはガイドとして作成されたものであり、このアッセイのバリデーションや最適化された性能を示すものではありません。
材料
- Molecular Devices CorporationのThreshold® System(カタログ番号0200-0500)、1311 Orleans Drive, Sunnyvale, CA 94089, tel: 408-747-1700 または 800-635-5577.
- Molecular Devices CorporationのImmuno-Ligand Assay Labeling Kit(カタログ番号R9002)。
- Molecular Devices CorporationのImmuno-Ligand Assay Detection Kit(カタログ番号R9003)。
- 注:ILA キットに含まれる Assay Buffer Concentrate は、コンタミヒトトランスフェリンアッセイには一切使用しません。
- BSA を含まないアッセイバッファー。ILA キットに含まれるアッセイバッファー濃縮液にはウシ血清アルブミン(BSA)が含まれています。バッファーの調製に使用される BSA は高品位ですが、アッセイに影響を及ぼす汚染トランスフェリンが含まれている可能性があります。ヒトトランスフェリンアッセイにはBSAを含まないアッセイバッファーが使用されます。BSA を含まないアッセイバッファーの処方は以下の通りです:
|
|
|
|---|---|---|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- 表 1: BSA フリーアッセイバッファーの処方
- BSA フリーアッセイバッファーの 10 倍溶液を脱イオン水で 1:10 に希釈したものを 500 mL 調製し、0.22 µm のフィルターでろ過する。10X ストックは 4℃で保存する。結晶が生じた場合は、室温に温め、結晶を溶解してから 1X 溶液を調製する。緩衝液の汚染を防ぐため、滅菌済みピペットチップと脱イオン水でよく洗浄したガラス器具のみを使用する。
- ヒトトランスフェリン、"アポ "フォーム、ベーリンガー・マンハイム製(カタログ番号1317- 393)。「Boehringer Mannheimのヒトトランスフェリンの "apo "型と "holo "型、Pentex ® Miles, Inc. Boehringer Mannheim 社の "apo "フォームを本アプリケーションノートに記載された実験の標準抗原として使用した。
- ヤギ抗トランスフェリン(ヒト)アフィニティー精製抗体 E**-**Y Laboratories (catalog # AF-010-2), San Mateo, CA 94401 US, tel: 415-342-3296, fax: 415-342- 2648. Accurate Chemicals社およびBoehringer Mannheim社の他の抗体も試験した。欧州のお客様は、Immunesystem AB (catalog # 02-020), Dag Hammarskjölds väg 26, Uppsala, P.O. Box 8012, S-750 08 Uppsala, Sweden, tel: 46-18-53 89 09, fax: 46-18-53 89 97 の鶏から単離したヒトトランスフェリン抗体の使用をご検討ください。
- Ovalbumin, Sigma Chemical社(カタログ番号A-5503)。
- PD-10® Sephadex G-25® カラム、Pharmacia Biotech(カタログ番号17-0851-01)。
- サンプルは、Molecular Devices Corporationの顧客のご厚意によりご提供いただいた。
方法
抗体の標識と保存
ヤギ抗トランスフェリン抗体は、Threshold System Operator's Manual の ILA セクションおよび ILA アプリケーションノート Optimizing the labeling of proteins に記載されている方法で標識した。抗ヒトトランスフェリンは、保存料であるアジ化ナトリウムを含む緩衝液中で供給されるため、標識の前に透析で除去する必要があります。そのため、抗体はリン酸緩衝生理食塩水(10 mMリン酸塩、150 mM NaCl、pH 7.0)に対して4℃で一晩透析した。DNP-ビオチン-NHSまたはフルオレセイン-NHSハプテンを、250μgの抗体とともに、遮光した室温で2時間インキュベートした。モルカップリング比(MCR)は、標識反応に使用したタンパク質(抗体)1モルあたりのビオチンまたはフルオレセインハプテンのモル数として定義される。フルオレセインとビオチンの標識には20:1のMCRが用いられた。
25mLのPBSで平衡化したPharmacia PD-10カラムに反応混合物を通すことにより、未反応のハプテンを標識抗体から分離した。タンパク質濃度、タンパク質回収率、モル取り込み比(MIR)は、Threshold System Operator's Manual の ILA セクションに記載されているように計算しました。MIRは、タンパク質(抗体)1モルあたり共有結合したハプテンの平均モル数として定義されます。表 2 は、3 つの独立した標識反応で得られたモル取り込み比を示しています。抗体のストック濃度は約0.5 mg/mLであった。
| 標識番号 | MIR Biotin/Ab | MIR Fluorescein/Ab |
|---|---|---|
| 1 | 4.7 | 5.4 |
| 2 | 4.3 | 4.1 |
| 3 | 4.4 | 4.2 |
表2:3種類の標識で得られたモル導入比
標識後、抗体をキャリアータンパク質として 1 mg/mL のオバルブミンを含む BSA フリー Assay Buffer で 10 µg/mL に希釈した。このアリコートをSarstedt滅菌チューブに入れて-20℃で保存した。
試験あたりの抗体の最適濃度の決定(ローディング試験)
3つの濃度のビオチン化および蛍光標識抗ヒトトランスフェリン抗体(10、20、および40 ng/test)を4つの濃度のヒトトランスフェリン(0、0.2、2.0、および20 ng/mL)で試験し、バックグラウンド率と反応の「傾き」を評価した。傾きとは、抗原濃度の変化に対するシグナルの変化を測定したものである。逐次インキュベーションプロトコールによるサンドイッチ形式を用い、室温で 2 時間のインキュベーションを行った(Threshold System Operator's Manual の ILA の項を参照)。
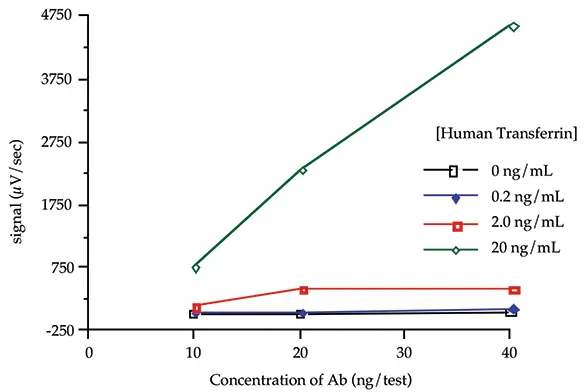
図1:負荷試験
図 1 のデータは、各標識抗体を 20 ng/test (200 ng/mL) 含む抗体の組み合わせが、許容可能なバックグラウンドシグナルを生成し (0 ng/mL ヒトトランスフェリン時)、0.2、2、20 ng/mL 抗原レベルでも満足のいくシグナル増加を生じたことを示しています。本アプリケーションノートで引用する残りの実験では、各抗体濃度 20 ng/test を使用した。
アッセイプロトコル
ステップ 1 ヒトトランスフェリン標準曲線をポリプロピレンチューブに調製する。ヒトトランスフェリン標準品(ストック濃度 10 mg/mL) を BSA フリーアッセイバッファーで希釈します。標準品は0.2ng/mLから20ng/mLの範囲で、中間標準品は0.5、1.0、2.0、5.0、10ng/mLです。
ステップ2 ポリプロピレンチューブにBSAを含まないアッセイバッファーで検体を希釈します。
ステップ 3 ビオチン化抗体と蛍光標識抗体をそれぞれ20 ng/test(200ng/mL)の濃度でBSAフリーのアッセイバッファーに溶解し、ポリプロピレンチューブに調製します。
ステップ 4 各ヒトトランスフェリン標準品および各サンプルを 100μL ずつ、適切なチューブに分注します。
ステップ5 ステップ3で調製した抗体100μLを、エッペンドルフのリピーターピペッターとCombitip® を用いてチューブに分注します。
ステップ6 チューブをパラフィルムで覆い、ラックを振って混合し、室温で2時間インキュベートします。
ステップ 7 BSAを含まないアッセイバッファー25mLでキャプチャー試薬を再構成します。再構成したキャプチャー試薬を BSA フリーアッセイバッファーで 1:10 に希釈します(キャプチャー試薬 1 容量+BSA フリーアッセイバッファー 9 容量)。インキュベーションが終了したら、エッペンドルフのリピーターピペッターとコンビチップを用いて、希釈した Capture Reagent を各チューブに 1 mL ずつ分注します。
ステップ8 反応混合物をろ過ユニットに移す。フィルターベースとフィルターブロックは新品でも再使用でもかまいません(洗浄方法については ILA 検出キットの添付文書を参照)。低真空でろ過する。
ステップ9 ろ過ステップの間に、酵素試薬をバイアルあたり 4 mL の BSA フリーアッセイバッファーで再構成します。再構成した酵素試薬の1:10希釈液を調製します(酵素試薬1容量+BSA不含アッセイバッファー9容量)。
ステップ 10 ろ過ユニットのウェルが空になったら、各ウェルに Wash Buffer 2 mL を分注し、高真空でろ過する。真空を切ります。
ステップ 11 希釈した酵素試薬 1 mL を、エッペンドルフのリピーターピペッターとコンビチップを用いて各ウェルに分注し、低真空でろ過します。
ステップ 12 濾過ユニットのウェルが空になったら、各ウェルに洗浄液を 2 mL ずつ分注し、高真空で濾過する。真空を止め、スティックを読み取ります。
アッセイ特性評価
標準曲線
標準曲線の最低検量線は、バックグラウンドシグナルに対して30~50μV/秒のシグナル増加を生じるヒトトランスフェリンの濃度を計算することにより選択した。この計算は負荷試験の結果に基づいて行われた(Threshold System Operator's ManualのILAセクションの "S andwich Assay Optimization "を参照)。他の標準曲線キャリブレーターは、最も低いキャリブレーターの 2 log (100 倍)上の範囲に分布していました(図 2 参照)。二次方程式が標準曲線を最適に定義しました。
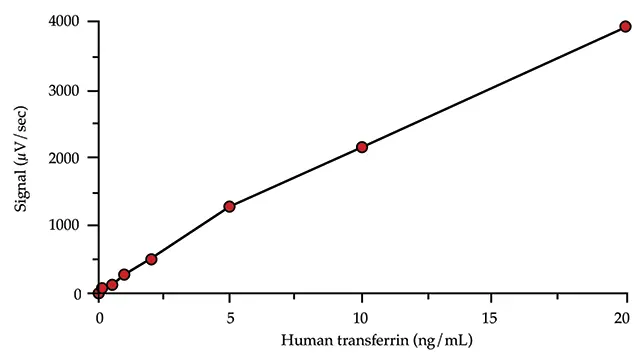
図2:標準曲線
インキュベーション時間
最適なインキュベーション時間を決定するために速度論的研究を行った。6種類の濃度のヒトトランスフェリン(20、10、5、1、0.5、0.2 ng/mL)を標識抗体とともに2時間、1時間、0.5時間、0.25時間インキュベートした。どのインキュベーション時間でも、同様のバックグラウンドシグナルが得られた。図3は、インキュベーション時間が長くなると傾きが大きくなることを示している。
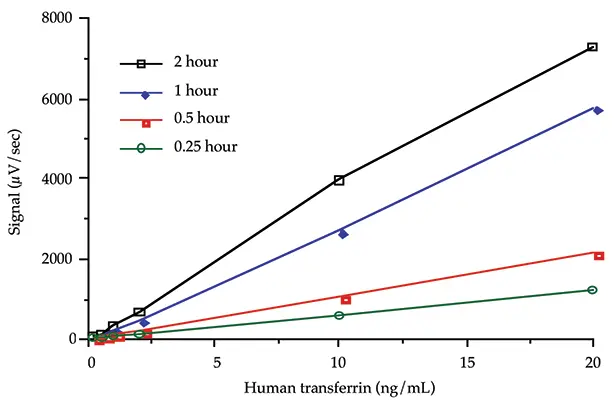
図3:速度論的研究
検出限界:
検出限界の評価についてはThreshold System Operator's Manualを参照。この特異的アッセイでは、0.2 ng/mLのヒトトランスフェリンをバックグラウンドから4標準偏差の分離で検出することができます。
アプリケーション
アッセイ性能は、ヒトトランスフェリンの混入について異なるタンパク質サンプルを試験することにより評価されました。サンプルはノンスパイクおよび既知濃度のヒトトランスフェリンをスパイクして試験し、スパイク回収率(% SR)は以下のように計算しました:

許容可能なスパイク回収率は100±20%と定義され、試料が汚染ヒトトランスフェリンの正確な定量の妨げになるかどうかを判断するために使用されます。
マウスIgGサンプル
2種類の異なるマウスIgG抗体サンプルについて、汚染ヒトトランスフェリンの試験を行いました。どちらのサンプルも、1000 pg/mL のヒトトランスフェリンのスパイクあり/なしで評価しました。サンプル#1は1:50,000希釈で、サンプル#2は1:500希釈で検査しました。結果を表3に示します。
| サンプル | スパイクされたサンプル (pg/mL) | スパイクされなかったサンプル (pg/mL) | ネットスパイク (pg/mL) | % スパイク回収率 |
|---|---|---|---|---|
| BSA フリーアッセイバッファー | 1014.7 | 0.0 | 1014.7 | |
| サンプル#1 | 2454.2 | 1491.9 | 962.3 | 95% |
| サンプル#2 | 2470.9 | 1512.1 | 958.8 | 95% |
表3:汚染ヒトトランスフェリンに対するマウスIgGの分析
サンプル#1とサンプル#2のヒトトランスフェリン濃度は、それぞれ74.6 µg/mLと756 ng/mLと判定されました。
アッセイ精度
上記の2つのマウスIgGサンプルは、日々の再現性を調べるために、6つの異なる日に3連で試験されました。同じ実験内での再現性は、6つの複製を試験することで調べました。以下の表は、良好なアッセイ内再現性と日々の再現性を示しています。
| サンプル#1 アッセイ内再現性 |
サンプル#2 アッセイ内再現性 |
||
|---|---|---|---|
| 日間 | 定量(pg BSA/mL) | 日間 | 定量(pg BSA/mL) |
| 1 | 1436.9 1530.8 1480.4 1549.1 1612.4 1430.1 |
1 | 1505.7 1440.0 1425.3 1427.6 1517.9 1434.2 |
| 平均 | 1506.6 | 平均 | 1458.4 |
| 標準偏差 | 70.7 | 標準偏差 | 41.8 |
| C.V | 4.7% | C.V | 2.9% |
表4:ヒトトランスフェリンアッセイの反復性
| サンプル#1 日間再現性 |
サンプル#2 日間再現性 |
||
|---|---|---|---|
| 日間 | 定量(pg BSA/mL) | 日間 | 定量(pg BSA/mL) |
| 1 2 3 4 5 6 |
1393.0 1407.8 1470.8 1469.0 1506.6 1491.9 |
1 2 3 4 5 6 |
1353.1 1430.7 1568.0 1599.2 1458.5 1512.1 |
| 平均 | 1456.5 | 平均 | 1486.9 |
| 標準偏差 | 45.9 | 標準偏差 | 91.3 |
| C.V | 3.2% | C.V | 6.1% |
表5:ヒトトランスフェリンアッセイの再現性
要約
本アプリケーションノートに記載されたデータは、2 時間のインキュベーションと各標識抗ヒトトランスフェリン抗体 20 ng/test を用いて作成されました。これらの条件により、ダイナミックレンジは2対数(100倍)、ヒトトランスフェリンの検出限界は0.2 ng/mLとなります。インキュベーション時間を短縮してより迅速なアッセイを行うことも、より高感度なアッセイを行うためにインキュベーション時間を長くすることもできます。アッセイ性能のバリデーションは、試験する製品ごとに決定する必要があります。
PDF版(英語)