Application Note タンパク質標識の最適化
PDF版(英語)
はじめに
Threshold®イムノリガンドアッセイ(ILA)は、ビオチンまたはフルオレセイン標識を結合タンパク質および/またはリガンドに共有結合させることにより、ELISA、RIAまたは放射性レセプターアッセイで使用される試薬をThresholdシステムにアダプターします。タンパク質の標識および精製を簡便にするため、Molecular DevicesはビオチンおよびフルオレセインをN-ヒドロキシスクシンイミドエステルとして製剤化し、それぞれBiotin LabelおよびFluorescein Labelと呼んでいます。これらの使用法の詳細はThreshold System Operator's Manualに記載されています。このアプリケーションノートでは、Threshold ILA アッセイで使用する結合タンパク質の標識に影響するパラメータについて説明します。
標識とは、タンパク質のビオチン化または蛍光標識のことです。他の化学反応と同様に、標識は pH、反応物の濃度、インキュベーション時間と温度、試薬の純度、妨害物質の存在などの条件に左右されます。利用可能なリジン残基の数や、高分子の構造、活性、安定性への寄与を一部反映して、個々のタンパク質は修飾に対してユニークな感受性を持つ。
簡単に参照できるように、このアプリケーションノートをThreshold System Operator's Manualに保管してください。
材料
-
Molecular Devices CorporationのThreshold® System(カタログ番号0200-0500)、1311 Orleans Drive, Sunnyvale, CA 94089、電話:408-747-1700または800-635-5577。
-
Molecular Devices CorporationのImmuno-Ligand Assay Labeling Kit(カタログ番号R9002)。
-
Molecular Devices CorporationのImmuno-Ligand Assay Detection Kit(カタログ番号R9003)。
-
Sephadex® G-25カラムはPharmacia Biotechから購入した(PD-10、カタログ番号17-0851-01)。
一般的推奨事項
以下の一般的な推奨事項はThreshold System Operator's Manualに記載されているもので、どこから始めるべきかのガイドとなります。
- 反応にはアジ化ナトリウムのような求核剤を含まないリン酸緩衝生理食塩水(10 mM リン酸ナトリウム、150 mM NaCl、pH 7.0-7.2)を使用する。
- タンパク質との反応は1 mg/mLで行うが、0.1 mg/mLという低濃度でも可能な場合がある。
- 新しいタンパク質の初期研究では、複数のモルカップリング比を試してみる。最初は10:1から40:1の比率から始める。暗所(すなわち、実験室の引き出しの中)で18-25℃(室温)で2時間反応させる。
- 最初のアッセイを実施するのに十分な量のタンパク質を標識する。サンドイッチ形式を用いる場合、6回の最適化実験には、単一モルカップリング比で標識した0.25mgのタンパク質で十分である。
- 標識条件が最適化されたら、より大量のタンパク質を標識する。標識後、安定性を最大にするため、担体タンパク質と保存剤を加えたバッファーで希釈し、分注後、凍結保存する。
一般的方法
このアプリケーションノートに記載されている実験では、ヤギの免疫アフィニティー精製抗体、プロテインA精製マウス免疫グロブリンG(IgG)、ウシ血清アルブミン(BSA)を使用した。タンパク質を標識するために、ビオチン標識またはフルオレセイン標識をジメチルホルムアミドに溶解し、最終的なモルカップリング比が20:1になるようにタンパク質に加えた。反応は20℃で2時間行った。標識タンパク質をSephadex G-25カラムを用いたゲルクロマトグラフィーで精製した。吸光度は280 nm、362 nmまたは490 nmで測定した。濃度とモル取り込みは、Threshold System Operator's Manual の記載に従って計算した。
モル結合比(MCR)は、最初の反応混合物中のタンパク質1モルあたりの標識のモル数として定義される。一方、モル取り込み比(MIR)は、タンパク質標識の程度を示す指標であり、タンパク質1モル当たり共有結合した標識の平均モル数である。次のページでは、モル取り込み比の依存性について説明する:
- 緩衝液のpH
- タンパク質の濃度
- モル結合比
- 反応のインキュベーション時間
- バッファー中のNaCl濃度
- 緩衝液中の洗剤
- 妨害物質の存在
このアプリケーションノートでは、最適なモル組込みと、未反応または加水分解した標識試薬が標識タンパク質から分離されずに残った場合の影響についても説明しています。
緩衝液のpH
一般に、タンパク質はpH 7で標識されるべきである。Biotin標識またはFluorescein標識によるタンパク質の標識化学反応は求核置換であり、活性な求核剤は通常、タンパク質中のリジンの非プロトン化εアミンである。リジンのε-アミンのpKaは約10.5なので、pHが7より低いとε-アミンのプロトン化が起こり、反応性を示すアミン基の割合が非常に少なくなる。反応混合物のpHを上げると、標識と競合する求核剤であるヒドロキシルイオンの濃度が上昇する。したがって、標識反応には最適なpHが存在する。
標識反応混合物のpHがモル導入量に及ぼす影響を図1に示す。マウスIgGを封じ込めたバッファーをSephadex G-25カラムで10 mM酢酸ナトリウム(pH 4.0)、10 mM酢酸ナトリウム(pH 5.0)、10 mM EDTA(pH 6.0)、10 mMリン酸ナトリウム(pH 7.0)、10 mMリン酸ナトリウム(pH 8.0)または10 mMホウ酸ナトリウム(pH 9.0)と交換した。IgGは適切な緩衝液で0.33 mg/mLに希釈した。NaClは150 mMであった。いずれのラベルもpH8で高レベルの置換が起こった。pHを9.0に上げると、ビオチン標識のモル導入は最適でなくなった。ビオチン標識の反応性が低下したのは、アルカリ性pHでの水溶性が低下したためと考えられる。
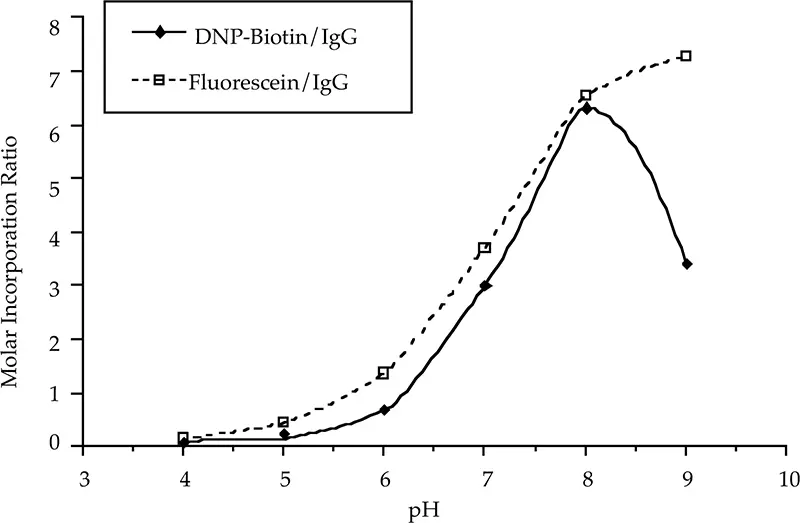
図1:モル導入量に対する緩衝液pHの影響。
標識が困難なタンパク質は、緩衝液のpHを8(フルオレセインの場合は9)に上げると効果的である。標識はタンパク質の塩基性基を中性のビオチン基または酸性のフルオレセイン基に置換し、タンパク質の等電点を変化させる。バッファーのpHをタンパク質の等電点に調整すると、タンパク質が沈殿することがある。高モル数の取り込みはタンパク質の安定性を低下させる可能性があるため、最大標識は最適標識とは異なる場合がある。モノクローナル抗体の中には、高いモル数、あるいは中程度のモル数のカップリング比で反応させると沈殿するものが観察されている。
タンパク質濃度
モル取り込みと反応速度は反応物濃度に依存する。図2は、モルカップリング比を一定に保ちながらタンパク質濃度を低下させた場合(すなわち、標識濃度も低下させた場合)のモル取り込みへの影響を示している。
0.1、0.25、0.5、1.0 mg/mL のマウス IgG をモルカップリング比 20:1 で pH 7.0 で 2 時間 Fluorescein 標識と反応させた結果、モル取り込みはそれぞれ 2.7、3.6、4.2、5.0 となった。同じ条件下でマウスIgGとビオチン標識体を反応させると、モル取り込みはそれぞれ1.6、2.6、4.2、5.0となった。これらの反応条件下で2つのラベルを比較すると、ビオチンラベルの濃度を下げる方が標識反応速度を下げる効果が大きいことがわかる。反応混合物中の標識不要濃度が低下すると、個々のタンパク質分子への標識取り込み速度が低下する。低タンパク質濃度で遊離標識濃度が低いために標識の取り込みが不十分な場合は、インキュベーション時間を長くしたり、モルカップリング比を大きくして反応速度を速めたりすることで補うことができます。これらについては次のセクションで説明する。
図2に示したタンパク質濃度の最低値0.1 mg/mLは、ビオチン標識の取り込みについて分光光度計で容易に分析できる最小値である。
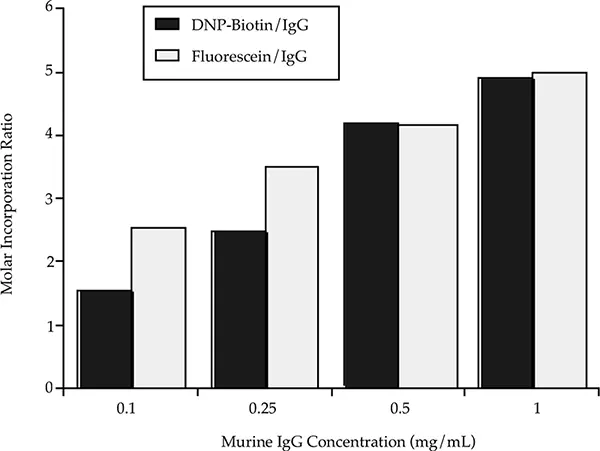
図2:タンパク質濃度がモル取り込みに及ぼす影響。
モル結合比
モル結合比は、最初の反応混合物中のタンパク質1モルあたりの標識のモル数として定義される。低濃度のタンパク質を標識する場合、モルカップリング比を大きくすることで、一定のモル取り込みを達成することができる。あるタンパク質を、ある濃度で、ある時間に、望ましいモル取り込みをもたらすモルカップリング比を推定する簡単で信頼できる方法はない。最適な標識条件は、モルカップリング比を変化させることで確立する必要がある。Threshold System Operator's Manualでは、抗体分子の標識に10:1から40:1の範囲のモルカップリング比を試してみることを推奨しています。推奨されるモルカップリング比の範囲は、異なるタンパク質の分子量やリジン含量のばらつきにより調整が必要な場合があります。簡単な補正係数は、タンパク質の分子量と免疫グロブリンの分子量(160,000ダルトン)の比です。高分子量のタンパク質ではモルカップリング比を比例して大きくし、低分子量のタンパク質では小さくする。ジメチルホルムアミドに対するタンパク質の耐性が、使用するモルカップリング比の上限を決めると思われる。
モルカップリング比とモル導入量の関係を表1に示す。マウスIgG FcおよびFab領域に対する親和性精製ヤギポリクローナル抗体をリン酸緩衝生理食塩水、pH7.0で1.0 mg/mLに希釈した。Biotin LabelとFluorescein Labelをそれぞれ2時間反応させた。反応量は330 µLで、モルカップリング比は5:1、10:1、20:1、40:1であった。取り込みは、モルカップリング比が5:1から20:1の間で直線的に増加した。タンパク質上の利用可能なアミン基の総数が、モル導入の上限を設定する。
|
MCR |
ビオチン/アンチF c |
MIR フルオレセイン/アンチF ab |
|---|---|---|
| 5:1 | 1.4 | 1.7 |
| 10:1 | 2.5 | 2.8 |
| 20:1 | 4.4 | 5.0 |
| 40:1 | 7.2 | 9.0 |
表1:モル導入率(MIR)に及ぼすモルカップリング比(MCR)の影響。
反応時間
図3は、一定のモルカップリング比(20:1)で、3つの異なるタンパク質濃度について、ウシ血清アルブミン(BSA)へのフルオレセインのモル取り込みを時間の関数として示したものである。0.5、1または2 mgのBSAを封じ込めた1 mLのPBS(pH 7)を、室温で20:1のモルカップリング比でFluorescein Labelと反応させた。ジメチルホルムアミドの最終濃度は4% v/vであった。別々の反応を15分、30分、60分、120分行った。反応はSephadex G-25カラムでタンパク質と標識不要を分離することで停止した。
すべての場合において、3モルの取り込みに達するのに必要な時間は、タンパク質濃度に反比例した;タンパク質濃度を2倍にすると、同じモル取り込みに必要な時間は約半分になった。この効果は、モル結合比を一定に保ち、タンパク質濃度を下げると、標識試薬の濃度が低くなるためである。標識試薬の濃度低下による反応速度の低下を補うため、インキュベーション時間を長くすることができる。高pHで長時間インキュベートしても、ヒドロキシルアニオンが競合する求核剤であるため、抗体を最大に標識できない可能性がある。より良い代替案として、先に述べたように、反応速度を加速するためにモルカップリング比を増加させることができる。
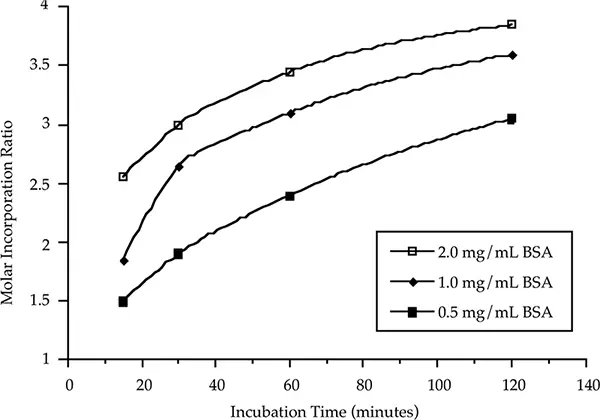
図3:反応時間とウシ血清アルブミン濃度がモル導入に及ぼす影響。
NaCl濃度
抗体は生理的食塩水(PBS)に似た緩衝液に保存されることが多い。PBSのイオン強度は標識効率に影響を与える可能性がある。ビオチンとフルオレセインのマウスIgGへのモル取り込みに対するNaCl濃度の影響を図4に示す。マウスIgGは、10-500 mM NaClを含む10 mMリン酸ナトリウム(pH 7)中0.33 mg/mLで標識した。
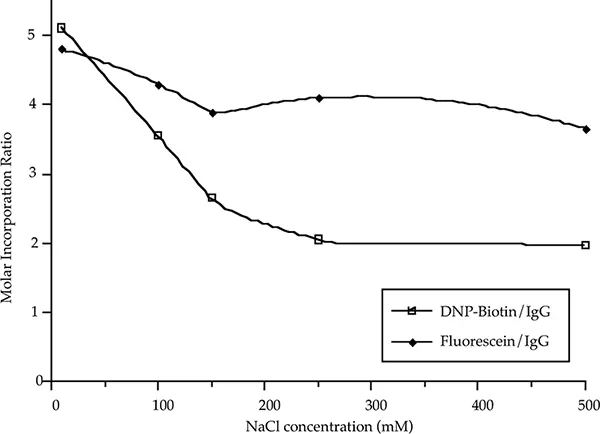
図4:モル取り込みに対するNaCl濃度の影響。
NaCl濃度を10~500 mMに変化させても、マウスIgGのFluorescein標識にはほとんど影響しなかった。しかし、わずか100 mMのNaClは、ビオチン標識のマウスIgGへのモル取り込みに著しい影響を与えた。ビオチン化に対するNaCl濃度の影響は、イオン強度が高くなるとビオチン標識の溶解度が低下するためかもしれない。サンプルのイオン強度が高いとビオチン化がうまくいかない可能性がある場合は、透析、ゲル濾過、その他の適切な緩衝液交換法によって塩を除去することができる。塩除去の後、タンパク質の濃縮が必要な場合がある。
バッファー中の洗剤
フルオレセインとビオチンのマウスIgGへのモル取り込みに対する5つの異なる洗浄剤の影響を図5に示す。マウスIgGを10 mMリン酸ナトリウム(pH7)150 mM NaCl中0.33 mg/mLにし、7 mM Zwittergent(3-12)、25 mM CHAPS、100 mM N-オクチルß-Dグルコピラノシド、4 mM Triton X-100、または0.4 mM Tween-20のいずれかを加えた。いずれの場合も、洗浄剤の濃度は臨界ミセル濃度(CMC)を超えていた。Zwittergent (3-12)、CHAPS、N-オクチル-β-D-グルコピラノシドはCMCの5倍、Triton X-100とTween-20はCMCの15倍で使用した。洗剤の種類と濃度は、各洗剤の臨界ミセル濃度(CMC)以上の一般的な使用法を反映して選択した。
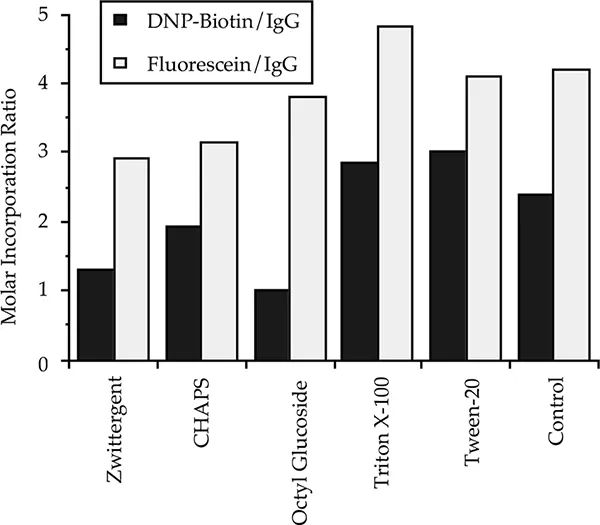
図5:モル導入率に対する洗浄剤の影響。
ZwittergentとCHAPSはモル組込み率を25%から50%低下させたが、より大きな影響はイオン性洗剤Zwittergentによるビオチンの組込み率の低下であった。非イオン性界面活性剤であるTriton X-100とTween 20は影響を及ぼさないか、あるいはフルオレセインとビオチンの両方の取り込みを増加させる傾向があった。非イオン性洗剤のオクチルグルコシドも同様に、フルオレセインの取り込みにはほとんど影響を与えなかったが、やや変則的にビオチンの取り込みを60%減少させた。疎水性基を持つ洗剤が標識効率を変えるメカニズムは、標識試薬やタンパク質の一部が洗剤ミセルに隔離されることかもしれない。洗剤はフルオレセイン標識よりもビオチン標識の標識に影響を与える傾向があり、これはおそらく前者の疎水性が大きいことを反映している。
洗剤の影響は、洗剤を除去することで除去できる。様々なメーカーがこの目的のためのクロマトグラフィー材料を販売している。デタージェントが標識タンパク質の溶解性に重要である場合は、モルカップリング比を上げるなど、デタージェント存在下でのモル導入量を増加させる他の方法を採用する。
妨害物質
反応混合物中に存在するタンパク質以外の求核剤は、標識試薬と競合する。アジ化ナトリウムは微生物の増殖を止めるために0.05%で使用されることが多いが、この濃度ではタンパク質とよく競合し、タンパク質へのモル取り込みを減少させる。同様に、汚染された無関係なタンパク質は、リジンアミンの形で求核剤と競合し、標識される。目的のタンパク質は十分に標識されるが、汚染タンパク質は目的のタンパク質へのモル取り込みの直接測定を妨害する。同様に重要なことは、標識された不純物が、酵素試薬またはキャプチャー試薬の有限な量と競合するほど豊富な場合、アッセイ性能に影響を与えることである。図6は、サンドイッチイムノアッセイにおいて、標識された無関係な免疫グロブリンと標識された特異性抗体を混合することにより、この現象をシミュレートしたものです。
このアッセイで使用した特異性ビオチン化捕捉抗体は、ヤギ由来の親和性精製抗ムラインFc(b-抗Fc)である。蛍光標識されたヤギ由来の抗ムラインFabがサンドイッチアッセイの第2成分であった。マウスIgGは1テストあたり1 ngの分析物であった。ウレアーゼ標識抗フルオレッセインが複合体と結合し、Threshold Systemリーダーで測定されるpH変化を引き起こした。アッセイは、b-抗Fcまたはb-抗Fcと30倍過剰のビオチン化非特異的IgGのいずれかを用いて構築した。後者の混合物は、親和性精製されていないポリクローナル抗血清をシミュレートした。
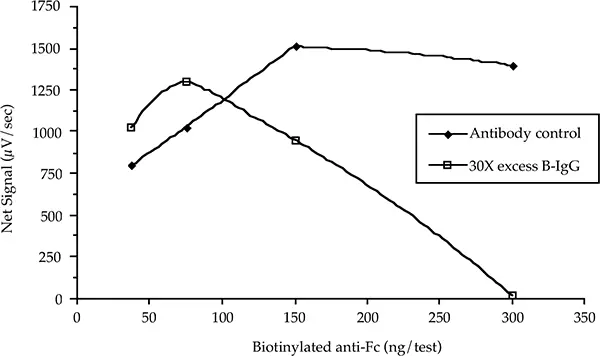
図6:マウスIgGに対するThreshold Immuno-Ligand Assayの性能に対するビオチン化非特異的IgGの影響。
ある種の低分子タンパク質をフルオレセイン標識すると、490 nmの吸光度から予想されるフルオレセインの取り込み量と比較して、280 nmの吸光度が誤って高くなることが観察されています。このような場合、標識タンパク質の正味回収率は、予想回収率の100%を超えることが多い。このような場合、独立した方法(ブラッドフォード法など)でタンパク質濃度を測定することができる。アッセイ性能の低下は、凝集した蛍光タンパク質が非特異的に結合し、分析物/ 抗原が存在しない場合にシグナルが上昇するために起こる可能性があります。結果を改善するために、標識条件を変更する(例えば、標識反応のpHを変更する)必要がある場合があります。
未反応の標識不要物質
Threshold System Operator's Manualでは、未反応遊離標識から標識タンパク質を精製することを推奨しています。アッセイ中のフルオレセインおよびビオチン結合能の総量により、アッセイが許容できる未反応または加水分解フルオレセインおよびビオチン標識試薬の量が決まります。酵素試薬が濾過工程の前に添加される場合(同時測定)、標識不要の標識は、特に標識がフルオレセインの場合、アッセイ応答を低下させる可能性がある。しかし、この精製ステップが望ましくない場合もある。フルオレセイン化タンパク質の通常の精製は、Enzyme Reagentをろ過捕捉ステップの後に添加し、希釈Enzyme Reagentをメンブレン上に捕捉された複合体を通過させてゆっくりろ過することで省略できるかもしれない(Sequential format)。
精製標識抗体と未精製標識抗体の性能を比較したマウスIgGのサンドイッチアッセイの結果を表2に示す。親和性精製したヤギ抗ムギIgG Fc(抗Fc)抗体とヤギ抗ムギIgG F(ab')2 [抗F(ab')2]抗体を、それぞれビオチン標識とフルオレセイン標識で、20:1のモルカップリング比で室温で2時間標識した。DNP-ビオチン標識抗体の半分とフルオレセイン標識抗体の半分をSephadex G-25カラムで精製した。ビオチン標識抗体とフルオレセイン標識抗体のモル導入率はそれぞれ4と5であった(すなわち、未反応または加水分解標識は、b-抗Fcとf-抗F(ab')2に対してそれぞれ5倍と4倍のモル過剰で存在した)。
精製および未精製の標識抗体は、SimultaneousまたはSequentialフォーマットを用いたマウスIgGのサンドイッチフォーマットアッセイで試験された。Simultaneousフォーマットでは、b-anti-Fcとf-anti-F(ab')2はそれぞれ100ng/テストと10ng/テストで存在した。未精製の標識抗体(「標識不要」)を用いたSimultaneousフォーマットにおけるシグナルの減少は、標識結合能がアッセイ応答を制限している可能性を示唆している。Sequentialフォーマットでは、両方の標識抗体が100 ng/testで存在し、達成されたシグナルはSimultaneousフォーマットよりも大きかった。Sequential フォーマットは遊離標識の量が10倍であるにもかかわらず、はるかに高いシグナルを示したことから、酵素試薬のフルオレセイン結合能に限界があり、Sequential フォーマットを使用することで克服されたことが示唆された。
未反応の遊離標識はSimultaneousフォーマットでは妨害となり、1000 pgの分析物ではレートが低下した。Sequential フォーマットを使用することで、この影響は解消された。酵素試薬のフルオレセイン結合能には限界があるため、Simultaneous フォーマットのアッセイにおけるフルオレセイン標識結合タンパク質の最適量は通常≤25 ng/testです。
| 速度(μV/sec) | 速度(μV/sec) | ||
|---|---|---|---|
| 1000 pg | 0 pg | ||
|
同時 |
精製 標識不要 |
1648 + 106 824 + 70 |
137 + 12 139 + 12 |
|
連続 |
精製 標識不要 |
4902 + 194 4792 + 124 |
172 + 11 188 + 10 |
表2:同時測定における未反応標識の除去の重要性。
最適なモル導入量
ポリクローナル抗体の最適なモル導入量は、抗体あたり3~5ハプテンです。標識されるタンパク質がIgGと比較して極端に小さい、または大きい場合、標識反応混合物中の標識試薬の望ましいモル濃度を維持するために、これらの値をそれぞれ減少または増加させることができる。フルオレセイン標識のモル濃度は、Sequential形式ではやや高めの方が最適かもしれない。経験則では、モルカップリング比が20:1であれば、1 mg/mLのポリクローナル免疫グロブリンのほとんどが上記の目標レベルまで標識される。
結論
最適なモル導入量と最適なモル導入量を得るための反応条件はタンパク質によって異なるため、経験的に決定する必要がある。Threshold System Operator's Manual では、ほとんどの IgG タンパク質で最適な反応条件を推奨しています。このアプリケーションノートでは、様々な個々のタンパク質や標識条件で最適な標識化を達成するための標識化パラメータの相互関係に関する追加情報を提供します。
PDF版(英語)