Application Note プロテインG汚染アッセイ
PDF版(英語)
はじめに
G群連鎖球菌の細胞壁から精製されたプロテインGは、抗体のFc領域に結合する30,000~35,000ダルトンのタンパク質である1 。この特性は抗体の精製に利用されている3 。共有結合したプロテインGを含むクロマトグラフィー用培地やメンブレンは、溶液から抗体を捕捉し、他の成分はカラムやメンブレンを通過する。結合した抗体はpHを下げることで溶出される。このようにして精製され、医薬品として使用される抗体は、これらの培地から溶出した可能性のあるプロテインGについて検査されなければならない。
このアプリケーションノートでは、市販の抗体を用いたプロテインGコンタミネーションアッセイの予備的性能について説明します。プロテインGはそのFc領域に非常に弱いか、全く結合しない2,3ため、ニワトリ抗プロテインG抗体が選択された。本書は手引きとして作成されたものであり、本アッセイの検証を意味するものではなく、また必ずしも最適な性能パラメータを示すものでもありません。
アルブミンとの結合部位を含まない組換え型プロテインGを、特に断りのない限り、以下のデータの標準として使用した。全てのサンプル、標準品、標識抗体は ILA Assay Buffer で希釈した。
材料
- Molecular Devices CorporationのThreshold® System(カタログ番号0200-0500)、1311 Orleans Drive, Sunnyvale, CA 94089, tel: 408-747-1700 または 800-635-5577。
- Molecular Devices CorporationのImmuno-Ligand Assay Labeling Kit(カタログ番号R9002)。
- Molecular Devices CorporationのImmuno-Ligand Assay Detection Kit(カタログ番号R9003)。
- 組換えプロテインGおよび精製プロテインGは、CalBiochem(それぞれカタログ番号539303、およびカタログ番号539302、カリフォルニア州サンディエゴ、TEL:800-854-3417または619-450-9600)から購入した。
- ポリクローナルニワトリ抗タンパク質G抗体(リコンビナントタンパク質Gに対して上昇させ、免疫アフィニティー精製)は、OEM Concepts, Toms River, New Jersey, tel: 908-341-3570から購入した。
- Sephadex® G-25カラムはPharmacia Biotechから購入した(PD-10、カタログ番号17-0851-01)。
- サンプル抗体(HuIgG、MuIgG 1、MuIgG 2a、MuIgG 2b、Rat IgG 2b )は、Molecular Devices Corporationの顧客のご好意により提供された。
方法
抗体の標識
ニワトリ抗タンパク質 G 抗体は、Threshold System Operator's Manual の ILA セクションおよび ILA アプリケーションノート Optimizing the labeling of proteins に記載されている方法で標識した。ニワトリ抗プロテイン G 抗体は、標識前にアジ化ナトリウムを除去するため、PBS に対して 4℃で一晩透析した。抗体のアリコートを、ビオチン DNP-NHS またはフルオレセイン NHS と 20:1 のモルカップリング比(MCR)で、暗所、室温で 2 時間インキュベートした。MCRは、標識反応に使用したタンパク質1モルあたりのビオチン標識またはフルオレセイン標識(ハプテン)のモル数として定義される。
未反応の標識は、25mLのPBSで平衡化したPharmacia PD-10カラムに反応液を通すことにより抗体から分離した。タンパク質濃度とモル取り込み比(MIR)は、Threshold System Operator's ManualのILAセクションに記載されているように計算した。MIRは、タンパク質1モルあたり共有結合した標識の平均モル数として定義される。標識抗体は ILA Assay Buffer で 10 μg/mL に希釈し、250 μL のアリコートを-20℃で保存した。1.3mg/mLで標識した抗体のMIRは、ビオチン化ニワトリ抗タンパク質Gで5.4、蛍光標識ニワトリ抗タンパク質Gで5.2であった。ニワトリ抗タンパク質G抗体の標識の違いにより、バックグラウンド率(μV/sec)に若干のばらつきが観察されたが、感度とダイナミックレンジは一貫していた。
試験あたりの最適な抗体濃度の決定(負荷試験)
各標識抗体の4つの濃度(12.5、25、50、100 ng/test)を3つの分析物濃度(0、100 pg/mL、1000 pg/mL)で試験し、バックグラウンド率と勾配を評価した(アッセイプロトコルの詳細は次ページ以降に記載)。ビオチン化抗体と蛍光標識抗体を同量使用したのは、同じポリクローナル抗体を標識したため、両方の標識抗体が被分析物の同じ結合部位で競合するためである。ビオチン化抗体と蛍光標識抗体を同量ずつ使用することで、被分析物とビオチン化抗体と蛍光標識抗体の結合確率を最大にすることができます。各標識抗体50 ng/testは、最小バックグラウンド率(0 pg/mL Protein G)と被分析物存在下での最大勾配(100 pg/mL Protein Gおよび1000 pg/mL Protein G)の間の最良の妥協点であった。この抗体の組み合わせは、本アプリケーションノートで説明する残りの実験に使用した。
測定プロトコール
ステップ 1 Protein G 標準曲線をポリプロピレンチューブに調製する。Protein G 標準物質を Assay Buffer で希釈する。標準品は 25 pg/mL~5000 pg/mL の範囲です。
ステップ 2 検体をポリプロピレンチューブのAssay Bufferで希釈します。
ステップ 3 ビオチン化抗体と蛍光標識抗体をそれぞれ 50 ng/test(500ng/mL)の濃度でアッセイバッファーと混合し、ポリプロピレンチューブに調製します。
ステップ 4 Protein G 標準品と検体をそれぞれ 100 μL ずつチューブに分注します。
ステップ5 ステップ3で調製した抗体100μLをエッペンドルフのリピーターピペッターとCombitip® を用いてチューブに分注します。
ステップ6 チューブをパラフィルムで覆い、ラックを振って混合し、室温で2時間インキュベートします。
ステップ7 キャプチャー試薬を25mLのアッセイバッファーで希釈します。再構成したキャプチャー試薬をアッセイバッファーで1:10に希釈します(キャプチャー試薬1容量+アッセイバッファー9容量)。インキュベーションが完了したら、エッペンドルフのリピーターピペッターとコンビチップを用いて、希釈した Capture 試薬を各チューブに 1 mL ずつ分注します。
ステップ 8 反応混合物をろ過ユニットに移す。フィルターベースとフィルターブロックは新品でも再使用でもかまいません(洗浄方法については ILA 検出キットの添付文書を参照)。低真空でろ過する。
ステップ 9 ろ過ステップの間に、酵素試薬をバイアルあたり 4 mL のアッセイバッファーで再構成します。再構成した酵素試薬の1:10希釈液を調製します(酵素試薬1容量+アッセイバッファー9容量)。
ステップ 10 ろ過ユニットのウェルが空になったら、各ウェルに Wash Buffer 2 mL を分注し、高真空でろ過する。真空を切ります。
ステップ 11 希釈した酵素試薬 1 mL を、エッペンドルフのリピーターピペッターとコンビチップを用いて各ウェルに分注し、低真空でろ過します。
ステップ 12 濾過ユニットのウェルが空になったら、各ウェルに洗浄液を 2 mL ずつ分注し、高真空で濾過する。
ステップ13 ウエルが空になったら、真空を止め、スティックを読み取ります。
アッセイ特性評価
標準曲線
標準曲線の最低検量線は、バックグラウンド速度より30~50μV/sec増加する組換えプロテインGの濃度を計算することにより選択した。計算は、負荷試験で観察された勾配を用いて行った。他のキャリブレーターは、アッセイの許容範囲である25 pg/mLから5000 pg/mLに均等に分布させた(図1は、5000、2500、1250、625、156、50、25、0 pg/mLのプロテインG濃度を用いた標準曲線を示している)。二次方程式が標準曲線を最もよく定義した。
精製プロテインGも、これらの標識抗体を用いて標準品として試験した。精製プロテインGを標準物質として用いると、リコンビナントプロテインGと比較して10倍感度が低くなる(図2)。このアッセイで使用したニワトリ抗プロテインG抗体は、リコンビナント分子(アルブミン結合部位を欠く)に対して上昇させたものである。組換えプロテインGは、本アプリケーションノートにおける残りの実験に使用された。
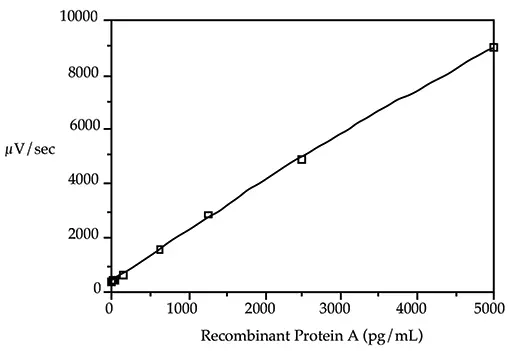
図1:組換えプロテインG標準曲線
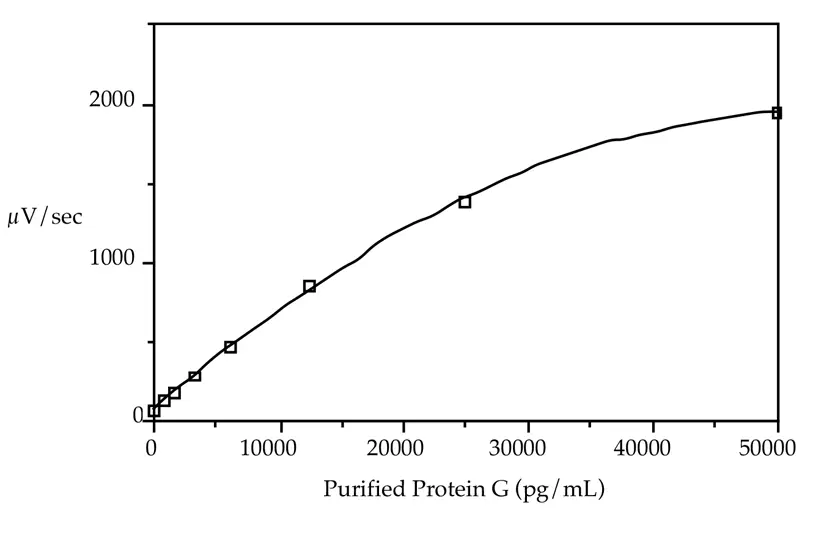
図2:精製プロテインG標準曲線
インキュベーション時間
最適なインキュベーション時間を決定するために速度論的研究を行った。4段階の分析対象物(0 pg/mL, 200 pg/mL, 1000 pg/mL, 3500 pg/mL)を標識抗体とともに30分、1時間、2時間、4時間インキュベートした。標準曲線と *(0 pg/mL)および #(1250 pg/mL)サンプルは、すべてのスティックで 4 時間インキュベートした。反応は4時間では平衡に達しなかった(図3)。このアプリケーションノートの残りの部分の実験では、便宜上、また十分なダイナミックレンジが得られたため、2 時間のインキュベーション時間を選択しました。選択したインキュベーション時間が標準曲線の特性評価に当初使用した時間と異なる場合は、新しいインキュベーション時間を使用して標準曲線範囲を再定義する必要がある場合があります。
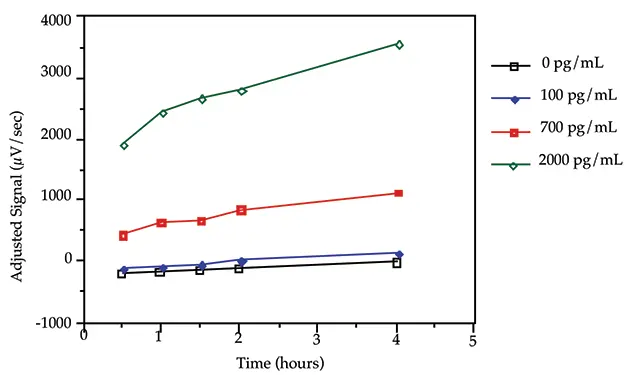
図3:シグナルに対するインキュベーション時間の影響
検出限界
検出限界の評価についてはThreshold System Operator's Manualを参照してください。この特異的アッセイでは、25 pg/mL のプロテインGをバックグラウンドから4標準偏差の分離で検出することができます。
アプリケーション
アッセイ性能は、数種類の抗体の存在下で検討されました: MuIgG1、MuIgG2a、MuIgG2b、HuIgG、Rat IgG2b。これらの製品抗体の存在下で、組換えプロテインGのスパイク回収率と検出限界を測定しました。
製品抗体存在下でのスパイク回収率
組換えプロテインGの1 ng/mLスパイクの回収率を、異なる種およびサブクラスの抗体の濃度範囲の存在下で試験した。各実験には緩衝液コントロールが含まれた。スパイク回収率は以下のように計算した:
平均 µV/sec スパイク検体 平均 µV/sec 非スパイク検体
-------------------------------------------------------------------------------------------- × 100 = %SR
平均 µV/sec スパイク緩衝液 平均 µV/sec 非スパイク緩衝液
許容可能なスパイク回収率は 100%±20%と定義しました。2回の独立した実験において、スパイクの完全回収が可能であった各サンプル抗体の濃度を表1に示す。スパイク回収率は種やサブクラスに依存するだけでなく、同じ種やサブクラスの異なる抗体でも異なる場合があります1。サブクラスが不明な3種類のヒトIgGを試験したが、スパイク回収率は受け入れられなかった(10μg抗体/mLでわずか7%)。
| 抗体種およびサブクラス | スパイク完全回収を示した製品抗体の最高濃度 |
|---|---|
| MuIgG 1 |
40 μg/mL |
| MuIgG 2a |
14 μg/mL |
| MuIgG 2b |
10 μg/mL |
| ラットIgG 2b |
60 μg/mL |
表1:製品抗体存在下でのスパイク回収率
製品抗体存在下での検出限界
上記で試験した抗体存在下での検出限界は、表1に示した抗体濃度を用いて、2回の独立した実験で決定した。検出限界はparts per million (ppm)、プロテインGの質量/抗体の質量で表した(表2)。
| 抗体種とサブクラス | 検出限界(2回の実験結果) |
|---|---|
| MuIgG 1 |
2 ppm |
| MuIgG 2a |
10 ppm |
| MuIgG 2b |
10 ppm |
| ラットIgG 2b |
1ppm* |
表2: 製品抗体存在下での検出限界。*単一実験の結果
要約
本アプリケーションノートのデータは、インキュベーション時間2時間、各標識抗体50 ng/試験で作成されました。これらの条件により、高感度(1~10 ppm)で定量的、かつダイナミックレンジの広い汚染プロテイン G の測定が可能です。例えば、インキュベーション時間を長くして感度を上げたり、インキュベーション時間を短くして迅速な(しかし感度は低い)アッセイを開発することができる。試験された様々な製品抗体について決定された検出限界レベルは、全ての抗体を代表しているとは限らない。アッセイ性能のバリデーション、特に検出限界は、試験した各製品抗体について決定する必要があります。
参考文献
- Bjorck, L. and Kronvall, G. 新規IgG結合試薬Streptococcus Protein Gの精製といくつかの特性。J. Immunol. 133 (2):969-973 (1984).
- Fahnestock, Steven R. クローニングされた連鎖球菌プロテインG遺伝子。Trends in Biotechnology 5(3):79-83 (1987).
- Harlow E. and Lane D. Antibodies: A Laboratory Manual. コールド・スプリング・ハーバー、615-622頁(1988年)。
PDF版(英語)