Application Note SpectraMax MiniMaxサイトメーターで
スライドベースのサンプルを画像化する
- スライドベースのサンプルから高画質画像を取得
- 様々な種類の組織の同定と分析
- 顕微鏡スライド、ペトリ皿、その他マイクロプレートフォーマット以外のプレート寸法をカスタム作成可能
- 直感的なSoftMax Proソフトウェアにより、画像処理の専門家でなくても利用可能
PDF版(英語)
はじめに
細菌塗抹標本から組織切片に至るまで、生物製剤のサンプルは一般的に顕微鏡スライド上で研究される。明視野画像や蛍光イメージャーを用いることで、研究者はスライドベースのサンプルの細胞学的あるいは形態学的変化を研究することができる。スライド顕微鏡観察には従来、顕微鏡システムが必要であったが、マイクロプレートリーダーシステムがスライドベースのイメージングを行う機能を進化させ始めた。
SpectraMax® i3x マルチモードマイクロプレートリーダーとSpectraMax® MiniMax™ 300イメージングサイトメーターは、専用のスライドアダプターを使用してスライドをイメージングできます。透過光(TL)、緑色(Ex/Em:460/541)、赤色(625/713)の蛍光チャンネルを備えたMiniMaxサイトメーターとSoftMax® Proソフトウェアを使用することで、さまざまな組織ベースのサンプルを画像化し、解析することができます。
このアプリケーションノートでは、MiniMax サイトメーターがスライドベースのサンプルからどのように高品質の画像とデータを取得できるかを紹介します。
資料
- SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices社、型番:i3x)
- SpectraMax MiniMax® 300イメージングサイトメーター(Molecular Devices社カタログ番号5024062)
- スライドアダプター(Molecular Devices社、型番:#1-5200-1337)
- FluoCells Prepared Slide #1(ThermoFisher 社、カタログ番号 F36924)
方法
顕微鏡用スライドサンプルを保持するためにスライドアダプターを使用した(図1)。SoftMax® Proソフトウェアで現在のPlateタイプを編集し、別の名前で保存することで、スライドアダプターの寸法に対応する「カスタムプレート設定」を作成した。カスタムプレートを作成するには、"Settings "をクリックし、"Plate Type "タブを選択し、"Edit Plate "をクリックする(この例では96ウェルプレートフォーマットを使用)。スライド式アダプターに対応するように図2に示すような寸法を入力し、カスタム名で保存します。このカスタムプレート設定は、今後のスライドベースイメージング実験に使用することができる。

図1. スライドアダプター。スライドアダプターは、顕微鏡スライドをマイクロプレートリーダーで撮像できるように、SBS設置面積で特異的に設計されている。
FluoCells®で作製したスライドをスライドアダプターにセットし、前回作成したカスタムプレート設定を用いてイメージングした。使用した撮影設定を表 1 に示す。FluoCellsスライドには、蛍光染色されたウシ肺動脈 内皮(BPAE)細胞が封入されていた。SoftMax® Proソフトウェアを使用して"% cell coverage "を算出した。541波長を使用する "Field Analysis "設定を選択し、あらかじめ作成した "Cells "設定を使用して、細胞コンフルエント領域を同定した。これらの特定された領域は、図 3に見られるように紫色のオーバーレイで表示される。算出された細胞被覆率は、SoftMax Pro ソフトウェアの関連するプレートセクションとデータテーブルに表示されます。
| パラメータ | セル数の設定 | ||
|---|---|---|---|
| 光学構成 | SpectraMax® MiniMax 300イメージングサイトメーター | ||
| Read mode | イメージング | ||
| Read type | エンドポイント | ||
| 波長設定 |
透過光(TL) 541 nm (緑色蛍光) 713 nm (赤色蛍光) |
||
| 画像取得設定 |
TL露光:7ミリ秒 TLフォーカス調整: -460 μm* |
541露出:200ミリ秒 541 フォーカス調整: -410 μm* |
713露出:1600ミリ秒 713 フォーカス調整: -440 μm* |
| 画像解析の設定 |
分析タイプ:フィールド分析 対物レンズの波長:541イメージング |
||
*フォーカス調整値は、ここで使用するスライドのタイプに対応しています。他のスライドではフォーカス調整値が異なる場合があります。
表 1. FluoCellsで作製したスライドの撮影および解析設定。
脛骨断面スライドは透過光(TL)設定で撮像した(図4)。サンプルは384ウェルフォーマットで撮像し、脛骨サンプルの近位部のみを示す。SoftMax ProのStainFree Analysisを使用して、同定された骨組織の面積(μm2)を算出した。画像解析タブの下で、TL波長を使用する "Field Analysis "設定を選択した。事前に作成した "セル "設定を使用して、紫色のオーバーレイで示すように、脛骨サンプルが占める領域を特定した。面積が計算され、対応するプレーティング断面とSoftMax® Proソフトウェアのデータテーブルに表示されます。この例では、図4の画像の下に骨の総面積を表示しています。
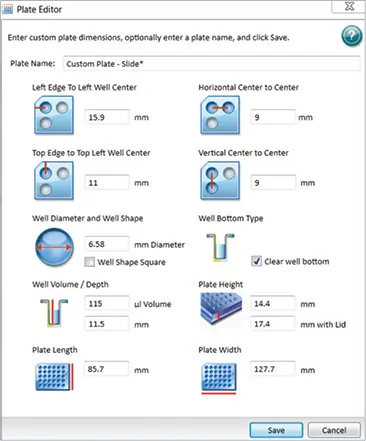
図2. スライドアダプター用のカスタムプレート寸法。SoftMax® Proソフトウェアで、上記の寸法を使用してスライドアダプターに対応するカスタムプレート設定を作成した。
結果
蛍光染色したBPAE細胞を封じ込めたスライドを、図1および図2に示したスライドアダプターおよび設定を用いてイメージングした。これらのスライドから高品質の蛍光イメージを取得することができ、SoftMax Proは緑色蛍光に基づいて細胞のコンフルエンスを算出することができた(図3)。
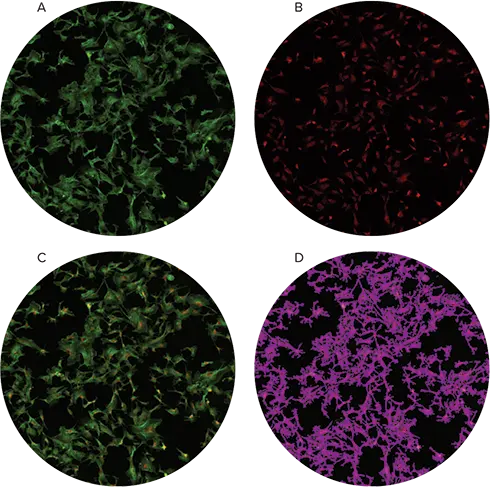
図3. FluoCellsで作製したスライドの画像化と解析。Alexa Fluor® 488 PhalloidinとMitoTracker® Red CMXRosで染色したBPAE1細胞を封じ込めたスライドを、MiniMaxサイトメーターを用いて画像化した。緑色蛍光チャンネル画像(A)と赤色蛍光チャンネル画像(B)を重ね合わせ(C)、緑色蛍光チャンネルのField Analysisによって決定されたコンフルエンスをパネルDで確認した。
さらに、MiniMaxサイトメーターは、同じスライドアダプターとSoftMax Proソフトウェアで作成したカスタムプレート定義を使用して、組織切片を画像化することができました。以下の例では、脛骨骨サンプルを撮像し、StainFree解析(図4)を用いておおよそのサンプル面積を算出しています。骨サンプルを封じ込めた各ウェルの算出面積を合計することで、総骨面積を算出することができ、これを用いて骨の成長を概算することができます。
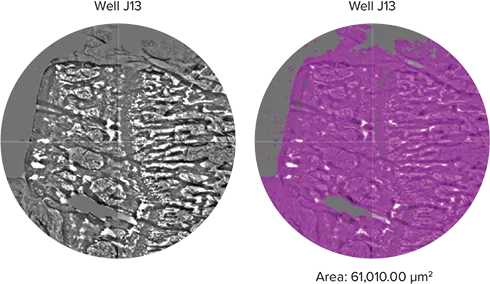
図4. 脛骨の断面。ヒトの脛骨の断面をスライドに置き、TL設定で撮影。脛骨断面の一部を左に、対物レンズを右に示す。
結論
プレートエディターとスライドアダプターを追加することで、SpectraMax MiniMax® 300イメージングサイトメーターを使用して、顕微鏡スライドのような異種のサンプルから高品質の画像を取得することができます。SpectraMax i3xマイクロプレートリーダーとMiniMaxサイトメーターを併用することで、これらのサンプルをさまざまな方法で解析でき、研究者の研究能力が向上します。
SpectraMax MiniMax 300イメージングサイトメーターについてさらに詳しく >>
PDF版(英語)