Application Note 3Dバイオプリンティング
卵巣がんモデルの画像特性評価
- ハイコンテントスクリーニングと一過性トランスフェクションの組み合わせは、3Dバイオプリントアッセイの特性評価と検証に役立つ
- 一過性の遺伝子発現は、3Dバイオプリントモデルの汎用性を高める強力なツールである。
- 多波長解析ツールは、3Dバイオプリンティングモデルの能力を十分に活用し、モデル内の異なるタイプの細胞集団の相互作用を研究するために不可欠である。
PDF版(英語)
はじめに
Z. Baka, C. Godier, H. Alem | Institut Jean Lamour
R. Storm, M. Cattaneo, S. Tendil | Molecular Devices
N. Chaboche, A. Nyamay’Antu | Polyplus Transfection
V. Gribova | INSERM
3Dバイオプリンティングとは、生物学的に機能的な3次元構造体や人工組織モデルを構築するための、セルと生物学的適合性材料の付加的成膜と定義される。この技術は組織工学の分野に革命をもたらし、優れた再現性を確保しながら、複雑であらかじめ定義されたデザインの構造体を作成することを可能にした。3Dバイオプリンティングに基づくアプローチは、軟骨2、骨3、皮膚再生など、さまざまな組織のエンジニアリングに応用されている。実際、2D細胞培養に基づくモデルは、その予測性の欠如からますます疑問視されるようになっており、3Dバイオプリンティングは、腫瘍微小環境(TME)をよりよくモデル化/表現するために、異なる種類の細胞や細胞外マトリックス由来の分子を沈着させることによって、この問題を回避する代替的なアプローチとして浮上している。3Dバイオプリンティングに基づくがんモデルは、肺がん5、乳がん6、神経膠芽腫7など数多く報告されている。これらのモデルは、スフェロイドやオルガノイドなどの他の戦略と比較して、デザインの柔軟性や再現性において優位性を示している。
3Dバイオプリンティングは、公衆衛生上の大きな問題である卵巣がんのモデルとして、現在も研究が進められている。この種の腫瘍では、がん関連線維芽細胞(CAF)ががん細胞と密接に相互作用し、がんの浸潤や薬剤耐性に主要な役割を果たすことが示されている。
このアプリケーションノートでは、3Dバイオプリンティングを用いて、がん細胞(SKOV3細胞)とCAFs線維芽細胞(MeWo細胞)からなる卵巣がんモデルを作製した。SKOV3細胞はjetOPTIMUS®(Polyplus®)を用いてGFPプラスミドでトランスフェクトし、MeWo細胞はCellTracker™ Orange CMRA Dye(ThermoFisher)で染色した。この2種類の細胞をゼラチン-アルギネートベースのハイドロゲルに含ませ、円柱状の腫瘍様構造体を作製するために使用する「バイオインク」を得た。これらの腫瘍モデル内の細胞分布のホモジニアス性と再現性を、ImageXpress® Picoイメージングシステムを用いて評価した。
結果と考察
図1に示すように、バイオプリント構造のイメージングから、GFPを発現するSKOV3細胞と蛍光染色したMeWo細胞がゼラチン-アルジネートベースのマトリックス内に均一性に分布していることが示された(図1AおよびB)。バイオインク内でのホモジニアスな細胞分布は、3Dバイオプリンティングを実施する際に考慮すべき重要なパラメータであるため、このことは重要である12。さらに、本来のTMEは、互いに密接に相互作用する複数の細胞種から構成されることが知られている13。したがって、がん細胞と間質細胞との相互作用を促進するためにin vitro腫瘍モデルを構築する際に、この細胞近接性を再現することが極めて重要である。
TMEの不均一性をよりよく模倣するために、腫瘍モデルでは多くの細胞種を組み合わせる必要がありますが、再現性を確保するためには、各細胞種の総数とそれぞれの割合を制御する必要があります。ImageXpress Picoは、迅速かつ容易に複数の顕微鏡画像を取り込むことができるため、このようなコントロールを行うのに特に適したシステムである。そのソフトウェアであるセルレポーターエクスプレス(Cell ReporterXpress)は、Zスタック最大投影法を用いて、厚いサンプルでも複数の細胞集団の定量を可能にします。このアプリケーションノートでは、このシステムを用いてバイオプリント腫瘍モデルを解析し、細胞数と割合の点で良好な再現性を示しました。検討した6つのバイオプリント構造体のうち、SKOV3細胞(細胞数FITC)の平均数は837±200(標準偏差≦25%)であった。MeWo細胞(セル数TRITC)の平均数は3264.50±462(標準偏差≦15%)であった。
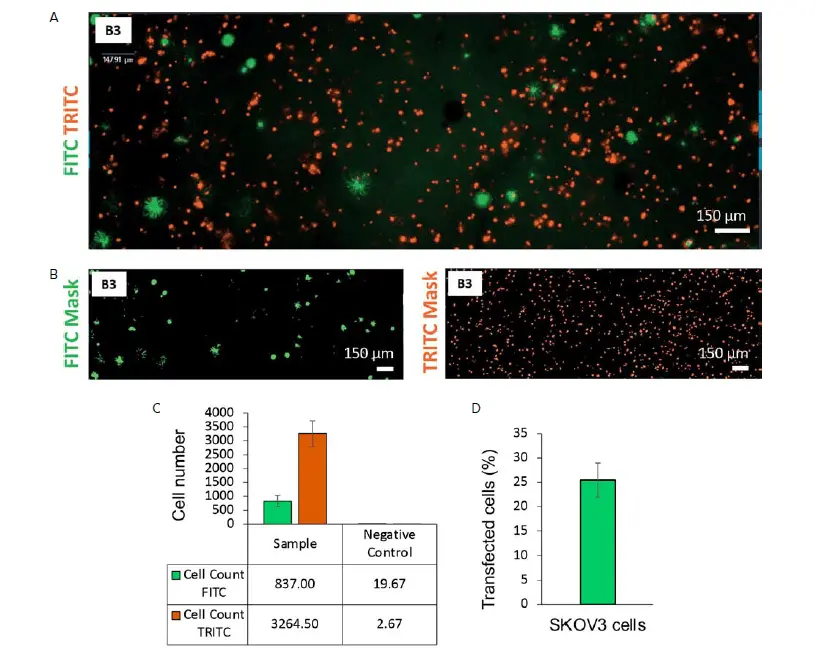
図1. GFPプラスミドでトランスフェクトしたSKOV3細胞とCellTracker Orange CMRA Dyeで染色したMeWO細胞を含む3Dバイオプリント構造の解析。A) ImageXpress Picoシステムで取得したウェルB3の3Dバイオプリント構造のFITCおよびTRITC画像(4倍、Z-スタッキング)。B) CellReporterXpressソフトウェアを用いて作成したFITCおよびTRITC細胞数の解析マスク。C) サンプル(5ウェル、染色、トランスフェクション)とネガティブコントロール(3ウェル、非染色、トランスフェクション)のFITCとTRITCチャンネルの平均細胞数。D) GFPプラスミドとjetOPTIMUS-Polyplus-transfection-transfection kitを用いたトランスフェクション効率の推定(FITC陽性細胞/TRITC陽性細胞の割合)。
このアプリケーションノートでは、バイオプリント構造体において特定の遺伝子を迅速に可視化する方法を示します。バイオプリンティングによって3D構築物に組み込む前にトランスフェクションを行うことで、バイオプリンティング構造物の特定の細胞タイプにおいて一過性の遺伝子発現を達成することができる。これは、トランスフェクションが困難であることが知られているスフェロイドやオルガノイドのような他の3次元細胞培養法と比べて、3Dバイオプリンティングの大きな利点である。この予備実験では、トランスフェクション効率は25%(STD 3.48%)と推定された(図1D)。これは、例えば、ImageXpress Picoを使用して、複数の濃度のトランスフェクションミックス、DNAプラスミド量、タイミングをスクリーニングすることで改善できる可能性がある。このアプローチはまた、同じバイオプリント構造内で、間質細胞とがん細胞の両方で遺伝子サイレンシングや遺伝子編集を行う可能性を提供する。
全体として、われわれはトランスフェクション、蛍光イメージング、細胞計数を組み合わせて、がん細胞とCAFを含む3Dバイオプリント卵巣腫瘍モデルの特徴づけと検証を行った。細胞間相互作用に有利なマトリックス中で、2種類の細胞の再現性のある均質な分布とその近接性を示すことができた。このアプローチは、3Dモデルで観察される色素の浸透の制限なしに、制御された再現性のある細胞分布で、より複雑で完全な腫瘍モデルを作成する可能性を提供する。したがって、3Dバイオプリント腫瘍モデルは、マイクロ流体システムに組み込む前に、その再現性を迅速に検証することができる。その後、生理的フロー下で長期培養することで、抗がん剤開発のための、より生体内に近い前臨床モデルを作成することができる。
材料と方法
ハイドロゲルの調製
ハイドロゲル調製のために、必要な量のゼラチンおよびアルギン酸ナトリウム粉末を秤量し、紫外線で1時間除染した後、10%ウシ胎児血清を添加した最小必須培地(MEM)と混合したダルベッコ変法イーグル培地に溶解した。得られた溶液を37℃で一晩、磁気攪拌下に保ち、完全にホモジナイズした。
細胞のトランスフェクションと染色
SKOV3細胞はjetOPTIMUS(Polyplus社製)を用い、製造元の説明書に従ってGFPプラスミドでトランスフェクションした10。簡単に言うと、適量のDNAをjetOPTIMUSバッファーに希釈し、適量のjetOPTIMUSトランスフェクション試薬を加えた。トランスフェクション溶液を室温で10分間保持した後、T75フラスコで60~80%コンフルエントに培養したSKOV3細胞に添加した。
MeWO細胞をCellTracker Orange CMRA Dye(ThermoFisher社製)で染色した。細胞を37℃で30分間曝露した。その後、試薬溶液を除去し、新鮮な完全培地と交換した。
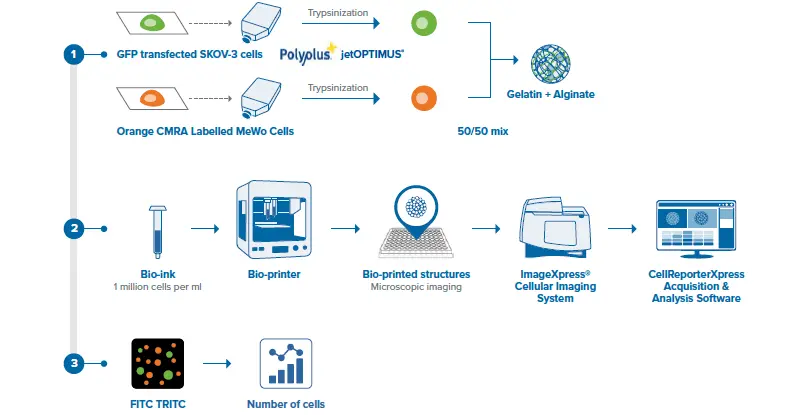
図2. 卵巣がんモデル構造のバイオプリントと画像化に用いた方法の概略説明。
細胞のカプセル化
バイオインクの調製では、トリプシン処理した細胞を新鮮な培養液に懸濁し、先に調製したポリマー溶液に注意深く加えた。得られた懸濁液をゆっくりと撹拌し、バイオインク内の細胞分布を均質化した。
バイオプリンティングプロセス
調製したバイオインクを3mLのカートリッジに充填し、バイオプリンティングヘッドに装填した。バイオプリンティングは24ウェルプレートで行われた。各3mLカートリッジは約48個の構造をバイオプリントした。バイオプリント後、構造体は100mM CaCl2溶液を用いて架橋され、新鮮な培養液で補充され、実験に必要なまで37℃、5%CO2で培養された。
細胞イメージング
バイオプリントした構造体を96ウェルプレート(Greiner 655892、ガラス底、黒壁)に移した。
細胞はImageXpress Pico Automated Cell Imaging Systemで4X対物レンズを使用して画像化した。
画像は、透過光、FITCおよびTRITCチャンネルを用い、それぞれ5、150および250msの露光時間で、ウェルあたり1部位ずつ取得した。4倍の対物レンズでウェル全体の約40%の領域を表示。ハードウェアベースのオートフォーカスと画像ベースのオートフォーカスを組み合わせて、50µm間隔で7つのZ平面を取得した(Zスタッキング)。最大2D投影画像はオンザフライで生成された。
FITC または TRITC チャンネルにシグナルを持つ細胞を定量するために、Cell ReporterXpress™ ソフトウェアの設定済み細胞数解析モジュールを使用した。解析に使用したセグメンテーション・パラメーターは、強度、最小幅、最大幅であった。値はFITCチャンネルでは23, 7, 100、TRITCチャンネルでは23, 7, 38であった。
謝辞
Pascal Kessler - フランス、ストラスブールのCRBS PIC-STRAの顕微鏡プラットフォーム。
参考文献
- Tan B, Gan S, Wang X, Liu W, Li X. 組織エンジニアリングにおける3Dバイオプリンティングの応用:利点、欠点、改善点、将来の展望。J Mater Chem B. 2021;9(27):5385-5413.
- Nguyen LH, Kudva AK, Saxena NS, Roy K. 多層ハイドロゲルを用いた、単一の幹細胞集団から空間的に変化するマトリックス組成と力学的特性を有する関節軟骨のエンジニアリング。Biomaterials. 2011;32(29):6946–6952. doi:10.1016/j. biomaterials.2011.06.014
- Kang HW, Lee SJ, Ko IK, Kengla C, Yoo JJ, Atala A. A 3D bioprinting system to produce human scale tissue constructs with structural integrity. Nat Biotechnol. 2016;34(3):312–319. doi:10.1038/nbt.3413
- Cubo N, Garcia M, Cañizo JF del, Velasco D, Jorcano JL. 機能的ヒト皮膚の3Dバイオプリンティング:作製とin vivo解析。Biofabrication. 2016;9(1):015006. doi:10.1088/1758-5090/9/1/015006
- Wang X, Zhang X, Dai X, et al. 3Dバイオプリンティングに基づく腫瘍様肺がんモデル。3 Biotech. 2018;8(12). doi:10.1007/s13205-018-1519-1
- Swaminathan S、Hamid Q、Sun W、Clyne AM. ヒトがんモデル用3D乳房上皮スフェロイドのバイオプリンティング。Biofabrication. 2019;11(2):025003. doi:10.1088/1758-5090/aafc49
- Wang X, Li X, Ding J, et al. 3D bioprinted glioma microenvironment for glioma vascularization. J Biomed Mater Res B. オンライン公開2020年。
- がん関連線維芽細胞由来のインターロイキン-8は、Notch3を介したシグナル伝達を通じて卵巣がん細胞の幹細胞性と悪性化を促進する。Front Cell Dev Biol.
- がん関連線維芽細胞は、STAT3シグナルを促進することにより、卵巣がん細胞のシスプラチン誘導アポトーシスを減衰させる。Biochem Biophysl ResCommun. 2016;470(4): 947–954. doi:10.1016/j.bbrc.2016.01.131
- jetOPTIMUS® DNAトランスフェクション試薬. 2022年6月9日アクセス。(アカウント作成が必要) https://myaccount.polyplus-transfection. com/my-account-home/protocol-download/.
- CellTrackerTM Orange CMRA Dye。2022 年 6 月 8 日アクセス。https://www.thermofisher.com/order/catalog/product/C34551
- Bhattacharyya A, Janarthanan G, Tran HN, Ham HJ, Yoon J, Noh I. 新規ツインスクリュー押し出しシステムを用いた、組織再生のための多成分マイクロ/ナノ複合ハイドロゲルの3Dバイオプリンティングにおけるバイオインク均一性制御。doi:10.1016/j.cej.2021.128971.
- アンダーソンNM、サイモンMC。腫瘍微小環境。2020;30(16):R921-R925.doi:10.1016/j.cub.2020.06.081.Curr Biol.
PDF版(英語)