Application Note 画像デコンボリューションによる核転座アッセイ結果の改善
- 2Dオンザフライ画像デコンボリューションにより画像の解像度を向上。
- あらかじめ設定された転座解析により、核転座を簡単に定量化できます。
- デコンボリューション画像により、データの統計的有意性を高める。
PDF版(英語)
はじめに
マシュー・ハマー|アプリケーションサイエンティスト|モレキュラー・デバイス
ワイドフィールド顕微鏡は、細胞シグナリングに関わる細胞や分子のプロセスを調べるために利用されてきた強力なツールである。ピンぼけ光による蛍光ボケは、すべてのワイドフィールド顕微鏡の生得的な結果であるが、イメージデコンボリューションアルゴリズムは、このピンぼけ光のアーチファクトを逆転させることができる。その結果、定量的な情報を維持しながら、画像や細部がより鮮明になる。
NF-κBシグナル伝達経路は、セル・シグナリングと遺伝子制御に関する研究のパラダイムとなっている。サイトカイン、細菌抗原、ウイルス粒子、あるいは細胞毒性刺激によって活性化された後、NF-κBシグナル伝達経路は細胞質から核に移動し、そこで様々な遺伝子の転写を制御する。
ここで我々は、HeLa細胞におけるNF-κBの核移行に対するTNF-α処理時間の影響を調べた。細胞はImageXpress® Pico自動細胞イメージングシステムとCellReporterXpress®画像取得・解析ソフトウェアを用いてイメージングした。画像は、Digital Confocal 2D on-the-fly画像デコンボリューションおよび標準ワイドフィールドモードで撮影し、デコンボリューション画像による解析結果の統計的有意性の向上を実証した。
材料
- HeLa細胞
- RPMI培地(Corning、cat. #10-104-CV)+10%FBS+1%pen/strep。
- 96ウェル黒壁透明底96ウェルマイクロプレート (Corning, cat. #3904)
- ブロックおよび透過化バッファー (PBS + 5%ロバ血清 + 0.2% TritonX-100)
- 抗体希釈バッファー (PBS + 1%ロバ血清 + 0.02% TritonX-100)
- TNF-α(ミリポアSigma、cat. #H8916)
- Hoechst 33342 (Invitrogen)
- NF-κB(RelA)一次抗体(ProteinTech, cat.)
- AlexaFluor 488 ロバ抗ウサギ二次抗体 (ThermoFisher, cat. #R37118)
- AlexaFluor 594 ファロイジン(ThermoFisher, cat.)
- ImageXpress Pico自動細胞イメージングシステム
- CellReporterXpress 画像取得・解析ソフトウェア
方法
HeLa細胞を黒壁透明底96ウェルプレートに5,000細胞/ウェル、RPMI培地でプレーティングした。このプレートを37℃、5% CO2で24時間インキュベートし、細胞の接着と増殖をさせた。次にセルをTNF-α(1500ng/ml)で0、15、30、45、60分間処理し、処理は4重反復で行った。
処理後、プレートをPBSで2回洗浄し、4%ホルムアルデヒドで10分間固定した。その後、セルをPBSで3回洗浄し、60分間ブロックして透過処理した後、RelA(NF-κBのサブユニット)一次抗体(1:200)とAlexaFluor 594ファロイジン(1:50)で4℃で一晩免疫標識した。その後、すべてのウェルから染色液を除去し、二次抗体(AlexaFluor 488 ロバ抗ウサギ抗体)染色液を1:500の濃度ですべてのウェルに加え、室温で2時間反応させた。二次抗体染色ステップの最後の30分間、Hoechst 33342を1μL/mLで各ウェルに添加した。その後、細胞はイメージング前にPBSで3回洗浄した。
画像の解像度を高めるためのデジタルコンフォーカルによるイメージング
デジタルコンフォーカル機能を有効にして1回、標準ワイドフィールドモードで1回の計2回、ImageXpress Picoシステムでイメージングを行った(図1)。対物レンズは40Xを使用し、1ウェルあたり25部位を撮像した。スティッチング取得プロトコルを実行し、画像を取得しながらスティッチングした。どちらの撮影モードでも同じ露光時間を使用し、各チャンネルの露光時間はDAPIが10ms、FITCとTexas Redが300msであった。
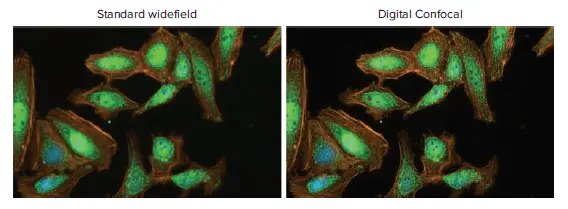
図1. TNF-αで30分間処理したHeLa細胞におけるNF-κB核転 移の代表的な標準ワイドフィールドおよびデジタルコンフォーカルイメージング。画像は40倍の対物レンズとDAPI、FITC、Texas Redチャンネルで撮影した。デジタルコンフォーカル2Dオンザフライデコンボリューションにより、焦点外光を除去し、画像の解像度を向上させた。HeLaセルはHoechst 33342(核、青)、AlexaFluor 594ファロイジン(アクチン、オレンジ)で染色し、RelA(RelA、緑)を免疫標識した。
核転座解析
細胞質から核へのNF-κBの移動を測定するために、CellReporterXpressソフトウェアのあらかじめ設定された転位解析モジュールを用いた(図2および3)。Hoechst 33342で染色した核をコンパートメントと定義し、NF-κBタンパク質をプローブとした。転座陽性核の定義には、ピアソンの相関係数値0.6を用いた。相関が0.6以上のセルを転座陽性とした。Pearsonの相関係数は、指定された区画(この場合は核)における2つの染色の画素強度の尺度である。1の値は2つの染色が完全に重なっていることを表し、0の値は染色が重なっていないことを表す。
NF-κB核移行に対する処理時間の影響
TNF-αの処理時間は、NF-κB転座陽性細胞の割合に明らかな影響を与えた。30分と45分の処理群では転座の割合が最も高く、60分の処理群では最も低かった(図2と4)。このことは、TNF-αに45分間さらされた後、NF-κBが核から細胞質へと再配置され始めたことを示している。これらの結果は、デジタル共焦点画像と標準ワイドフィールド画像の両方で捉えられた。
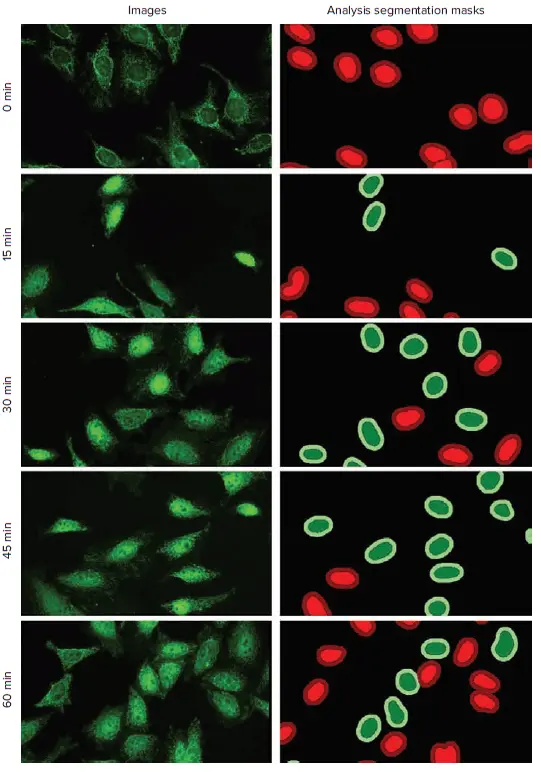
図2. NF-κB核移行に対するTNF-α処理時間の時間依存性効果。HeLa細胞を1500ng/mlのTNF-αで0、15、30、45、60分間処理した。画像および解析のセグメンテーションマスクは、デジタル共焦点モードで撮影したデータセットからのものである。FITCチャンネルの画像(RelA)をここに示す。細胞質から核へのNF-κB核内転位は、CellReporterXpressソフトウェアの転位解析モジュールを用いて解析した:内側陽性領域(濃い緑)、外側陽性領域(薄い緑)、内側陰性領域(薄い赤)、外側陰性領域(濃い赤)。
デジタルコンフォーカル画像と標準ワイドフィールド画像のトランスロケーション解析
標準ワイドフィールドとデジタルコンフォーカルデータセットの間には、解析結果に顕著な違いがあった。最も顕著なのは、標準ワイドフィールドデータの標準偏差値が、デジタルコンフォーカルデータの標準偏差値よりも高かったことである(図4)。処理時間45分と60分のデータでは、標準ワイドフィールド画像の解析で転座陽性細胞の割合が高産生な結果となった。この現象は、核の上下にある細胞質からのピンぼけ光が、偽陽性の同定につながったことが一因である(図3A)。Digital Confocal 2Dオンザフライ・デコンボリューション・アルゴリズムは、焦点外光を除去し、1つのz平面からの光をより正確に表現するのに役立つ。これにより、NF-κB分子の位置がより正確に決定され、デコンボリューション画像からの解析結果における統計的有意性が向上した。さらに、デジタル共焦点画像のコントラストとシグナル対ノイズ比が向上したことで、標準的なワイドフィールド画像と比較して、転座イベントを正確に特定することができた(図3B)。
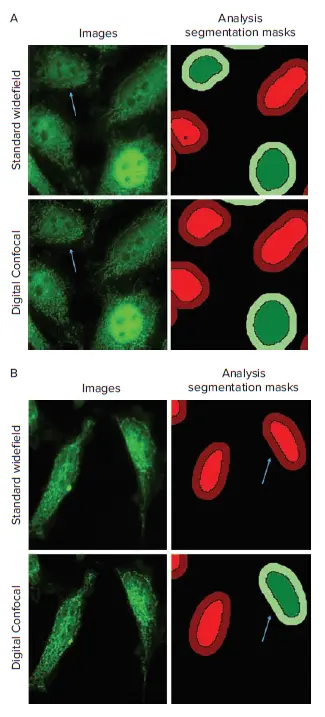
図3. 図3. 標準ワイドフィールド画像とデジタルコンフォーカル画像のトランスロケーション解析。デジタルコンフォーカル2Dオン-the-fly画像デコンボリューションは、ワイドフィールドイメージングのピンぼけ光アーチファクトを逆転させるのに役立ち、画像解析による統計的妥当性と精度の向上につながった。A. 矢印は、標準ワイドフィールド画像では転座陽性、デジタルコンフォーカル画像では陰性と判定されたセルを示す。B. 矢印は、標準ワイドフィールド画像では転座陰性、デジタルコンフォーカル画像では陽性と同定されたセルを示す。画像は30分間のTNF-α処理群のもの。
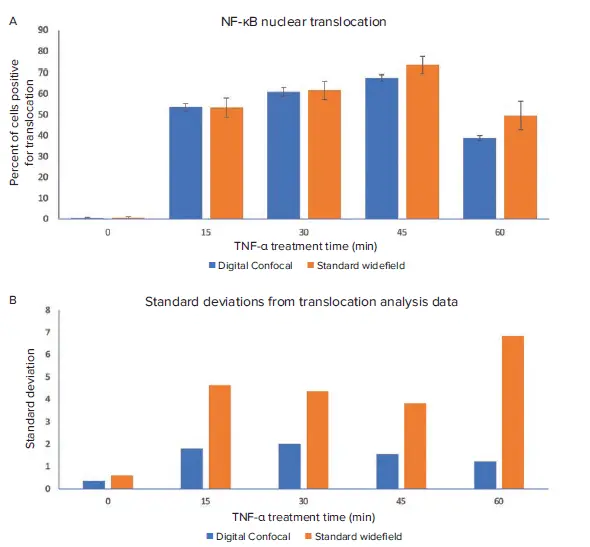
図4. NF-κB核移行に対するTNF-α処理時間の影響。標準ワイドフィールドおよびデジタル共焦点画像を、CellReporterXpressの最適化された転座モジュールで解析した。A. 両画像データセットの解析から得られた転座陽性細胞のパーセンテージをここで比較する。B. 各データポイントの標準偏差を上に示す。デジタルコンフォーカルで取得した画像を解析したところ、反復間の標準偏差が有意に低いことからわかるように、より優れた再現性が得られた。
結論
細胞内の異なるコンパートメント内の細胞内構造や分子を正確に同定する必要があるアッセイでは、その場で画像デコンボリューションを行うことで、ピンぼけ光による潜在的に高いバックグラウンドに対して特異性蛍光シグナルの同定を向上させることができる。我々は、ImageXpress PicoシステムとCellReporterXpressソフトウェアを利用して、TNF-αで処理したHeLa細胞の細胞質から核へのNF-κBのトランスロケーションを評価した。標準的なワイドフィールドとデジタルコンフォーカル2Dオンザフライ画像デコンボリューションを使用して生成された画像の比較は、NF-κB核移行イベントの測定におけるデジタルコンフォーカル機能の有用性を強調した。画像の解像度が向上し、定量的な情報が維持されたことで、デジタルコンフォーカル画像の解析結果は統計的に有意なものとなった。
参考文献
- Wan, F., & Lenardo, M. J. (2010). NF-κBの核内シグナル伝達:現在の知見、新たな洞察、そして将来の展望。セルリサーチ, 20(1), 24-33.
- Oeckinghaus, A., & Ghosh, S. (2009). 転写因子のNF-κBファミリーとその制御。コールド・スプリング・ハーバー生物製剤の展望, 1(4), a000034.
PDF版(英語)