Application Note SpectraMax MiniMaxサイトメーターの
透過光を用いた細胞計数法の改善
- イメージングが困難な細胞タイプの細胞計数の精度が向上。
- 蛍光細胞染色に代わる経済的な方法
- データ収集から解析までのシンプルなワークフロー
PDF版(英語)
はじめに
Caroline Cardonnel, PhD | Field Applications Scientist | Molecular Devices
Andrew Bashford, PhD | Field Applications Scientist | Molecular Devices
Simon Lydford | Field Applications Scientist Manager | Molecular Devices
ヘマトキシリンは、ログウッド(Haematoxylin campechianum)の心材から抽出される天然産物で、組織学の染色プロトコールに最も一般的に使用される染料である。ヘマトキシリンは、塩基性染料のように反応し、紫青色を呈し、セル核やリボソーム、粗面小胞体などのRNAを封じ込めた小器官を含む酸性または好塩基性構造を染色する1 。
SpectraMax® i3x マルチモードマイクロプレートリーダーとSpectraMax® MiniMax™ 300イメージングサイトメーターには、透過光(TL)、緑色蛍光(Ex/Em:460/541)、赤色(625/713)蛍光チャンネルが搭載されています。SoftMax® Proソフトウェアを搭載したMiniMaxサイトメータは、さまざまな細胞のイメージングと解析に使用できます。ここでは、透過光画像のコントラストを高めるためにヘマトキシリンを使用し、比較的平坦な形態や細胞間隙が区別できない細胞株の細胞計数を改善できることを示す。
材料
- Mayer's Hematoxylin Solution(シグマ社製、商品番号MHS1)
- CellStar 96 ウェル細胞培養プレート、μClear 底、黒色壁(Greiner 社製 cat.)
- SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices 社 cat.)
- SpectraMax MiniMax® 300イメージングサイトメーター(Molecular Devices社 cat.)
方法
セル培養
MDCK(マディン・ダービー・イヌ腎臓)細胞(親細胞株、MDCK I、MDCK II)は、James Cooper博士によりEuropean Collection of Authenticated Cell Cultures(ECACC)から提供された。イーグル最小必須培地(EMEM)+2mMグルタミン+1%非必須アミノ酸(NEAA)+10%ウシ胎児血清(FBS)で継代培養し、37℃、5%CO2雰囲気の加湿インキュベーターで維持した。細胞を96ウェルプレートに1ウェル当たり4×104個播種し、実験前に37℃で18~24時間培養した。
ヘマトキシリン染色
細胞培地を除去し、Mayer's Hematoxylin Solutionをウェル表面を覆うようにウェルに直接加え(96ウェルプレートでは1ウェルあたり50μL)、3~5分間放置した。その後、Mayer's Hematoxylin Solutionをウェルからピペッ トで抜き取り、細胞を増殖培地で2~3回穏やかに洗浄し、青色化させた。このステップにより、核内のヘマトキシリンの最初の可溶性の赤色が不溶性の青色に変換される。
データ解析
透過光チャンネルで生成された画像は、SoftMax® Proソフトウェアで、定義済みのデータ解析設定「セルB」または新しいカスタムデータ解析(「新規設定作成」)のいずれかを使用して「離散対物レンズ解析」(セルカウント)を行い、個々の細胞を同定およびカウントした。画像あたりの対物レンズ数の算出には、SoftMax® Proソフトウェアを使用した。撮影と解析の設定を表1に示す。
| 透過光 | |
|---|---|
| フォーカス調整 | 10 or 70 µm |
| 露出 | 7 ms |
| データ解析設定 離散対物レンズ分析: CellsBまたはカスタム解析 | 離散対物レンズ分析: CellsBまたはカスタム解析 |
表1. 非染色およびヘマトキシリン染色MDCK細胞(全系統)の取得および解析設定。数値はここで使用したPlateとこれらの細胞タイプについて示している。他のPlateや細胞タイプでは異なる設定が必要な場合がある。
結果
MDCK細胞株は上皮形態を有し、タンパク質輸送、偏光、膜透過性など、様々なメカニズムを研究するモデルとして一般的に用いられている。MDCK細胞はまた、最近では細胞のウイルス感染やワクチン製造の研究にも用いられている2。MDCK細胞の形態は株によって異なる3。親株MDCK細胞の大きさは様々で、形態も不均一性である(図1A)。MDCK I細胞はわずかに多形で、細胞の境界は非常に細かく、ほとんど区別がつかない(図1B)。MDCK II細胞は多角形で、細胞間の境界が明瞭に見え、細胞単層にモザイク状の外観を与える(図1C)。
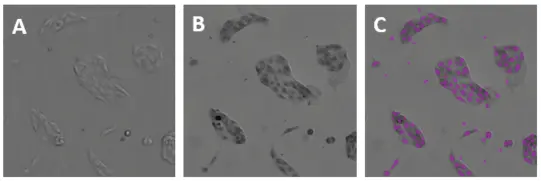
図1. 透過光による非染色MDCK細胞のイメージング(焦点は10μm)。A: MDCK親細胞株は多形である。B: MDCK I細胞は細胞膜がほとんど区別できない。セル:MDCK II細胞は多角形であり、細胞境界が明瞭に定義され、モザイク状に見える。
MDCK II細胞は、SoftMax® Proソフトウェアの定義済みデータ解析設定 "セルズB "で解析することができました。しかし、他のMDCK細胞株では、形や大きさの違い(MDCK)や細胞膜が見えないこと(MDCK I)をソフトウェアが補正できず、細胞を適切にセグメンテーションできなかった。
しかし、ヘマトキシリン染色を行うと、セル内のコントラストが向上し、細胞は核が濃くなり、はっきりと識別できるようになった。ヘマトキシリンで染色したMDCK細胞をMiniMaxサイトメーターの透過光チャンネルでイメージングした結果、核のコントラストが強調され、ソフトウェアでより簡単に識別できるようになった(図2)。この手法は、親株(図2)、MDCK I(図3)、MDCK II(図4)の3系統のMDCK細胞すべてで成功した。
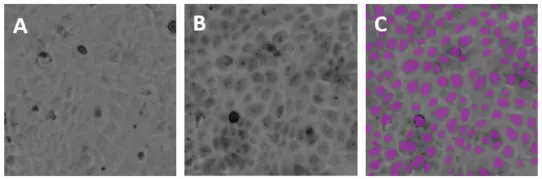
図2. MiniMaxサイトメーターのTLチャンネルから得られた親MDCK細胞のイメージング。A:染色していない親MDCK細胞;B:ヘマトキシリン染色した親MDCK細胞;C:Bと同じフィールドで、ソフトウェアにより同定された細胞を紫色のマスク(オーバーレイ)として示す。
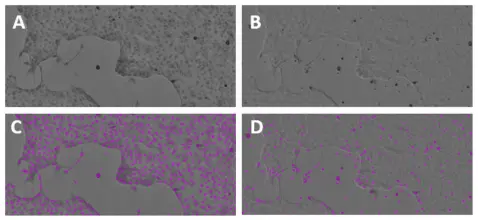
図3. 染色されたMDCK I細胞と染色されていないMDCK I細胞の識別。MiniMaxサイトメーターのTLチャンネルでイメージングしたヘマトキシリン染色MDCK I細胞(A、C)は、非染色細胞(B、D)よりも正確に同定され、ソフトウェアでカウントされた。
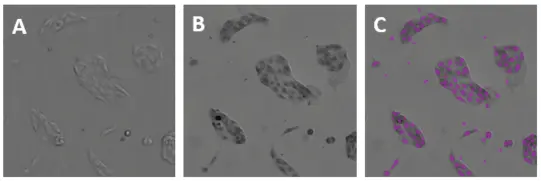
図4. 未染色および染色MDCK IIセル。MiniMaxサイトメーターのTLチャンネルでイメージングしたヘマトキシリン染色MDCK II細胞は、ソフトウェアにより正確に同定・計数された。
すべてのヘマトキシリン染色MDCK細胞をカウントするために、新しいデータ解析設定を開発した(表2)。この新しい方法のロバスト性を確認するため、この解析がうまく機能するMDCK II細胞について、得られた細胞数を透過光チャンネルの事前定義設定'セルB'と比較した。細胞数の差はわずか約3%であり(表2)、ヘマトキシリン染色を新しいデータ解析と組み合わせることで、イメージングした細胞をより正確にカウントすることができ、細胞間の境界が不明瞭な平坦な細胞をカウントするための解決策となりうることが確認された。
| セルカウント | MDCK (親) | MDCK I | MDCK II |
|---|---|---|---|
| TL 未染色細胞を用いた定義済み分析「セルB |
不成功 | 不成功 | 4242 |
| TL ヘマトキシリン染色細胞による新しい分析 |
4414 | 3675 | 4373 |
| 細胞数の差(%) | N/A | N/A | 3 |
表2. MDCK細胞のデータ解析(画像ごとの対物レンズ数を示す)。
ヘマトキシリン染色は免疫蛍光染色と相容れないことに注意されたい。なぜなら、ヘマトキシリン染色は未知のメカニズムによりすべての特異性染色を消失させるからである4 。免疫蛍光のデータが必要な場合は、ヘマトキシリン染色の前に蛍光アッセイを行うべきである。
結論
SoftMax Proソフトウェアが提供するデータインテグリティを備えたMiniMaxサイトメーターを使用して、透過光チャンネルにおけるMDCK細胞株のイメージングと解析に成功した。ヘマトキシリン染色により透過光での画像コントラストが大幅に向上したため、細胞間の区別がつかないセルも正確にカウントできた。この技術は、平板細胞や細胞クラスターなど、カウントが困難な細胞株をカウントするソリューションを提供します。蛍光染色の何分の一かの価格で、ヘマトキシリンは、単純な細胞カウントが必要な場合に、細胞の蛍光イメージングの経済的な代替となる。
SpectraMax i3xリーダー(MiniMaxサイトメーター付き)は、イメージングの利点とマルチモードマイクロプレートリーダーアッセイの汎用性をシームレスに組み合わせます。SoftMax Proソフトウェアは、データ収集から解析までのシンプルなワークフローを提供し、ユーザーによるアップグレードが可能なカートリッジオプションは、このシステムをあらゆるラボに論理的に追加します。
参考文献
- Titford M. ヘマトキシリンの長い歴史。Biotech Histochem. 2005 Mar-Apr;80(2):73-8.
- Lugovtsev VY, Melnyk D, Weir JP. MDCK細胞株の不均一性とインフルエンザウイルス研究への応用。PLOS One. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0075014
- Dukes JD, Paul Whitley P, Andrew D Chalmers AD. MDCK variety pack: choosing the right strain. BMC Cell Biology. 2011 12:43.
- 組織および細胞切片のヘマトキシリン・エオジン染色。CSH Protoc. 2008 May 1;2008:pdb.prot4986.
PDF版(英語)