Application Note 近赤外ラベルと高度な画像・データ分析で
セルペインティングのロバスト性を向上させる
- 近赤外ラベルを用いたセルペインティングアッセイの感度向上
- IN CartaのディープラーニングSINAPモジュールを使用したロバスト性画像セグメンテーションの取得
- StratoMineRでクラウドベースのデータ分析物を簡単に使用。
PDF版(英語)
はじめに
広く使われているセルペインティングアッセイなどの画像ベース表現型プロファイリングアプローチは、ハイコンテントイメージングとマルチパラメーターの出力を用いて、細胞内の生物学的、遺伝学的、化学的摂動を研究する。この方法は、創薬プログラムからゲノムのスクリーニング研究まで、幅広いアプリケーションで使用されている。
標準的なセルペインティングアッセイでは、さまざまな細胞小器官や構造(核、細胞質、ミトコンドリア、ゴルジ体、小胞体、細胞骨格、cytoRNA、核小体)が5つのイメージングチャンネルに取り込まれる。このように細胞を広範囲に染色することで、複数の形態学的変化を単一細胞の分解能でモニターし、定量化することができる。発表されたセルペインティングアッセイの限界としては、適切な色素の入手が困難であることと、イメージングシステムが適切なスペクトル分離を行うことができないことが挙げられる。特異性として、ゴルジ体とアクチンは同じイメージングチャンネルを用いてイメージングされるため、画像解析中に2つの構造を分離する際に困難が生じる。この制限は、ヒット化合物の選択を妨げたり、特にゴルジ体(生合成経路)や細胞骨格ネットワークに影響を及ぼす作用機序(MOA)を持つ化合物の効果を覆い隠したりする可能性があります。
ここでは、近赤外光源を搭載したImageXpress® Confocal HT.aiハイコンテントイメージングシステムを活用することで、アッセイを改善することを試みた。我々は、Alexa Fluor 568ファロイジンをAlexa Fluor 750ファロイジンに交換し、細胞骨格をゴルジ区画から明確に分離できるようにした。
このマルチプレックスアッセイは複雑であるため、これらの画像の解析から生成されるデータ量が膨大になり、データのマイニングと解釈を支援する追加の分析物が必要となる。管理しやすい画像とデータ解析のために、特徴抽出にはIN Carta®画像解析ソフトウェアを使用し、データマイニングと解析にはHC StratoMineR™を使用しました。IN Cartaには、よりロバスト性の高い特徴セグメンテーションを可能にするディープラーニング機能が搭載されている。したがって、セルペインティングアッセイは、ディープラーニングSINAPモジュールと併用することで、核の検出が向上するというメリットがあります。さらに、ミトコンドリア、小胞体、ゴルジ体、細胞骨格などの細胞小器官は、必要に応じてディープラーニング機能を使ってさらにセグメンテーションすることができる。蛍光強度、空間数、テクスチャー、オルガネラの分布、コロケーションの測定値を含む測定値を、解析画像から抽出することができる。データはその後、さらなるデータ解析のために、直感的なクラウドベースのデータ解析プラットフォームであるHC StratoMineRにアップロードされる。我々のアプローチが標準的なセルペインティング・プロトコルに比べて優れているかどうかを調べるため、5チャンネルで取得した画像と6チャンネルで取得した画像の表現型距離スコアを比較した。その結果、化合物のサブセットで処理した細胞では、距離スコアが最大49%増加した。これらの結果は、ゴルジ体と細胞骨格に別々のイメージングチャンネルを使用することで、セルペインティングアッセイの感度が向上し、多様な細胞表現型プロファイルをよりロバスト性高く表現できることを示しています。
方法
- U2OS細胞(ATCC)を1ウェルあたり2000セル播種した。
- 11種類の化合物を7点1:3希釈系列で、適切なコントロールとともに4重ウェルで試験した。使用した化合物 Ca-074-Me、CCCP、クロロキン、サイトカラシンD、エトポシド、ラトルンクリンB、ラパマイシン、ロテノン、スタウロスポリン、パクリタキセル、テトランドリン。
- セルはBrayら1によるプロトコルを用いて染色した。修正プロトコールでは、phalloidin/Alexa Fluor 568の代わりにphalloidin/Alexa Fluor Plus 750(Thermo Fisher)を用いた。
- 画像取得は、ImageXpress Confocal HT.ai(レーザーベース)またはImageXpress Micro Confocal(LEDベース)ハイコンテントイメージングシステム(Molecular Devices)のいずれかで、20X Plan Apo対物レンズを用いて行った。使用したフィルターは表1に示す。
- 画像解析にはIN Carta画像解析ソフトウェアを使用した。選択された測定値には、強度、テクスチャー、形状、空間関係、および共局在化スコアに関するパラメータが含まれる。
- セルレベルのデータは、StratoMineR™(https://cla.stratominer.com/index.php, Core Life Analytics)にアップロードし、さらなるデータ解析を行った。簡単に説明すると、品質管理、プレーティングの正規化、データの形質転換、特徴の標準化が適用された。主成分分析(PCA)は、データセットの次元を下げるために使用された。さらに、主成分と表現型の距離スコアに基づいて、ヒット選択とクラスタリング解析などの下流解析を行った。
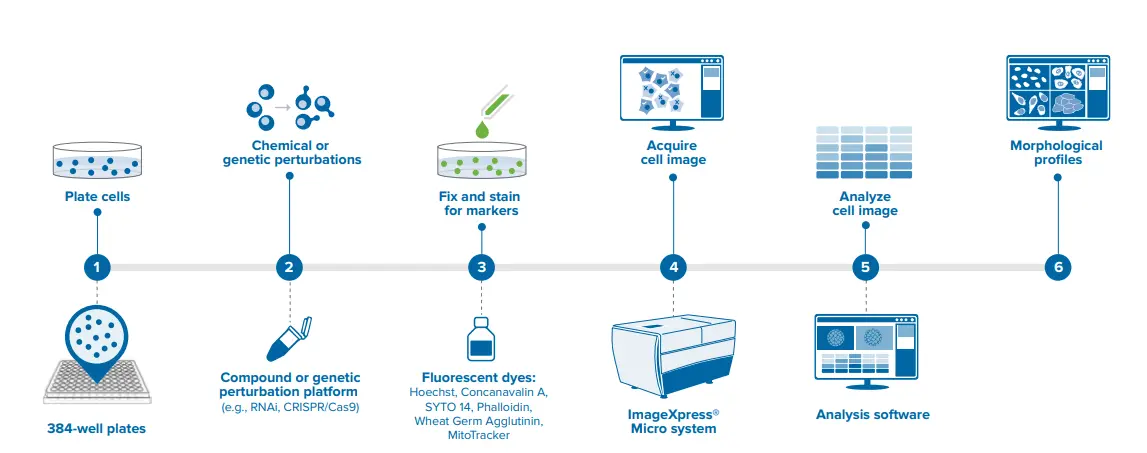
画像ベースプロファイリングのワークフローの概要。上記の各ステップの詳細。
結果
画像取得
セルペインティングアッセイでは、6種類の蛍光マーカーを用いて同時に細胞を標識し、様々な細胞構造をイメージングする。ゴルジ装置(AGPチャンネル)と細胞骨格は、同じフィルターセットを用いて撮像される(表1、図1)。これらの細胞内構造の解像度は、通常、画像解析の段階で行われる。我々のモデルアッセイでは、U2OS細胞を11種類の化合物で24時間処理した後、既報のプロトコールに従って処理した。
ゴルジ構造と細胞骨格を分離するために、Alexa Fluor 568 PhalloidinをAlexa Fluor 750 Phalloidinに置き換えてアッセイを修正し、NIR光源を備えたImageXpress Confocal HT.aiハイコンテントイメージングシステムを用いて細胞をイメージングした(図2A)(以下、修正アッセイと呼ぶ)。この方法により、未処理細胞ではゴルジ体構造が核周辺に分布していることが明瞭に確認できる。この分布は、WGA(ゴルジ体)染色とファロイジン(アクチン)染色の両方を同じチャンネルでイメージングした場合には、容易に区別できない(図1)。この違いは、化合物(テトランドリンなど)で処理した細胞ではより明らかである(図2B)。
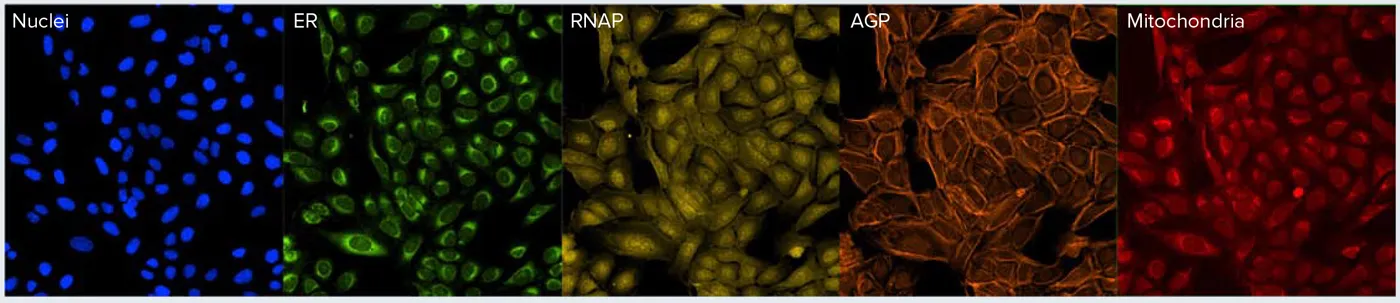
図1. セルペインティングアッセイ。既発表のプロトコルを用いてセルペインティングアッセイ用の色素で染色した細胞の例。ゴルジ体とアクチン構造は同じチャンネル(AGP)で取得されていることに注意。アクチンの染色は糸状構造で表される。しかし、ゴルジ体は目視では容易に区別できない。
| セル コンパートメント | 染料 | Ex/Em | 使用フィルター(LED | 使用フィルター(レーザー) |
|---|---|---|---|---|
| 核(DNA) | Hoechst 3342 | 350/461 | DAPI 377/447 | DAPI 405/452 |
| 小胞体(ER) | コンカナバリン A - AlexaFluor488 コンジュゲート | 495/519 | FITC 475/536 | FITC 467.5/520 |
| 核小体(RNA) | SYTO14 |
516/549 (DNA) 521/547 (RNA) |
Cy3 531/593 | YFP 520/562 |
| ゴルジ装置(AGP) | 小麦胚芽アグルチニン AlexaFluor555コンジュゲート | 555/565 | Texas Red 560/624 | TRITC 555/598 |
| F-アクチン(AGP) | ファロイジン AlexaFluor568 | 578/600 | Texas Red 560/624 | |
| F-アクチンファロイジン | AlexaFluor750 | 758/784 | Cy7 725/794 | |
| ミトコンドリア(mito) | MitoTracker Deep Red | 644/665 | Cy5 631/692 | Cy5 638/692 |
表1. セルペインティングアッセイで使用した染色と、細胞コンパートメントの検出に使用したフィルターセット。
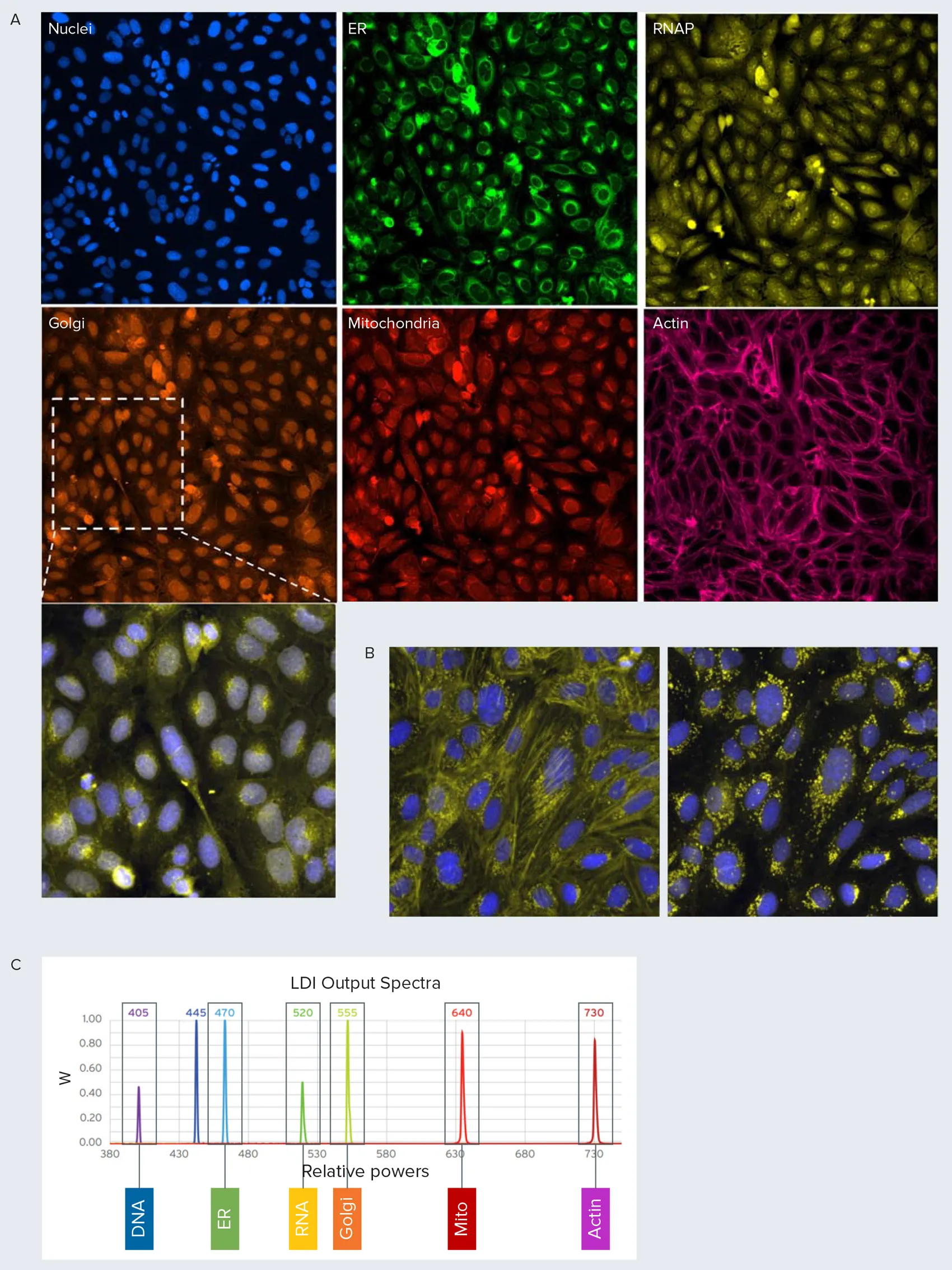
図2. セルペインティングアッセイの変更 セルペインティングアッセイのスペクトル分離を改善するために、遠赤色光源を用いたプロトコルを変更した。A) 修正プロトコールでは、アクチンの標識にファロイジンAlexa Fluor 750を用いた。コントロールウェルの画像例を示す。インセット(白枠)は拡大し、核(青色)とゴルジ体(黄色)チャンネルを合成して示した。ゴルジ体の点刻が、主に核周辺に分布しているのが明瞭に認められる。B) テトランドリンで処理した細胞のイメージング。左はアクチンとゴルジチャンネルを統合した再構成画像(黄色)。右はゴルジ体(黄色)と核(青色)のみの画像。ゴルジ体分布に対するテトランドリンの影響は、修正したプロトコール(右)の方がより明確である。C) レーザー光源とその相対出力。それぞれの光源による細胞コンパートメントの検出。
特徴抽出とデータ解析
標準セルペイント色素セットで染色した細胞と、改良色素セットで染色した細胞との違いを定量化するために、INカルタ画像解析ソフトウェアで画像を解析した(図3)。抽出された測定値は、さらなるデータ解析のためにHC StratoMineRにアップロードされた。主成分分析(PCA)は、標準的なセルペインティングアッセイと改良アッセイから 抽出されたデータに対して行われた。興味深いことに、AGP チャンネルからの測定値は、5 チャンネル画像から得られた PCA 1 の特徴成分のほとんどを占めていた。しかし、アクチンチャンネルからの測定値は、修正された6チャンネル画像からのPCA1では、支配的な特徴のほとんどを占めている(図4)。このことは、修正アッセイが、MOAの理解に有用なアクチンとゴルジ体成分間の表現型プロファイルの解像度を改善できることを示唆している。
また、標準アッセイと改良セルペインティングアッセイの表現型プロファイルを、それぞれの距離スコアに基づいて比較しました。このスコアは、陰性対照との表現型的な距離を示すもので、スクリーニングアッセイにおけるヒットセレクションに用いることができる。ゴルジ体経路に影響を及ぼすことが知られている化合物では、距離スコアが増加することがわかった(表2)。これらの結果は、ゴルジ体と細胞骨格に別々のイメージングチャンネルを使用することで、セルペインティングアッセイの感度が向上し、細胞の表現型プロファイルをよりロバスト性高く表現できることを示しています。
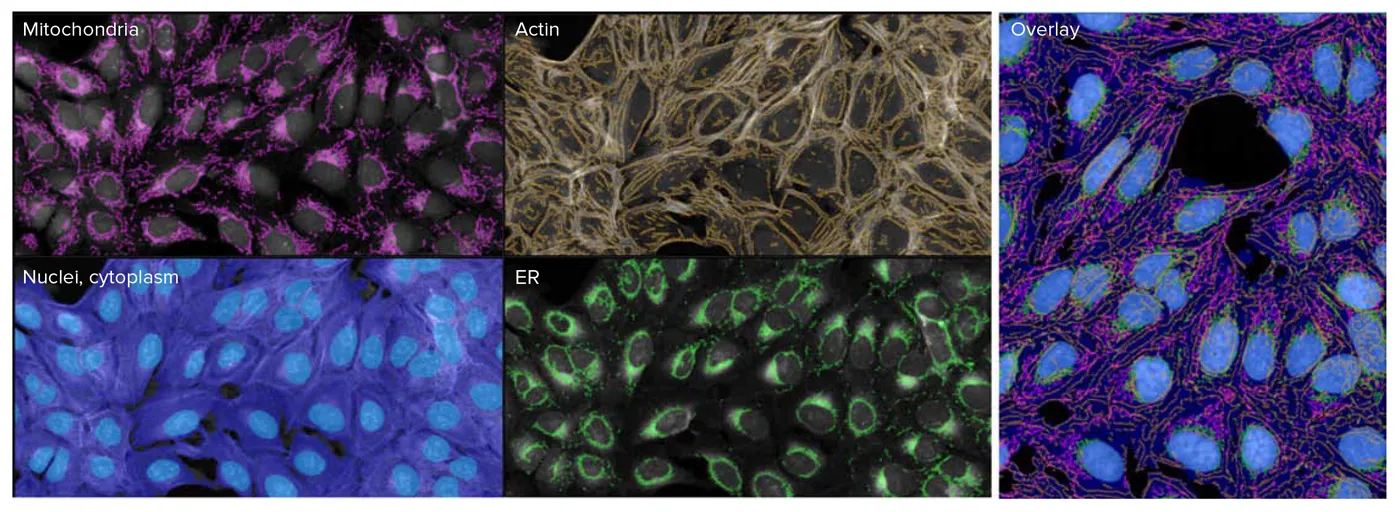
図3. 様々な細胞構造をセグメンテーションするために、IN Carta™ソフトウェアで特徴抽出を行った。ここでは、すべての処理において核のロバスト性セグメンテーションを達成するために、内蔵の核モデルを使用した。6チャンネルで取得された画像について、細胞あたり487の特徴が抽出された。IN Carta™ソフトウェアで特徴マスクをオーバーレイした画像例。
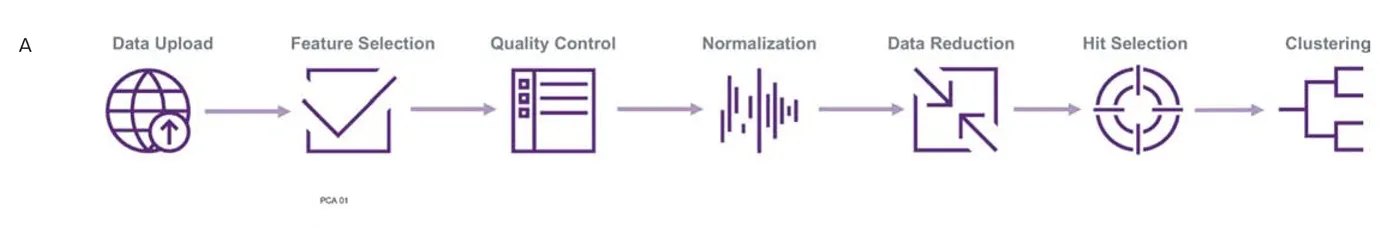
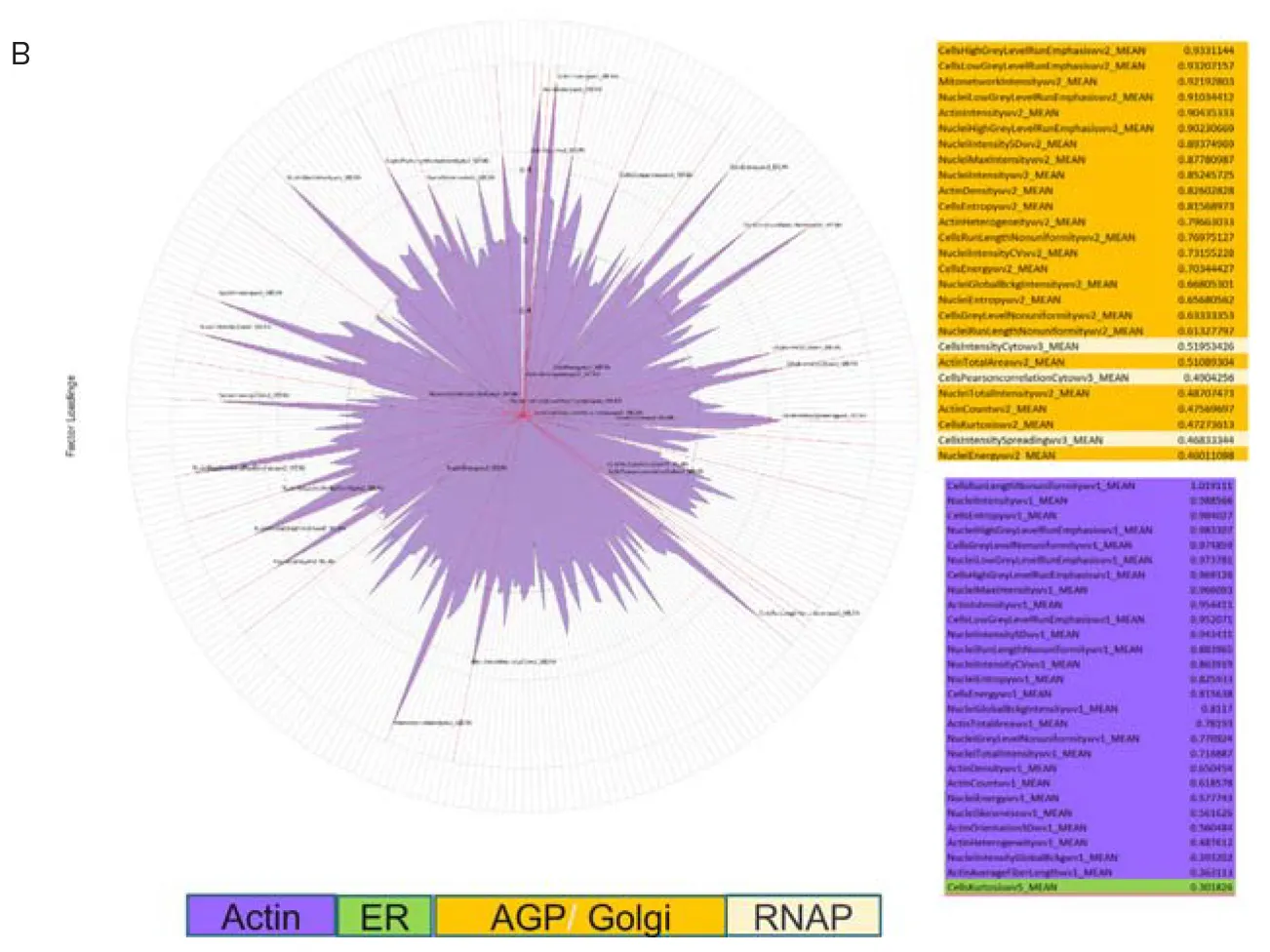
図4. データ解析のためのHC StratoMineRの使用。A) HC StratoMineRは、ハイコンテントマルチパラメトリックデータの解析における典型的なワークフローをユーザーにガイドするウェブベースのプラットフォームである。B) PCA(一般化重み付き最小二乗法)を用いて、データを15成分に絞り込んだ。PCA1へのフィーチャー寄与を偏光プロットで示す。細胞コンパートメントによって色分けされている。5チャンネル(上)と6チャンネル(下)のセルペインティング撮影によるPCA1フィーチャー。フィーチャー寄与の違いに注意。
| 化合物 | 距離スコアの変化(%) |
|---|---|
| クロルキン | 49 |
| テトランドリン | 48 |
| CCCP | 11 |
表2. セル画の5チャンネルと6チャンネルのデータセット間の距離スコアの変化。
結論
- 我々の結果は、近赤外レーザーの使用によりセルペインティングアッセイの感度が向上したことを示すものである。この場合、ゴルジ体表現型の分離においてより感度の高いアッセイの開発が可能となった。
- また、チャンネルを追加することで、プロジェクト特有のバイオマーカーを追加し、標準的なセルペインティングアッセイを拡張することができる。
参考文献
- Bray MA et.al., Nat Protoc. 2016 Sep;11(9):1757-74
- Gustafsdottir SM et.al., PLoS One. 2013 Dec 2;8(12):e80999.
- Omta WA, et.al., Assay Drug Dev Technol. 2016 Oct;14(8):439-452
PDF版(英語)