Application Note EarlyToxライブ/デッドアッセイキットと
ハイコンテントイメージャーを用いた細胞毒性評価の精度と効率の向上
- 無洗浄ホモジニアスアッセイプロトコルの実施
- 迅速な画像取得のための露光時間の短縮
- ハイコンテントイメージャーによるアッセイ精度と効率の向上
- MetaXpress®ソフトウェアの設定済みLive/Dead解析モジュールの活用
PDF版(英語)
はじめに
細胞生存能アッセイは、細胞死や細胞増殖のメカニズムの検討から、薬剤候補、パスウェイ活性化剤や阻害剤、遺伝学的レポーターを含む細胞毒性化合物や新規治療薬の効果の評価まで、幅広い研究分野で利用されています。高品質の画像取得と完全なマルチパラメーター、ハイスループットスクリーニングを組み合わせることで、細胞生存率を評価する最適な方法が得られます。このアプリケーションノートでは、ImageXpress® Micro ハイコンテントイメージングシステムおよびMetaXpress® ハイコンテント画像取得・解析ソフトウェアと組み合わせたEarlyTox™ Live/Dead アッセイキットの使用について報告します。
EarlyTox Live/Dead アッセイキットには、生細胞用マーカーと死細胞用マーカーが封じ込められ、いずれも哺乳類細胞での使用に適しています。これらのユニークな作用機序は、細胞膜透過性に依存します。生細胞マーカーとして広く使用されているCalcein AMにより、生細胞は細胞質内で強度の緑色蛍光で染色される。非蛍光性のカルセインAMは無傷の細胞膜を透過し、アセトキシメチル(AM)基が細胞内のエステラーゼによって切断され、蛍光性のカルセイン分子が得られる。カルセインAMは、EarlyTox™ Live Cell Assay Kit(Molecular Devices P/N R8342:Explorerキット、P/N R8343:Bulkキット)で提供されているように、細胞増殖アッセイや生細胞染色のみを必要とするその他のアッセイにスタンドアロン試薬として使用することができます。
エチジウムホモダイマー-III(EthD-III)は実質的に無蛍光であり、無傷の細胞膜に対して不透過性である。細胞死に伴う細胞膜の完全性が損なわれた場合、EthD-IIIは死んだ細胞内に入り、核酸と結合して明るい赤色の蛍光を発する。細胞膜の完全性に影響を与え、最終的に細胞死に至る細胞毒性イベントは、この方法を用いて正確に評価することができる。
このアッセイキットは、洗浄不要の均一性アッセイプロトコールであるため、死細胞や瀕死細胞を除去する可能性がなく、被験物質の完全な濃度反応プロファイルの特性評価が可能である。カルセインおよび EthD-III からの蛍光シグナルは、ImageXpress Microシステムを使用して検出でき、MetaXpress® ソフトウェアの標準的な Live/Dead アプリケーションモジュールを使用して迅速に解析できる。
材料
- EarlyToxライブ/デッドアッセイキット
- エクスプローラーキット(2プレートサイズ、Molecular Devices P/N R8340)
- バルクキット(10プレートサイズ、Molecular Devices P/N R8341)
- HeLa細胞(ATCC P/N CCL-2)
- HeLa培地
- 最小必須培地(グルタミンおよび血清入り完全培地
- CHO-M1WT3 細胞(ATCC P/N CRL-1985)
- CHO培地
- ハムF-12完全培地(グルタミンおよび血清入り
- ハムF-12完全培地(グルタミンおよび血清入り
- スタウロスポリン(Sigma P/N S5921)
- マイトマイシンC(Sigma P/N M4287)
- 96ウェル黒色透明底マイクロプレート(Greiner P/N 655090)
- 384ウェル黒色透明底マイクロプレート(Corning Falcon P/N 62406-490)
- ImageXpressマイクロハイコンテントイメージングシステムとMetaXpressハイコンテント画像取得・解析ソフトウェア
方法
HeLa細胞を96ウェルマイクロプレートに6,000個/ウェル、100μLの容量でプレーティングした。384ウェルマイクロプレートでは、CHO-M1細胞を1ウェルあたり5,000細胞、容量50 µLでプレーティングした。両方のプレートを37℃、5% CO2のインキュベーターに一晩置き、細胞の接着と増殖を待った。その後、両細胞をスタウロスポリン(一般的なプロテインキナーゼ阻害剤であり、抗がん治療用タンパク質として期待されている)で24時間処理した。
HeLa細胞もマイトマイシンC(強力なDNA架橋剤、化学療法剤)で処理した。HeLa細胞は1:3に連続希釈した化合物で4回反復処理し、CHO細胞は1:2に連続希釈したスタウロスポリンでトリプリケート処理した。HeLaプレートの対応するウェル(コントロールウェルを除く)に、100μLの2倍希釈化合物を添加した。スタウロスポリンの最終濃度は1 µMから0.000017 µM(0.017nM)までであり、マイトマイシンCの最終濃度は100 µMから1.694 µMまでであった。50µLの2倍スタウロスポリン希釈液をCHOプレートのウェルに加え、最終濃度を2µMから0.00024µM(0.24nM)にした。化合物を連続的に希釈することで、これらの化合物の細胞毒性作用に対する用量依存的な反応を解析することができた。
カルセインAMとEthDIIIのストック溶液を温DPBSに入れ、各染料を2 µMの濃度になるように調製した。染色液を添加する前に、各ウェルから等量の培地を除去した。この結果、各染料の最終濃度は1 µMとなった。プレートを37℃、5% CO2で45分間インキュベートした。EarlyTox Live/Dead キットに加え、Hoechst 33342 のような核染色剤をセルに添加することで、全細胞数のデータ取得を補助することができます。Live/Dead 染色のインキュベーション後、55 µM (11X) Hoechst 溶液を各ウェルに 10 µL ずつ添加し、各ウェルの最終濃度を 5 µM にしました。細胞を37℃、5% CO2で15分間インキュベートした。
最終インキュベーションの直後、10X Plan Apo対物レンズとFITC、Texas Red、DAPI(核がHoechstでカウンター染色されたため)フィルターセットを用いて、プレートをImageXpress Microシステムでイメージングした。この倍率では、1視野で1,100-1,500個の細胞をイメージングできるので、1枚の画像で統計的に意味のある結果が得られる。HeLa細胞プレートは、1ウェルあたり2部位でイメージングされ、2000細胞/ウェル以上の解析が可能となった。画像はワイドフィールドイメージングモードを用いて撮影した(図1および2)。
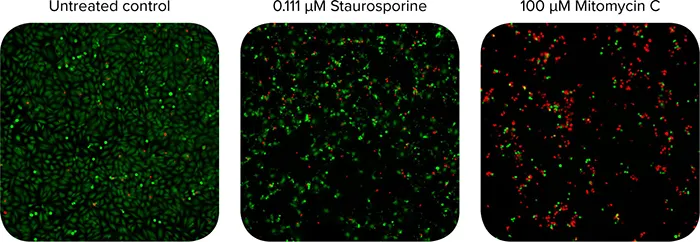
図1. Calcein-AM染色(緑)およびEthidium Homodimer-III染色(赤)したHeLa細胞の10倍ワイドフィールド画像。(左)未処理のコントロール、(中)0.11 µMスタウロスポリン処理、(右)100 µMマイトマイシンC処理。両化合物とも高い頻度で死細胞核を誘導した。
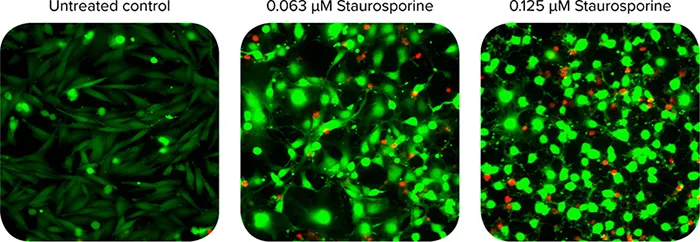
図2. カルセインAM染色(緑)およびエチジウムホモダイマーIII染色(赤)CHO細胞の40倍ワイドフィールド画像。未処理のコントロール(左)では100%のセルが生存していることが確認されたが、スタウロスポリンで処理したウェルでは20%(中)と27%(右)の死細胞核が高頻度に認められた。
明るい染色により高速読み取りが可能
ImageXpress Microシステムを用いた10倍画像のプレーティングは非常に効率的で、96ウェルプレート全体を2分半、384ウェルプレートを2色(FITC、Texas Red)で9分半で処理できた。キットに含まれる蛍光色素の輝度が高いため、露光時間が短く、迅速な画像取得が可能で、不要な光退色を防ぐことができた。
あらかじめ設定された画像解析モジュールにより、正確なデータ生成が容易になった。
ワイドフィールド画像は、MetaXpress®ソフトウェアのLive/Deadアプリケーションモジュールを用いて解析した。直感的なユーザー入力により、このモジュールは、各細胞タイプが発現する染色に基づき、生細胞と死細胞を識別・区別するように設定された。生細胞と死細胞の数、生細胞と死細胞のパーセンテージ、総細胞数、各Wavelengthの強度など、複数の測定パラメータを評価することができた。さらに、核がHoechstでカウンター染色されている場合、Multi-Wavelength Cell Scoringソフトウェアモジュールを、Live/Deadモジュールと共に(あるいはその代わりに)実行することができる。これにより、細胞生存率アッセイに追加分析が提供されます。例えば、特異性波長(FITCまたはTexas Red)で陽性蛍光を発する細胞をスコアリングしたり、すべての核を正確にカウントしたりすることができます。
毒性EC50値は用量反応曲線から計算できる。
生細胞および死細胞を蛍光イメージャーでイメージングし、カルセイン(緑色蛍光)またはEthD-III(赤色蛍光)陽性染色細胞に基づいて定量分析を行った(図1および2)。HeLa細胞をスタウロスポリンとマイトマイシンCで処理すると、いずれも明確な濃度応答が認められた(図3)。生細胞率および死細胞率対化合物濃度のグラフは、スタウロスポリンで0.121 µM、マイトマイシンCで9.307 µMのEC50値を示す用量反応曲線を示した。スタウロスポリンの濃度に対するCHO細胞の生死パーセンテージの曲線は、0.180 µMのEC50値を示した。両実験におけるスタウロスポリン処理のEC50値が同等であることは、生細胞と死細胞の判定におけるEarlyTox試薬の正確性をさらに実証しています。
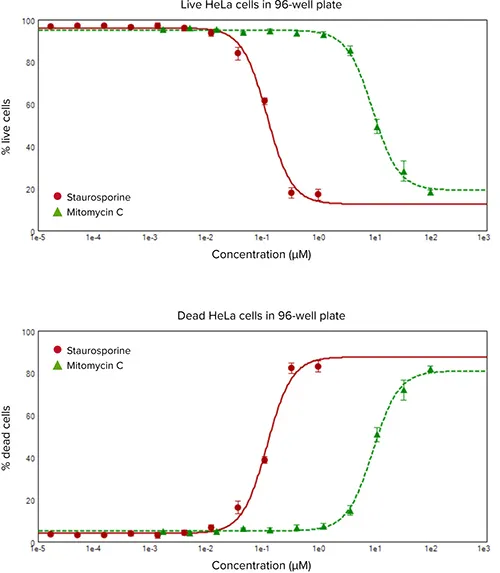
図3. スタウロスポリン(赤)とマイトマイシンC(緑)で24時間処理したHeLa細胞の生細胞率と死細胞率の濃度反応曲線。細胞はImageXpress Microシステムにより1ウェルあたり2カ所でイメージングした。カルセインAM染色により緑色に蛍光を発する生細胞と、EthD-IIIにより赤色に蛍光を発する死細胞を、MetaXpress®ソフトウェアのLive/Dead解析モジュールでカウントした。2つの部位からのデータを平均した。生細胞の割合(上)と死細胞の割合(下)について、化合物濃度に対する4パラメータカーブフィットをプロットした。この曲線から、EC50値はスタウロスポリンで0.121 µM、マイトマイシンCで9.307 µMであった。
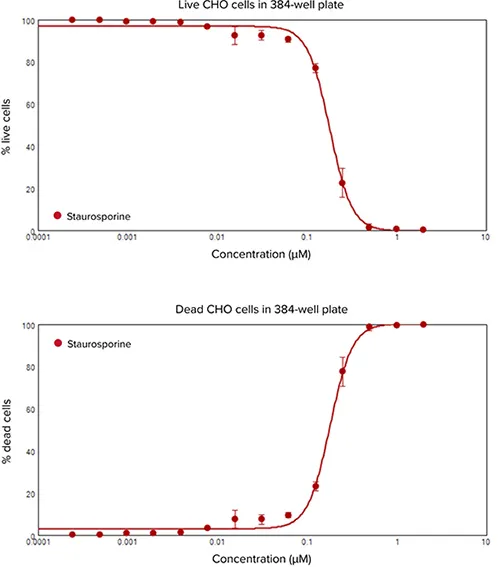
図4. スタウロスポリン(赤)で24時間処理したCHO細胞の生細胞率と死細胞率の濃度反応曲線。細胞は、ImageXpress Microシステムにより、ウェルあたり1カ所でイメージングした。生細胞(緑色蛍光、Calcein AM)と死細胞(赤色蛍光、EthD-III)をカウントし、MetaXpress® ソフトウェアのLive/Dead解析モジュールを用いて区別した。スタウロスポリンの濃度に対する生細胞(上)と死細胞(下)のパーセンテージを4パラメータカーブフィット処理でプロットした。両曲線ともEC50値は0.180 µMであった。
結論
MetaXpress®ソフトウェアとImageXpress Microシステムで解析したEarlyTox生細胞/死細胞アッセイキットは、非常に効率的なワークフローで生細胞と死細胞の正確な測定を可能にする。EarlyToxキットの細胞生存率マーカーを画像ベースで迅速かつロバストに定量できる一方で、蛍光色素の輝度により、科学者は低試薬濃度に最適化することができます。一貫性のある統計学的な定量分析により、濃度の異なる複数の化合物のテストが可能になり、ほぼすべての細胞生存率アッセイに適応できます。
PDF版(英語)