Application Note 自動ワークステーションを用いた
セルペインティングアッセイのスループット向上
- ルペインティングアッセイの作業時間を80%以上短縮
- フレキシブルで自動化されたプロセスは、様々なアプリケーションに容易に変更可能。
- セルペインティングアッセイにおける人為的ミスの削減とスループットの向上
PDF版(英語)
要旨
Michael Hayes, PhD | Beckman Coulter Life Sciences
Angeline Lim, PhD | Molecular Devices
セルペインティングは、創薬コミュニティにおいて人気のあるスクリーニング手法となっている。この表現型スクリーニングプラットフォームは、ハイコンテント顕微鏡、ハイスループットスクリーニング、リキッドハンドリング、そして膨大な量のデータを生成する計算の進歩を活用している。セルペインティングアッセイは、目的の表現型を誘導することができる新薬や創薬標的を同定するために、遺伝的摂動や薬剤様低分子ライブラリーと組み合わせて用いられることが多い。セルペインティングのワークフローは時間と労力を要し、数日を要し、多くのアッセイプレートのスクリーニングを必要とする。Biomek i7 Hybrid自動化ワークステーションのような自動リキッドハンドラーを使用すれば、これらのプロセスを合理化し、貴重な時間を節約し、アッセイのスループットを向上させることができる。ここでは、セルペインティングアッセイプレートを調製する自動ワークフローを開発した。細胞を染色した後、Molecular Devices ImageXpress® Confocal HT.ai ハイコンテントイメージングシステムを使用して、下流のデータ解析のための高画質画像を取得した。Biomek i7ハイブリッド自動ワークステーションを用いて、細胞をパラホルムアルデヒド固定し、Triton X-100で透過処理した後、6種類の分光学的に適合性のある蛍光染色の組み合わせで処理した。また、低分子スクリーニングのセットアップをシミュレートするためのケーススタディとして、コルヒチンの時間経過実験を行った。ここで発表されたデータは、BiomekリキッドハンドリングとImageXpressイメージングを組み合わせた自動ワークフローが、どのように形態学的プロファイリングに使用できるかを明らかにするものである。
はじめに
最近の細胞生物学の進歩により、ますます複雑なヒト疾患モデルの開発が可能になった。これらの進歩には、患者由来の人工多能性幹細胞のような新しい細胞モデル、三次元オルガノイドのような新しい培養法、CRISPR/Cas9のような新しい精密な遺伝子編集法などが含まれる。これらの最近の細胞モデルを含む多くのワークフローは、最終的な読み出しとして蛍光イメージャーを使用し、より複雑で情報量の多い実験セットアップの開発につながっている。この表現型スクリーニング・プラットフォー ムは、ハイコンテント顕微鏡、ハイスループット・スクリーニング、リキッドハンドリングの進歩を活用し、大量のデータを生成する。セルペインティングは、遺伝子や低分子のスクリーニングなど、様々な細胞操作の分析に用いられてきた。遺伝子スクリーニングでは、各ウェルに目的の遺伝子を操作するための試薬が封じ込められ、しばしばsiRNAやCRISPR/Cas9が用いられる。低分子化合物スクリーニングでは、数千から数百万の化合物をテストし、薬剤のようなリード化合物を同定する。
さらに、人工知能や機械学習を用いて、ハイコンテントイメージに基づき、生理学的に関連するモデルシステムにおいて生物学的に活性な化合物を同定することへの関心が高まっている。あるいは、セルペインティングには、テストした各条件の形態学的な細胞プロフィールを作成できるという利点がある。ポストホック分析を使って、観察されたセルペインティングプロファイルに基づいて、既知の対照遺伝子/薬剤条件と実験的治療とをクラスタリングすることができる4(これは、より多くの画像ベースのデータセットで計算手法が洗練されるにつれて、創薬コミュニティで有用性が増す研究分野である)。
典型的なセルペインティングアッセイの一般的なワークフローを以下に概説する(図1)。まず、細胞を光底マイクロタイタープレートにプレーティングする。一般に、ワークフローのイメージング部分がより簡単になるため、接着細胞が好ましい。次に、細胞をトランスフェクション(遺伝学的スクリーニング)または化合物添加(低分子スクリーニング)のいずれかの方法で、目的の実験条件で処理し、目的の表現型が観察できるまでインキュベートする。その後、セルを固定し(パラホルムアルデヒド)、透過処理し(Triton X-100)、染色する(ライブ染色を使用する場合は、固定前に行う)。プレートは、Molecular Devices ImageXpress Confocal HT.ai ハイコンテントイメージングシステムのような自動蛍光コンフォーカル顕微鏡を用いて画像化されます。画像は、IN Carta® 画像解析ソフトウェアやオープンソースの CellProfilerソフトウェアパッケージなどの画像解析ソフトウェアで解析され、測定値は、ウェブベースの StratoMineR(Core Life Analytics)など、細胞形態プロファイルを解析できるデータマイニングパイプラインに供給される5。
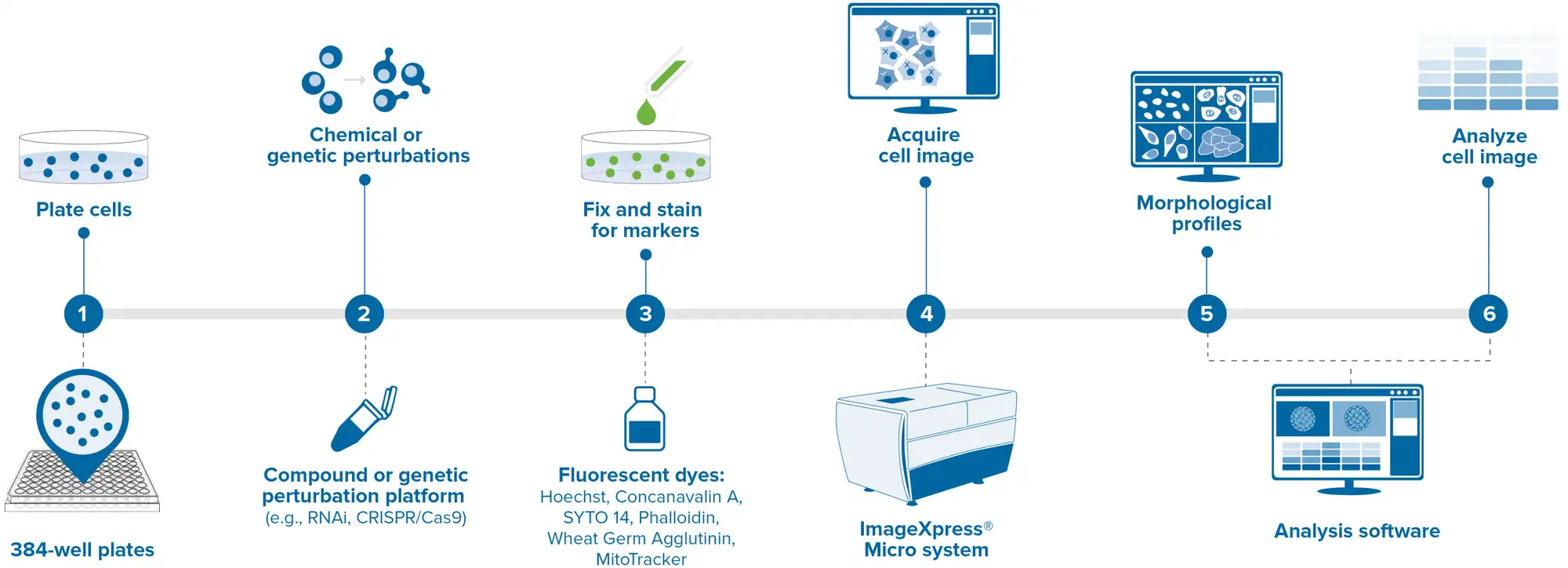
図1. 自動セルペインティングワークフロー 自動セルペインティングリキッドハンドリング、画像取得、データ解析の簡略化されたプロトコール。Biomek i7ハイブリッド自動ワークステーションを用いて、セルをプレーティング、薬剤処理、固定、染色した。画像はMolecular Devices ImageXpress® Confocal HT.aiを用いて取得した。
このワークフローには数日を要し、ユーザーによるいくつかのタッチポイントが必要である。少数の条件しかテストしない場合や96ウェルプレートで作業する場合は、手動ピペッティングでこれらのステップをすべてプレーティングすることも可能ですが、高密度(384ウェル以上)やハイスループットが要求される場合は、手作業でこれらのステップを実行することは現実的ではなくなります。Biomek i7 ハイブリッド自動化ワークステーションは、セルペインティングワークフローの複雑なリキッドハンドリングステップを効率的に実行できる自動リキッドハンドラーである(図2)。これにより、必要なユーザー操作の回数を最小限に抑え、ウォークアウェイ時間を増加させ、オペレーターは他のラボ作業に専念することができる。マルチチャンネルポッドには、それぞれ1~1200 μLおよび0.5~60 μLを正確にピペッティングできる96ウェルまたは384ウェルヘッドを装備できます。さらに、8チャンネルのSpan-8ポッドは、0.5~>1000μLの精度があります。このワークステーションは45のデッキポジションをサポートし、プレートおよびサンプル処理用の環状シェーカー、加熱/冷却ペルチェ、チップウォッシャーなどの装置を直接取り付けることができます(図2)。

図2. Beckman Coulter Life Sciences Biomek i7 Hybrid 自動ワークステーションと Molecular Devices ImageXpress Confocal HT.ai ハイコンテントイメージングシステム。
さらに、ユーザーのニーズに応じて、Biomek i7 Hybrid ワークステーションは、組織培養インキュベーター、バーコードリーダー、プレートウォッシャー、バルク試薬ディスペンサー、マルチモードプレートリーダー、遠心分離機、自動蛍光顕微鏡など、他の自動プレートハンドリング機器との統合をサポートする。もう一つの重要な特徴は、オプションのHEPAフィルターで、哺乳類細胞培養を扱うときに重要な要素である無菌環境を作り出す。このように、自動セルインキュベーター(例:Liconic、Cytomat、Thermo Fisher)とハイコンテントイメージャーを統合したBiomekシステムは、細胞プレーティングから画像取得までのセルペインティングワークフロー全体を、ユーザーによるデッキセットアップのみで行うことができる。ImageXpressコンフォーカルHT.aiハイコンテントイメージングシステムは、7レーザー光源を搭載したスケーラブルなハイスループット、ハイコンテントスクリーニングソリューションです。高輝度レーザーの使用により、画質を損なうことなく露光時間を短縮することができる。これは、LED光源を搭載したシステムと比較して、撮影スピードの大幅な向上につながります。さらに、ImageXpress® Confocal HT.aiは最大8チャンネルのイメージングが可能であるため、セルペインティングのような高度なマルチプレックスアッセイに最適です。
ここでは、Biomek i7 ハイブリッドワークステーションを用いた HEK293 細胞のプレーティングから固定、染色、そして ImageXpress Confocal HT.ai ハイコンテントイメージングシステムを用いた画像取得までの自動ワークフローをご紹介します。自動ワークフローは、スループットを向上させると同時に、作業時間を短縮し、ユーザーによるサンプル操作ミスの可能性を減らすことができる。
方法
セル培養
Lenti-X 293T細胞(Takara)は、DMEMに10% FBSと1% 100X antibiotic/antimycotic(Gibco)を添加した増殖培地中で、5% CO2、37℃に維持した。細胞採取のため、培養液をDPBSで洗浄し、トリプシンで解離させ、Allegra X-14R 遠心機(Beckman Coulter Life Sciences)を用いて300 x gでペレット化し、Opti-MEM Iと増殖培地を1:1で再懸濁した。細胞を血球計数器で数え、さらにOpti-MEM Iで希釈し、所望の細胞密度100cells/μLにした。96ウェルプレートでは、HEPAフィルターユニットを装備したBiomek i7ハイブリッドワークステーションを用いて、1ウェル当たり10,000個の細胞をプレーティングした(総容量100μL)。低分子薬物投与をシミュレートするため、コルヒチンをOpti-MEM Iで1μMに希釈し、Biomek i7ハイブリッドワークステーションを用いて、96ウェル細胞ペインティングアッセイプレートの各ウェルに50μLを指示された時点で添加した。コルヒチンを含まないOpti-MEM Iをコントロールとした。
自動セルプレート調製
自動リキッドハンドリング法では、吸引と洗浄の全ステップは1200μLヘッドを備えた96ウェルマルチチャンネルポッドを用いて行い、試薬添加の全ステップはSpan-8ポッドを用いて行った。自動化メソッドのデッキレイアウトを図3に示す。すべての自動リキッドハンドリングステップは、プレートウェルの中心から70%以上離れた位置から5μL/secで吸引・分注するピペッティングテンプレートを用いて行った。これにより、ウェル底の細胞単層が、セルペインティング手順の間、邪魔されないことが保証された。パラホルムアルデヒド溶液は、16%ストック溶液を超純水で6.8%PFAに希釈し、アッセイ当日に新たに調製した。
まず、ウェルの内容物110μLを吸引し、96ウェルプレートに最終容量40μLを残し、ウェルを110μLのDPBSで2回洗浄した。次に、60μLのMitoTracker Deep Redを各ウェルに添加し、プレートを暗所、周囲温度で20~30分間インキュベートし、細胞を110μLのDPBSで再度洗浄した。次に、60μLの6.8%PFAを加えて細胞を固定し、最終濃度を4%PFAにした。プレートを暗所、周囲温度で20分間インキュベートした後、PFAを除去し、細胞を110μLのDPBSで2回洗浄し、各ウェルに最終容量の150μLのDPBSを残した。プレートを密封し、セルペインティングアッセイを行う日まで4℃で暗所保存し、細胞を染色してイメージングした。
セルペインティングアッセイ
トリトンX-100浸透液は、トリトンX-100を0.1 mg/mL BSA添加DBPSで0.1%に希釈して作製した。Hoechst、コンカナバリンA、SYTO 14、WGA、ファロイジン蛍光色素のストック溶液を調製し、Brayら(1)に記載されているように、単一の染色マスターミックスに合わせた。110μLのDPBSでセルを洗浄した後、120μLのTriton溶液を加え、暗所、周囲温度で10-20分間透過処理した。その後Tritonを除去し、細胞を110μLのDPBSで2回洗浄した。細胞を、40μLの染色試薬を加え、暗所、周囲温度で30分間染色した。最後に染色液を除去し、細胞を110μLのDPBSで3回洗浄し、ImageXpress Micro HT.ai ハイコンテントイメージングシステムを用いてプレートをイメージングした。
画像取得とデータ解析
IN Carta画像解析ソフトウェアを用いて画像を解析した。画像セグメンテーションプロトコルは以下のように設定した: 核は、カスタムセグメンテーションで事前に訓練されたモデルNuclei.a.h5を用いて主要ターゲットとして割り当てられた。エッジに触れる対物レンズは除外した。セルはYFPチャンネル(SYTO14)をロバストオプションでセグメンテーションした。さらに3つのオルガネラクラスを指定されたオプションでセグメンテーションした: ミトコンドリア(ネットワーク)、アクチン(線維)、小胞体(ネットワーク)。各細胞コンパートメントから測定値を抽出した。形状、サイズ、強度、テクスチャー、共焦点化、隣接する対物レンズとの空間的関係などの測定値が解析出力として選択された。セルあたり合計487の特徴が抽出された。
データ解析のために、細胞レベルのデータはCSV形式でエクスポートされ、化合物情報を含むメタデータを含むテキストファイルとともにHC StratoMineR(CoreLife Analytics)にアップロードされた。プレーティングマップはStratoMineRのインターフェイス内で定義された。Quality Controlタブを使用して、異常値ウェルを解析から除外することができる(50セル未満のウェルは除外された)。データ形質転換は、推奨される方法で行い、その後、フィーチャースケーリングを行った。主成分分析(PCA)はデータ削減のために使用された。その結果得られた7つの成分を用いて距離スコアを算出し、これはウェル内のセルに対する処理の表現型効果の尺度として定義される6。
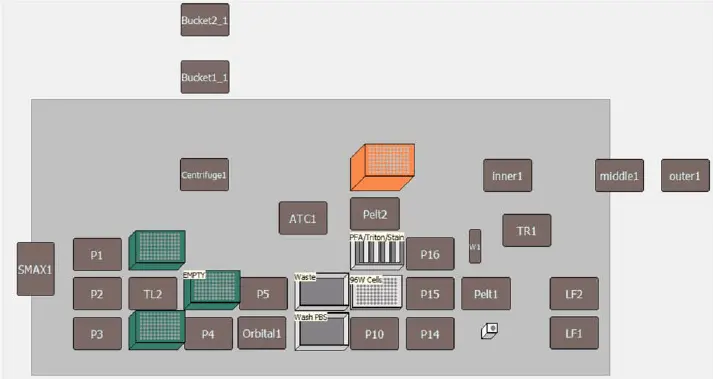
図 3. Biomek i7 ハイブリッドワークステーションを用いた自動セルペインティングアッセイのデッキレイアウト Biomek i7 ハイブリッドワークステーションを用いた自動セルペインティングアッセイのデッキレイアウト Biomek i7 ハイブリッドワークステーションを用いた自動セルペインティングアッセイのデッキレイアウト Biomek i7 ハイブリッドワークステーションを用いた自動セルペインティングアッセイのデッキレイアウト Biomek i7 ハイブリッドワークステーションを用いた自動セルペインティングアッセイのデッキレイアウト Biomek i7 ハイブリッドワークステーションを用いた自動セルペインティングアッセイのデッキレイアウト
結果と考察
セルペインティングは、様々な細胞操作の後、豊富な情報を得ることができるため、スクリーニング界で人気を集めている。セルペインティングアッセイのためのプレート調製ワークフローには、特にスクリーニングするプレートの数が増えるにつれて、手作業で行うには非現実的となりうる手間のかかるリキッドハンドリングステップが含まれる(1)。そのため、Biomek i7ハイブリッド・ワークステーションを用いて、以前に記載されたベストプラクティス(実施基準)を用いて、ウォークアウェイ・プレート処理法を開発した(1)。プレートをプレーティングする前に、セルはそれぞれ4% PFAと0.1% Triton X-100を用いて固定と透過処理を行った。ここでは、新たに開発した自動化手法のリキッドハンドリングを、手作業でペインティングしたセルと比較する。
自動ワークフローで評価された最初のパラメーターは、手動ワークフローに対する時間短縮であった。96ウェルプレート1枚を、12ウェルマルチチャンネルピペットとBiomek i7 Hybridワークステーションを用いて手動でプレーティングした。プレート1枚の場合、どちらのワークフローも完了までに約2時間かかり(手動120分 vs Biomek115分)、合計時間のうち60分は暗所での周囲温度でのインキュベーションであった。Biomek法では、必要な実地時間はデッキのセットアップのためのメソッド開始時の5〜10分のみであった。一方、手動法ではピペッティングに60分を要した(表1)。さらに、自動メソッドは384ウェルフォーマットに簡単にアダプターできた。384ウェル法では約120分かかったが、ここでも必要な手作業はデッキのセットアップのみであった(5-10分)。384ウェルのワークフローは手作業では行わなかった。このプレートフォーマットでは、手作業によるピペッティングに3~4時間を要する可能性があり、現実的ではないと考えられたからである。
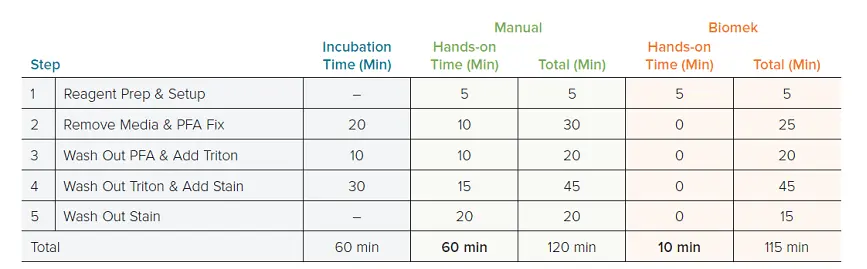
表1. 手作業と自動セルペインティングのタイミング
この新しく開発された自動化法を定性的に評価するために、市販の蛍光染色剤を用いてHEK293細胞を染色した(図4)。その結果、ほぼ予想通りの染色パターンが得られた。小胞体、ゴルジ体、ミトコンドリア、核、RNA(核小体)は、以前に報告されたセルペインティングの結果と一致した染色パターンを示した(図4)(1)。興味深いことに、ファロイジンによるf-アクチン染色では、ロバスト性の蛍光標識が得られたが、以前のセルペインティングの結果のように、明瞭なアクチンフィラメントは識別できなかった。これは、HEK細胞株と今回使用したファロイジン染色の濃度との組み合わせによるものかもしれない。このことは、大規模なスクリーニングを行う前に、目的のセル株に最適な染色濃度を特定するための予備実験が必要かもしれないことを強調している。さらに重要なことは、この実験の結果から、自動セルペインティングと画像取得のワークフローが機能していることが示されたことである。細胞は各ウェルの底に明瞭に存在し、これは自動リキッドハンドリングが、細胞をプレートに接着させたまま固定するのに十分穏やかであったことを示している。さらに、いくつかの色素(ファロイジン、コンカナバリン)は通常、細胞に対して不透過性であるため、細胞内コンパートメントの染色は、0.1% Tritonを用いて十分な細胞透過性が達成されたことを示している。最後に、各チャンネルで観察されたロバスト性の蛍光シグナルは、染色ステップも成功したことを示している。
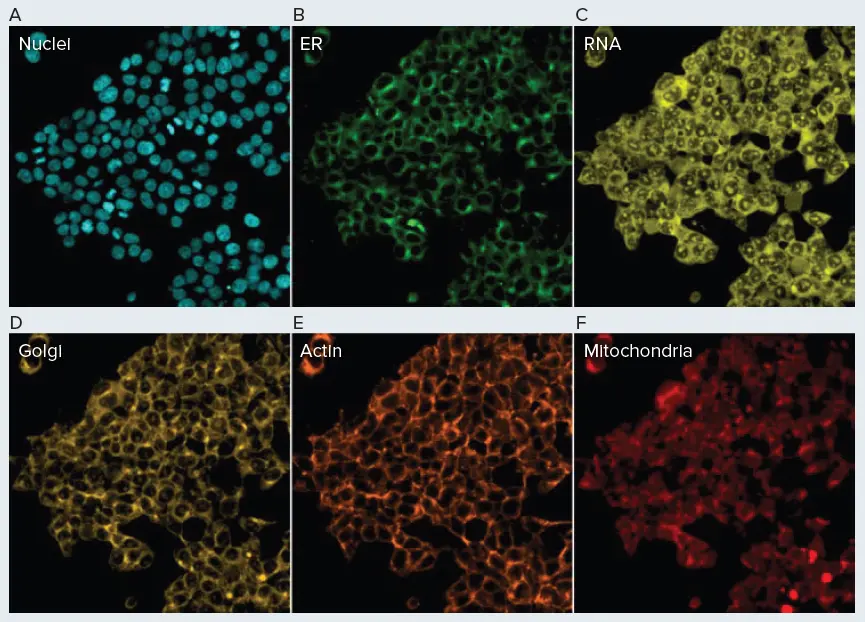
図 4. 自動セルペインティングアッセイ HEK293 細胞を Biomek 自動化法を用いてペインティングし、Molecular Devices ImageXpress Confocal HT.ai ハイコンテントイメージングシステムを用いてイメージングした。小胞体網様体はコンカナバリンA(A)、ゴルジ体/形質膜は小麦胚芽アグルチニン(B)、ミトコンドリアはMitoTracker(C)、核はHoechst 33342(D)、アクチンはファロイジン(E)、RNAはSYTO Green(F)で染色した。
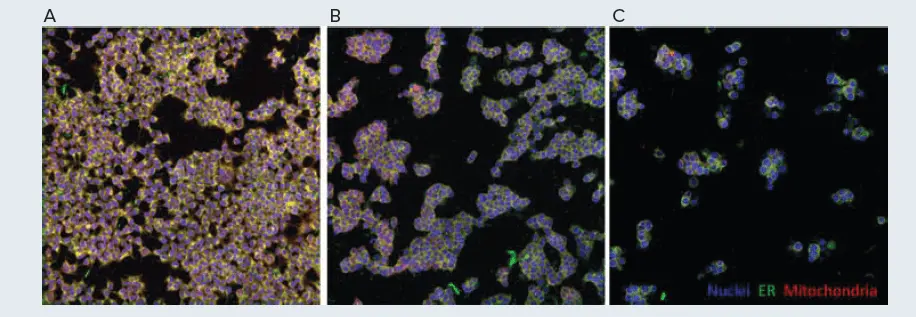
図5. 模擬細胞塗装スクリーニング対照 HEK293細胞をビヒクルコントロール(A)または300 nMコルヒチンで4時間(B)または24時間(C)処理した。画像はMolecular Devices ImageXpress Confocal HT.ai ハイコンテントイメージングシステムで取得した。
セルペインティングはスクリーニング技法として用いられることが多いので、各ウェルには異なる薬物様低分子化合物など、異なる細胞操作が封じ込められることが多い。このアッセイ設定をシミュレートするために、コルヒチンを対照化合物として選択した。コルヒチンは、有糸分裂とそれに続く正常な細胞分裂に必要なチューブリンに結合して阻害する。この作用機序から、この薬剤で処理するとHEK293細胞の形態が劇的に変化すると予測された。Biomekを用いて、細胞をプレーティングし、300 nMのコルヒチンで24時間または4時間処理し、未処理の細胞をコントロールとして用いた。処理後、Biomek i7 ハイブリッドワークステーションとImageXpress Confocal HT.ai ハイコンテントイメージングシステムを用いて、それぞれ細胞をペイントし、イメージングした。コントロールとコルヒチン処理細胞の間で観察された細胞表現型の違いは劇的であった(図5A、5C)。コルヒチンで処理されたセルは大きく丸くなり、有糸分裂のメタフェースの間に細胞周期が停止したことを示した。さらに、薬物処理後のウェルあたりの細胞数は少なく、これはおそらく細胞が適切に分裂できなかったためであろう。
セルペインティングのワークフローのもう一つの重要な部分は、下流の画像とデータ解析である。画像はまず、IN Carta画像解析ソフトウェアを用いて解析された。IN Cartaはディープラーニングに基づくセグメンテーションツール(SINAP)を備えており、ロバスト性のある特徴同定が可能である。解析のために、SINAPの核モデルは核の検出を改善し、触れる核を正確に分割することができた。SYTO14染色を用いて細胞質を定義し、ER、ミトコンドリア、アクチン構造も同定・解析した。全体として、各セルから、強度、テクスチャー、形状、オルガネラ間の空間的関係、および共局在化数を表す487の測定値が得られた。
図5に示した各条件について、24個の複製ウェルから得られた細胞レベルのデータを、HC StratoMineR(Core Life Analytics)のクラウドベースツールに供給した。主成分分析を用いて、487の測定値を7つの主成分に分類した。3つの異なるクラスタリングが観察され、各クラスタは単一のコルヒチン処理条件を代表していた(図6)。これは、各レプリケートが同一処理ウェルで正確にクラスタリングされたことから、セルペインティングワークフローにおける自動リキッドハンドリングと画像取得の有用性を強調するものである。また、コルヒチンは、IN CartaとHC StratoMineRを用いた解析で区別できるような、ロバスト性の時間依存的な表現型の違いを誘導したことから、品質管理化合物の有用性も浮き彫りになった。
上記の結果は、1枚のプレートをプレーティングした場合のものであるが、多くのワークフローでは、より大きなライブラリーをスクリーニングするために、複数のプレートを処理する必要がある。これも自動リキッドハンドラーの得意とするところである。Biomekワークステーションは、自動インキュベーター(セル)やハイスループット蛍光顕微鏡(モレキュラーデバイス)のように、自動細胞ハンドリングとイメージングを行うための様々なインテグレーションを取り付けることができる。しかし、プレート洗浄機(BioTek 405)やバルク試薬ディスペンサー(MultiFlo/ Multidrop)を使って細胞洗浄ステップを行いたいユーザーもいるだろう。幸いなことに、Biomek iSeries はこれらのインストゥルメンテーションと統合することも可能であり、ここで説明したものよりも高度でハイスループットのワークフローを可能にする。さらに、細胞プレーティングプレートの蛍光イメージングは時間がかかる(1プレートあたり1~2時間)ため、一度に複数のプレートをアセンブルしたくないユーザーもいるかもしれない。ベックマン・コールター・ライフサイエンス社は、SAMI EX スケジューリングソフトウェアも提供しています。このソフトウェアツールを使用すると、固定/浸透/染色中にすべてのプレートがほぼ同じ時間経過で処理されるように、染色やプレート読み取りなどのメソッドコンポーネントをインターリーブするために、高度なタイミングとプレートハンドリング操作をスケジュールすることができます。これらのハードウエアとソフトウエアを組み合わせることで、ハイスループット、ウォークアウェイセルペインティングワークフローを提供することができる。
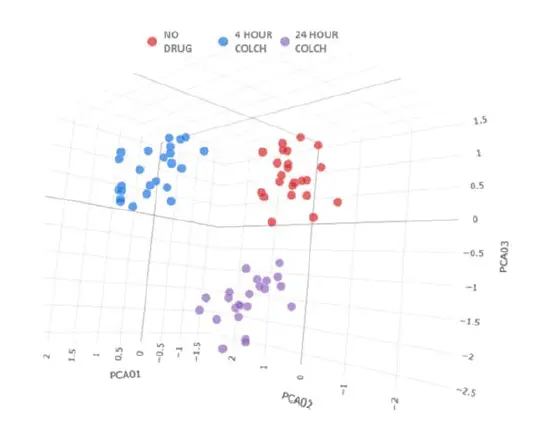
図6. データPCAプロット HC StratoMineRでは、各条件で24個のウェルが評価された。ウェルは3つの異なるクラスタリングに分けられ、それぞれが1つの処理条件を代表した。
要約
創薬コミュニティが高度に複雑な疾患モデル細胞を作製する能力を向上させるにつれて、高度に複雑なアッセイの出力に対する関心も高まっている。注目されている方法の一つがセルペインティング法であり、市販のシンプルな細胞染色を数種類マルチプレックスして複雑な表現型データを作成するものである(1)。この表現型解析法を遺伝学的手法(siRNA/CRISPR)や低分子スクリーニングと組み合わせることで、1回の実験から膨大な量のデータを得ることができる。セルペインティングスクリーンの実行後、画像ベースのプロファイリングを用いて、表現型に基づいて遺伝子や化合物をクラスタリングし、推定される作用機序を予測することができる(2)。残念ながら、セルペインティングのワークフローには、アッセイプレートの準備と自動画像取得という2つのボトルネックが残っている。
アッセイプレートを手作業で準備するのは時間と労力のかかるプロセスで、薬剤処理/トランスフェクションの時間経過にもよるが、数日かかることもある。さらに、細胞の固定/浸透/染色には、96ウェルプレート1枚あたり最大1時間の作業時間が必要となる。これらの障害に対処するため、私たちは、細胞のプレーティング、処理から蛍光染色、画像取得までのセルペインティングワークフローの自動化を追求した。ここでは、このワークフローの有用性と、Biomek i7 ハイブリッドワークステーションおよびImageXpress Confocal HT.ai ハイコンテントイメージングシステムの機能を紹介する。最初の実験では、自動化された方法を用いて、プレートの培養、固定、染色、イメージングが容易に行えることが示された。その後の研究により、低分子(コルヒチン)スクリーニングのワークフローが自動化され、この方法を用いて有意義なセルペインティングデータが得られることが示された。Biomekの自動化とImageXpressイメージングを併用することで、作業時間を短縮し、アッセイのスループットを向上させることができる。
参考文献
- Bray, M. A., Singh, S., Han, H., Davis, C. T., Borgeson, B., Hartland, C., Kost-Alimova, M., Gustafsdottir, S. M., Gibson, C. C., & Carpenter, A. E. (2016). Cell Painting, a high-content image-based assay for morphological profiling using multiplexed fluorescent dyes. Nature Protocols, 11(9), 1757-1774. https://doi.org/10.1038/nprot.2016.105.
- Chandrasekaran, S. N., Ceulemans, H., Boyd, J. D., & Carpenter, A. E. (2021). 創薬のための画像ベースプロファイリング:機械学習によるアップグレードの時期?Nature Reviews Drug Discovery, 20(2), 145-159. https://doi.org/10.1038/s41573-020-00117-w.
- Simm、J., Klambauer、G., Arany、A., Steijaert、M., Wegner、J. K., Gustin、E., Chupakhin、V., Chong、Y. T., Vialard、J、 Buijnsters, P., Velter, I., Vapirev, A., Singh, S., Carpenter, A. E., Wuyts, R., Hochreiter, S., Moreau, Y., & Ceulemans, H. (2018). Repurposing High-Throughput Image Assays Enables Biological Activity Prediction for Drug Discovery. Cell Chemical Biology, 25(5), 611-618.e3. https://doi.org/10.1016/j.chembiol.2018.01.015.
- Gustafsdottir, S. M., Ljosa, V., Sokolnicki, K. L., Anthony Wilson, J., Walpita, D., Kemp, M. M., Petri Seiler, K., Carrel, H. A., Golub, T. R., Schreiber, S. L., Clemons, P. A., Carpenter, A. E., & Shamji, A. F. (2013). 多様な細胞状態を測定するマルチプレックス細胞プロファイリングアッセイ。PloS One, 8(12), e80999. https://doi.org/10.1371/journal.pone.0080999.
- Kamentsky, L., Jones, T. R., Fraser, A., Bray, M. A., Logan, D. J., Madden, K. L., Ljosa, V., Rueden, C., Eliceiri, K. W., & Carpenter, A. E. (2011). CellProfiler:モジュラー型ハイスループット画像解析ソフトウェアの構造、機能、互換性の向上。Bioinformatics (Oxford, England), 27(8), 1179-1180. https://doi.org/10.1093/ bioinformatics/btr095
- Omta WA, van Heesbeen RG, Pagliero RJ, van der Velden LM, Lelieveld D, Nellen M, Kramer M, Yeong M, Saeidi AM, Medema RH, Spruit M, Brinkkemper S, Klumperman J, Egan DA. HC StratoMineR: A Web-Based Tool for the Rapid Analysis of High-Content Datasets.Assay Drug Dev Techno l. 2016 Oct;14(8):439-452. doi: 10.1089/ adt.2016.726. Epub 2016 Sep 16. pmid: 27636821.
材料
| 設備 | メーカー |
|---|---|
| i7 ハイブリッド自動ワークステーション | ベックマン・コールター ライフサイエンス |
| アレグラX-14R遠心機 | |
| ImageXpress Confocal HT.ai ハイコンテントイメージングシステム | Molecular Devices |
***表2.
使用インストゥルメンテーション
| 試薬 | メーカー | 品番 |
|---|---|---|
| DMEM、高グルコース、ピルバテン | ギブコ | 11995065 |
| 抗生物質/抗真菌剤、100X | ギブコ | 15240062 |
| ウシ胎児血清 | ギブコ | 16000044 |
| DPBS | ギブコ | 14190144 |
| トリプシン | ギブコ | 25200072 |
| Opti-MEM I | ギブコ | 31985070 |
| MitoTracker Deep Red | インビトロジェン | M22426 |
| ヘキスト 33342 | インビトロジェン | H3570 |
| Wheat Germ Agglutinin Alexa Fluor 555 Conjugate | インビトロジェン | W32464 |
| コンカナバリンA Alexa Fluor 488 コンジュゲート | インビトロジェン | C11252 |
| ファロイジン Alexa Fluor 568 コンジュゲート | インビトロジェン | A12380 |
| SYTO Green 蛍光核酸染色 | インビトロジェン | S7576 |
| 16% パラホルムアルデヒド | EM Sciences | 50-980-488 |
| コルヒチン | Alfa Aesar | J61072 |
| Lenti-X 293T 細胞株 | Takara | 632180 |
表 3. 使用試薬
| 消耗品 | # | メーカー | 品番 |
|---|---|---|---|
| iシリーズ、230μLピペットチップ、無菌 | 2 | ベックマン・コールター・ライフサイエ ンス | B85906 |
| iシリーズ、1070μLピペットチップ、滅菌済み | 1 | ベックマン・コールター・ライフサイエ ンス | B85945 |
| 96ウェルマイクロプレート | 1 | Beckman Coulter Life Sciences | 609844 |
| 96ウェルハーフエリアハイコンテントイメージャーフィルムボトムマイクロプレート | 2 | Corning | 4680 |
| 384ウェル組織培養プレーティングプレート | 1 | Nunc | 142761 |
表4. ランごとの消耗品
PDF版(英語)