Application Note 生細胞アッセイ開発を強化する
インテリジェントタイムラプスイメージング
- 画像解析には、設計済みのアプリケーション・モジュールまたはユーザーが作成したカスタム・モジュールを使用します。
- 並列画像処理により解析時間を最大40倍短縮
- 蛍光標識および非標識細胞の活性を長時間追跡
PDF版(英語)
はじめに
生細胞の反応を特異性期間にわたってモニターする能力は、アッセイ開発において細胞生物学者にいくつかの重要な利点を提供する。日常的な細胞ベースのスクリーニングでは、タイムコースの結果からエンドツーエンドアッセイを読み取る適切な時期を決定することができる。ハイコンテントタイムラプスイメージャーは、一度に複数の反応のカイネティックを評価したり、細胞の増殖や死滅をモニターしたりするのにも使用できます。
MetaXpress®ハイコンテント画像取得・解析ソフトウェア(バージョン5.1以上)は、タイムラプス画像データの取得と解析を完全に自動化します。時系列画像全体の解析は、MetaXpress® PowerCore™ハイコンテント画像解析ソフトウェアと共有し利用できる、あらかじめ設定されたアプリケーションモジュールまたはユーザーが設計した独自のカスタムモジュールを使用して実行されます。トレンドや異常値は、解析されたプレートのヒートマップ可視化によって即座に特定されます。
以下の実験は、環境制御チャンバーを備えたImageXpress® Microハイコンテントイメージングシステムを使用して実施され、インストゥルメンテーション内で生細胞を長時間維持することができました。場合によっては、このシステムは予定された流体添加や透過光による非蛍光細胞のイメージングも行った。

図A

図B

インテリジェント・タイムラプス-3図C 図1. タイムラプス撮影と解析の簡単なセットアップ Fig. A, Fig. B: MetaXpress®ソフトウェアでのタイムラプス取得は、カイネティクスの高速化のために1つのウェルまたはウェルグループを迅速に取得するように設定することも(Fig. A)、選択したウェルまたはプレート全体を複数日までの長期間にわたって取得するように設定することもできる(Fig.) ユーザー は、タイムポイントの間隔と実験期間を入力してタイムポイント数を自動計算させることも、タイムポイント数だけを入力して間隔と期間を自動計算させることもできます。Fig. C: タイムラプスデータを解析するには、適切な設定を選択し、"Run Analysis "をクリックする。
神経突起伸長を発達しながら測定する
この実験では、抑制処理を行った場合と行わなかった場合のiPSC由来ニューロン(Cellular Dynamics Intl.)を96ウェルプレートにプレーティングし、透過光で18時間イメージングした。MetaXpress®ソフトウェアの神経突起伸長アプリケーションモジュールを用いて、この時間経過で得られた画像を解析した。その結果、タイムラプス画像解析オプションを使用して生成された時間対ウェルデータのビュー(図2)は、ヒートマップフォーマットで時間ポイントごと、ウェルごとのデータの可視化を提供する。予想されたように、未処理のニューロンは一晩の画像取得中に複数の長いアウトグロースを生じたが、スタウロスポリン処理細胞では神経突起伸長が阻害された(図3)。

図2. ヒートマップにより、タイムラプス反応の迅速な評価が可能。18時間にわたる36時点の神経突起伸長の変化を、時間対ウェルのヒートマップで可視化。A05とA06のウェルのニューロンは10μmのスタウロスポリンで処理した。他のすべてのウェルでは、ニューロンは未処理か成長因子のみで処理された。

図3. 非標識細胞において神経突起伸長を経時的に追跡することができる。左:染色していない神経突起の透過光画像と、その結果得られた神経突起伸長画像解析マスク(赤色)。36時間後の未処理コントロール細胞(上)と10μmスタウロスポリン処理細胞(下)では、形態が著しく異なる。右: AcuityXpress High Content Informaticsソフトウェアで解析した結果、各時点(x軸)ごとの各細胞の神経突起の長さの中央値(y軸)を示す。成長阻害剤スタウロスポリンで処理した細胞(下のトレース)と比較すると、未処理の細胞の方が有意なアウトグロースの長さを示す割合が高い(上のトレース)。
細胞増殖に対する処理の効果をリアルタイムで追跡
ライブセル・タイムラプス実験により、がんに関連する細胞増殖の異常な制御について、より有意義な洞察が得られ、その結果、無秩序な細胞分裂を抑制する治療法の開発に役立つ。
未刺激のU2OS GFP発現細胞(Transfluor® Assay)を一晩培養し、10X Plan Fluor対物レンズで30分ごとにイメージングした。細胞は次に、ユーザーが開発したMetaXpress®ソフトウェア用のカスタムモジュールで解析され、最初に細胞質内のGFPを介して細胞を同定し、次に核が占める未染色領域を埋めることにより、ロバスト性の細胞数が得られた。2つのクローンのタイムラプス解析では、開始細胞数と増殖速度が異なっていた(図4)。

図4. 視野が広いため、かなりの数のセルで細胞増殖率を測定。上:一晩培養したGFP発現U2OSセルの時間対ウェルヒートマップデータ。ウェルA04:A06のクローンは、ウェルA07:A08のクローンよりも細胞数が多かった。下: 画像取得時にフラットフィールド(シェーディング)補正を行わなかった場合でも、カスタムモジュールにより正確に細胞が同定された。
複数日にわたる細胞死メカニズムの解析
HeLa細胞をNucView-488(緑)でアポトーシス、Propidium Iodide(赤)でネクローシス、さらにHoechst核染色で染色した。細胞は過酸化物、エトポシドを投与されるか、あるいは無処置のまま放置され、43時間にわたって30分ごとにイメージングされた(図5、上)。画像は、カスタムモジュールのタイムラプス画像解析オプションを使用して解析した。その結果得られたウェル配列ヒートマップは、実験終了時の細胞生存率またはアポトーシスを示している(図5、下)。
総合生存率、初期アポトーシス、後期アポトーシス、ネク ロシスを含むいくつかの測定パラメータのタイムラプスプロファイ ルをAcuityXpress™ソフトウェアで解析し、図6に示した。
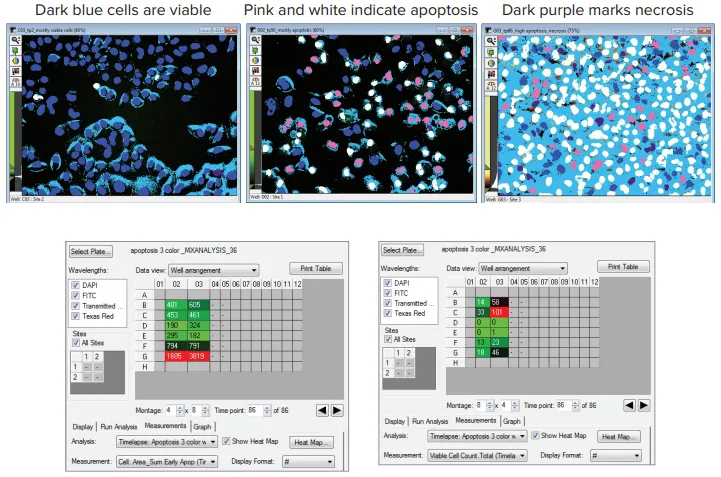
図5. 細胞死結果の視覚的スナップショット。上図:生細胞実験の過程におけるHeLa細胞イメージングでは、処理によって様々な結果が示された。無処置のコントロールセル(左)は、1時間後(時点2)にはほとんど生存核(ロイヤルブルーのマスク)を持っていた。25時間後(時点50)、エトポシド処理したセル(中央)の多くは初期アポトーシス(ピンクのマスク)と後期アポトーシス(白のマスク)にあった。過酸化物処理細胞(右)は、43時間(時点86)において、ほとんどが後期アポトーシス(白マスク)であり、一部ネクローシス(紫マスク)を起こしている。下図: データのヒートマップは、DとEの行のエトポシド処理、またはFとGの行の過酸化物処理と、BとCの行の未処理ウェルとの実験終了時までの細胞反応を即座に可視化する。

図6. 3つの処理についてプロットしたタイムラプスデータ。43時間にわたるコントロール、過酸化物処理(H2O2)およびエトピソド処理(Et)HeLa細胞のタイムラプスプロット。処理によって細胞死のメカニズムが異なることがわかる。
ヒト心筋細胞における拍動数のカウント
培養中の心筋細胞は、本来の心筋細胞と同様に振る舞う拍動する合胞体を形成することができる。細胞の同期収縮に伴って生じるカルシウムレベルのオシレーションは、カルシウム感受性色素を用いてモニターすることができ、治療によるオシレーションパターンの変化をモニターすることができる。
iPSC由来の心筋細胞(Cellular Dynamics Intl.)をFLIPR®Calcium 6 Assay Kit色素を用いてカルシウム変動をモニターし、タイムラプスモードで1秒間に3回、合計100のタイムポイントをイメージングした。カルシウムフラックスを測定するための簡単な閾値を持つ2段階のカスタムモジュールが、データを解析するために書き込まれた。時間対ウェルヒートマップおよび画像サムネイルに表示される明/暗強度パターンは、拍動速度を示している。
結論
制御されたセル環境を必要とする複雑なタイムラプス実験の自動評価は、環境制御チャンバーを備えたImageXpress Microシステムで簡単に実行できる。各時点で生成された個々の画像は、MetaXpress® および AcuityXpress® ソフトウェアを用いて処理・解析し、即座にデータを可視化することができる。さらに、何千もの多波長画像から意味のある数値を極めて迅速に生成する必要がある場合、MetaXpress® PowerCoreソフトウェアは、カスタム設計の解析モジュールを利用した場合でも、解析時間を最大40分の1に短縮することができます。これらのツールにより、多くのライブセル生物学的プロセスを効率的かつ正確に決定することができます。

図7. 心筋細胞の拍動パターンを経時的に可視化する。タイムラプスイメージングを用いた心筋細胞拍動パターンデータの可視化。時間経過反応のプロットは、画像解析後にMetaXpress画像解析ソフトウェアで見ることができる。グラフを表示」(赤丸)をクリックすることで、1ウェルからのプロット(青で表示)を見ることができる。
PDF版(英語)