Application Note ImageXpressマイクロシステムを用いた
ライブセルカイネティクスアッセイ
- 時間経過実験を数時間から数日間モニター
- 毎回まったく同じFOVに戻る
- たった2回のクリックでビデオを作成
PDF版(英語)
はじめに
Molecular DevicesのImageXpress® Micro Confocal/ XLS ワイドフィールド ハイコンテントイメージングシステムには、オプションでフルイディクスモジュールと環境コントロールモジュールが用意されており、迅速なカイネティクス実験や長時間のタイムラプス実験において、化合物の添加や培地交換のためのシングルチャンネルピペッティングが可能です。Fluidicsオプションは、MetaXpress®ハイコンテント画像取得・解析ソフトウェアを搭載しており、各ピペッティングイベントを正確に制御することができます。各システムは、96ウェルおよび384ウェルフォーマットのピペットチップを使用し、3~200 µLの容量を正確に分注します。オプションのヒーティングにより、2枚の化合物プレートまたは培地リザーバーをシステムにロードできます。環境制御モジュールと流体モジュールを備えたImageXpressマイクロシステムにより、研究者は化合物を添加し、生きた細胞の反応を数分から数日間にわたってモニターすることができます。
Transfluor® セルベースGPCRアッセイキットは、ハイコンテントスクリーニング(HCS)において、GFP標識β-アレスチンを用いてGPCRの脱感作とリサイクリングを定量化し、自動画像解析することにより、Gタンパク質共役型受容体(GPCR)の活性化を追跡するために使用される貴重なツールです。Transfluorアッセイは、90以上の異なるGPCRで検証され、広く受け入れられているGPCRスクリーニング法であり、創薬プログラムにおける一次および二次スクリーニング法として使用されている。この方法は、下流のGタンパク質シグナルに依存しない「普遍的な」GPCRの脱感作とリサイクリング経路をモニターするため、ほぼすべてのGPCRの研究に用いることができる。GFPタグ付きß-アレスチン遺伝子を発現するセル株で、目的のGPCRの遺伝子を過剰発現させる必要がある。
各Transfluor Assayは画像解析を利用し、目的のGPCRの活性化に伴うGFPタグ付きβ-アレスチンの内在化を定量します。刺激されていないセルは、細胞質に拡散した ß-アレスチン-GFP蛍光を示す。GPCRが活性化されると、β-アレスチンはレセプターを標的として内在化し、その結果、蛍光を発する小さなクラスリンコートピットが出現する。レセプターがβ-アレスチンに対して高い親和性を持つと、セルはその後、ピットよりも大きく明るい、蛍光を発するエンドサイトーシス小胞を形成する(図1および2)。
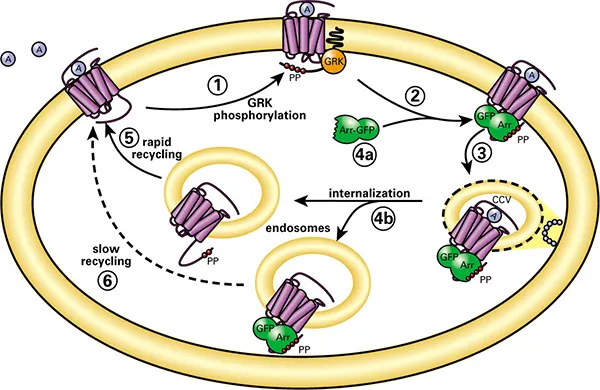
図1. トランスフルオアッセイ技術。GPCRの脱感作と再感作のモデルにおけるアレスチンの役割。(1) アゴニストによって活性化されたGPCRは、GRK(Gタンパク質共役型受容体キナーゼ)によってカルボキシル末端尾部でリン酸化される。(2) アレスチン(Arr)はアゴニストによって占有され、GRKによってリン酸化された細胞膜の受容体に移動し結合する。(3)アレスチンは脱感作されたレセプターをエンドサイトーシスのためにクラスリンでコートされたピットに標的化する。(4a) いくつかのレセプターはアレスチンと低親和性で結合し、細胞膜あるいはその近傍でアレスチンから解離する。(5) これらのレセプターはアレスチンを介さずにエンドサイトーシス小胞に内在化し、速やかに再利用される。(4b) 他のレセプターはアレスチンと高い親和性で結合し、アレスチンと結合したまま、レセプター-アレスチン複合体がユニットとしてエンドサイトーシス小胞に内在化する。(6) これらのレセプターはゆっくりとリサイクルする。
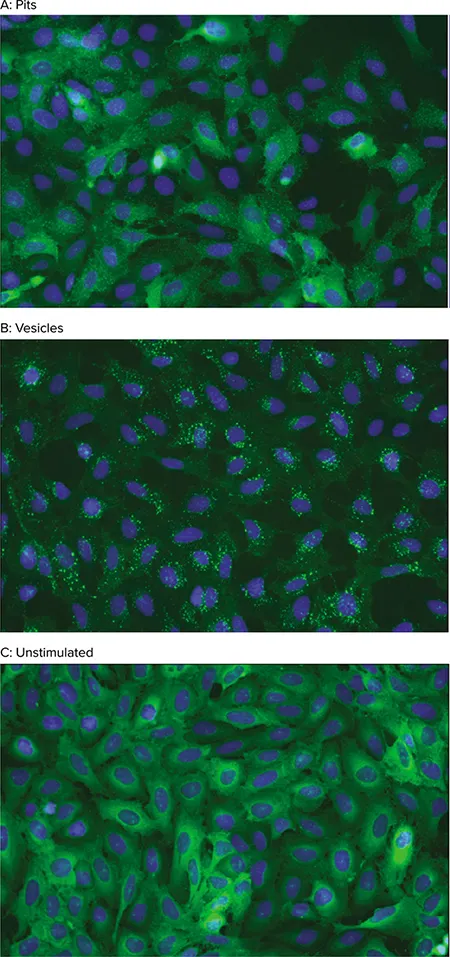
図2. Transfluor Assayの細胞表現型。Transfluor AssayにおけるGPCRの活性化は、ß-アレスチン-GFPを封じ込めたピット(A)または小胞(B)の形成を誘導する。非刺激細胞では、ß-アレスチン-GFPが細胞質に拡散分布している(C)。画像はImageXpress Microシステムを用いて20倍の倍率で取得した。核(青)はHoechst 33342で染色した。
Transfluor Assayは伝統的にエンドポイントアッセイであり、アゴニストモードではアゴニストによる60分間の誘導後に定量される。アンタゴニストモードでは、45分間のアンタゴニスト誘導と、それに続く60分間のアゴニスト誘導の後に測定が行われる。化合物の存在下では、誘導はしばしば数分の時間スケールで起こり、最終的にピットの形成は定常状態に達する。これにより、簡便でロバスト性のあるエンドポイント「固定・染色」アプローチが可能になる。
この実験は、アゴニストとアンタゴニストに対するTransfluorアッセイ反応のカイネティックを示し、エンドポイントアッセイでの画像取得に60分の時点が最適かどうかを決定するためにデザインされた。実験は、ImageXpress Microシステムの環境制御チャンバーとスケジュールされたフルイディクス追加を使用して容易に行われた。
ImageXpressマイクロシステムにフルイディクスモジュールを追加することで、カイネティック実験は、Transfluorアッセイにおける結果としてのピットとベシクルの形成と退行を研究するために使用することができる。MetaXpress®ソフトウェアは、画像取得と得られた画像データの解析の両方を完全に自動化します。Transfluorアプリケーションモジュールは、Transfluorアッセイからの画像を解析するために特異的に設計され、最適化されました。現在、Transfluorモジュールを使用したカスタムジャーナルは、カイネティックTransfluorアッセイデータを解析するために使用されています。
材料
Transfluor アッセイの実施には、Molecular Devices 社からのライセンスが必要です。Transfluor アッセイ試薬は、Transfluor アッセイのライセンシーがモレキュラーデバイスから入手できます。詳細はMolecular Devices社にお問い合わせください。
注意:すべての溶液は、各実験の直前に新しく調製してください。
- ß-arrestin-GFP および ß-2 アドレナリン受容体(ß2AR)発現 U2OS 細胞(Molecular Devices社製)
- 96ウェルマイクロプレート、ポリ-D-リジンコート、クリアボトム、黒色ポリスチレン (Corning Cat.#3667) 細胞アッセイプレートに使用。
- 96ウェルクリアマイクロプレート、丸底ポリプロピレン、滅菌済み (Corning Cat. #3359)。ソース/化合物プレートに使用。
- U2OS培地: MEM(Gibco Cat.#11095)に10%熱不活性化FBS(Gibco Cat.#10082)、10 µg/mLゲンタマイシン(Gibco Cat.#15710)、10 mM HEPES(GibcoCat.#11344)、0.4 mg/mL Zeocin(GibcoCat.#R250)、および0.4 mg/mL G418(GibcoCat.#10131)を加えたもの。
- 飢餓培地: 血清、フェノールレッド、抗生物質を含まないMEM(Gibco Cat. #51200) with 10 mM HEPES
- アスコルビン酸培地: 1mg/mLのアスコルビン酸(L-アスコルビン酸ナトリウム、Sigma Cat.#A7631)
- イソプロテレノール原液 細胞培養グレードのDMSO(Sigma Cat. #D2650)中の(-)-イソプロテレノール(+)-酒石酸塩(Sigma Cat. #I2760)の5 mMストック溶液
- プロパノール原液: (s)-(-)-プロパノール塩酸塩(Sigma Cat. P8688)の細胞培養グレードDMSO(Sigma Cat. #D2650)中5mMストック溶液
- 塩化カルシウムおよび塩化マグネシウムを含まないDPBS(Sigma Cat. #D8537)
- 4%メタノールフリーホルムアルデヒド:16%メタノールフリーホルムアルデヒド(Polysciences Cat. #18814-20)塩化カルシウムと塩化マグネシウムを含むDPBSで希釈(Gibco Cat. #14040)
- Hoechst 33342、10mg/mL(Invitrogen Cat. #H3570)
測定方法
アッセイプロトコル
ステップ1. ポリ-D-リジンコートした96ウェルマイクロプレートにU2OS培地100μLを入れ、35,000セル/ウェルでプレーティングする。37℃、5% CO2で一晩インキュベートする。

ステップ 2. ImageXpressマイクロシステムの電源を入れ、オプション制御ボックスでコンパウンドプレートとサンプルプレートの温度を37℃に設定する。5%CO2/95%エアータンクからのCO2供給を確認する。システムを少なくとも1時間平衡化させる。
ステップ3. 培地を吸引し、Hoechst 33342の1:300,000希釈液を封じ込めた75µLのStarvation培地で置換する。遮光し、37℃、5% CO2で20分間インキュベートする。インキュベーション中にインストゥルメンテーションパラメーターを設定する(下記の「ImageXpress Micro Assay Setup」のセクションを参照)。
ステップ 4. Hoechst染色液を吸引し、75 µLの新鮮なStarvation培地と交換する。
ステップ 5. 環境コントロール(EC)ガスケットを用いてプレートをImageXpress Microシステムにセットする。
ステップ6. t=1分から62分間、1分間隔で各ウェルを画像化する。
ステップ 7. ImageXpressマイクロシステムを用いて、化合物プレート1から75µLのアゴニストまたはコントロールをt=2(イメージング後)に添加するイベントを新たに追加する。混合ステップの後にピペットチップを交換し、1回混合する。
a) ウエル A01-A03:コントロール、飢餓培地のみ(FBSなし)
b) B01-B03ウェル:アスコルビン酸培地中の2X イソプロテレノール(最終濃度100 nM)
c) ウエルC01-C03:アスコルビン酸培地中の2X イソプロテレノール(最終濃度100 nM)
ImageXpressマイクロシステムアッセイセットアップ
20 分間の血清飢餓および核染色インキュベーション期間中に、インストゥルメンテーションパラメー タを設定する。ImageXpress Micro システムには、Environmental Control and Fluidics オプションがインストールされている必要があります。
ステップ 1. Devices / Environmental Control を選択して環境コントロールチャンバーの現在のステータスを表示し、環境チャンバーが安定していることを確認します。
- 化合物およびサンプルプレートの温度が37℃であることを確認します。
- CO2圧力が適切なレベルであれば、OKの表示が出ます。
- 湿度チャンバー内に十分な液体がある場合、液面レベルはOKを示します。
ステップ2. Plate Acquisition Setup/ Fluidicsタブで、Configure Stationsを選択し、System Propertiesを選択して以下のパラメーターを定義します。
- ドローとディスペンス速度: 5 µL/秒
- ドロー後のエアギャップ: 2 µL
- ドロー前エアギャップ: 10 µL
- ウェット分注: オン
- スマートディスペンス オフ
- ドローオーバーフィル:0 µL
- ポンプ整定時間:100 ms
Configure Stationsダイアログで選択します:
- 追跡ボリューム オン
- 液面を追跡する: オン
- 化合物プレートの追跡のための初期容量: 150 µL
- Plate Acquisition Setup/ FluidicsタブのScheduled Eventsにある:
- イメージ2の後、化合物添加、75µL、化合物プレート1、選択した全ウェル、1Xミックス、交換毎に新しいチップ
- イメージ32の後、洗浄、75µL、化合物プレート2、選択した全ウェル、チップ交換あり、3回交換
ステップ3. 化合物プレート1と2の準備:(MetaXpress®ソフトウェアがマイクロプレートウェルの1対1のプレーティングを行う)
- 化合物プレート1:アスコルビン酸培地(最終濃度100 nM)中の2X 200 nM イソプロテレノール150 µLをウェルB01-C03に分注し、Costar 3904マイクロプレートのスターベーション培地150uLをウェルA01-A03に分注する。
- 化合物プレート2:コスター3904マイクロプレートのスターベーション培地中1Xプロパノロール275μLをウェルB01-B03に、10%FBS添加スターベーション培地をウェルA01-A03およびC01-C03に分注する。
画像取得
MetaXpress®ソフトウェアを用い、DAPIおよびFITCフィルターセットと20X Plan Fluor ELWD (NA = 0.45)対物レンズを用い、カメラゲインを1に設定して2x2ビンの画像を取得する。ここに記載した結果は、ウェルごとの単一部位の取得から得られたものである。
画像のレビュー
MetaXpress® ソフトウェアで、Screening メニューの Review Plate Data ダイアログボックスから実験をロードし、 Select Plate を選択して特異性プレートに移動する。実験がロードされると、選択したウェルがモンタージュ上に表示されます(図 3A)。ウェルの一つをクリックすると、完全解像度の画像が表示されます(図 3B)。画像は単一波長またはカラー合成として見ることができます(以下の3つの図に示す)。
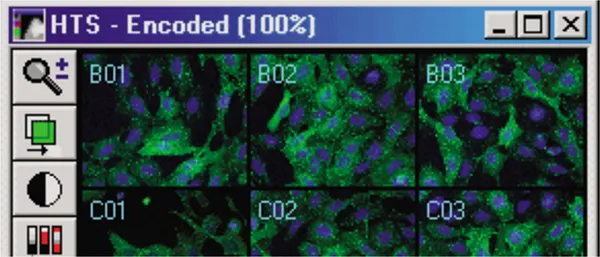
図3A. Transfluor Assay実験画像モンタージュ。
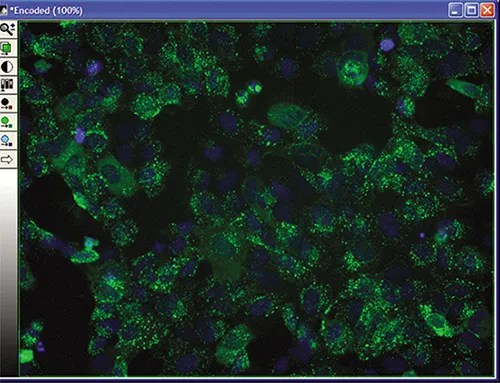
図3B. 選択された坑井データ。
個々の画像を表示するには、Review Plate DataダイアログボックスでTimepointを変更するか、表示をTime vs. Well(カイネティック実験に推奨)に変更する。個々のウェルを右クリックして選択し、Load Imagesをクリックしてすべてのタイムポイントをスタックにロードし、ムービーとして表示およびエクスポートすることができます(図3C)。
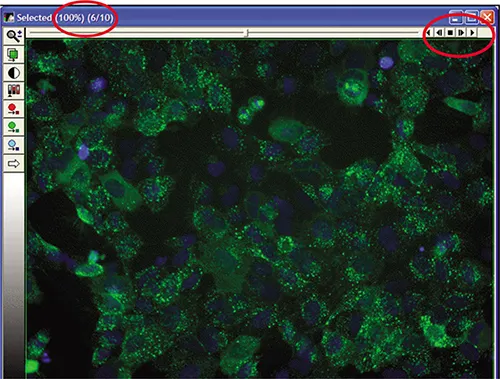
図3C. タイムポイントデータのスタック。
画像解析
Kinetic data can be analyzed with the Kinetic Transfluor Analysis journals. Visit the Knowledge Base section of the Molecular Devices website and follow the detailed instructions to download, install and run the kinetic analysis journal.
アッセイ条件が変更された場合、ジャーナルの解析パラメーターを再最適化する必要がある場合があります。正しい Transfluor アッセイ設定を決定するには、知識ベースサイトの Article 19736 の指示を使用してください。
結果
ß-arrestin-GFP を発現し、野生型 ß2AR(ピット形成型)または 亢進型 ß2AR(小胞形成型)を発現する U2OS セルを、アッセイ培地 のみ、またはイソプロテレノール(アゴニスト)+プロプラノ ロール(アンタゴニスト)、またはイソプロテレノール+プロプラノ ロール(アンタゴニスト)、またはイソプロテレノール+プロプラノ ロール(アンタゴニスト)+プロプラノロール(アンタゴニスト) で処理した。亢進型β2ARはC末端が修飾されているため、β-アレスチンとの親和性が高く、蛍光小胞形成が可能である。
画像は、Materials and Methodsに記載されているように、Environmental ControlおよびFluidicsオプションを装備したImageXpress Microシステムで取得し、カスタムKinetic Transfluor Analysisジャーナルで解析した。
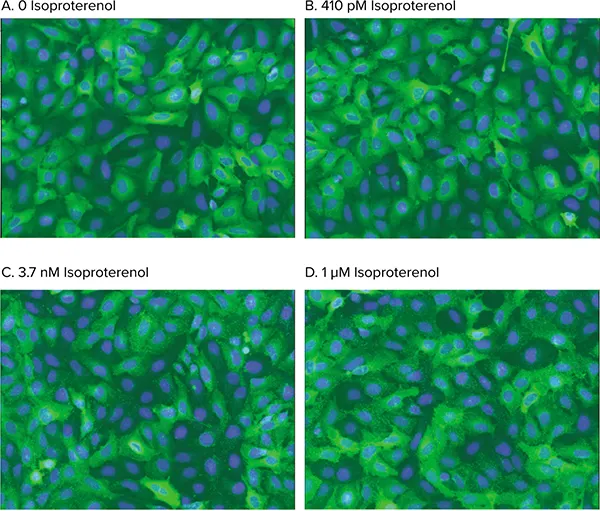
図4. ピット形成のアゴニスト刺激。WTß2AR の活性化に伴う用量依存的 ß-arrestin-GFP 転移の解析画像。セルは 0 (A), 410 pM (B), 3.7 nM (C), または 1 µM (D) イソプロテレノールで処理した。Transfluor Assay Application Moduleにより、アゴニスト刺激によるピット形成が正確に同定された。
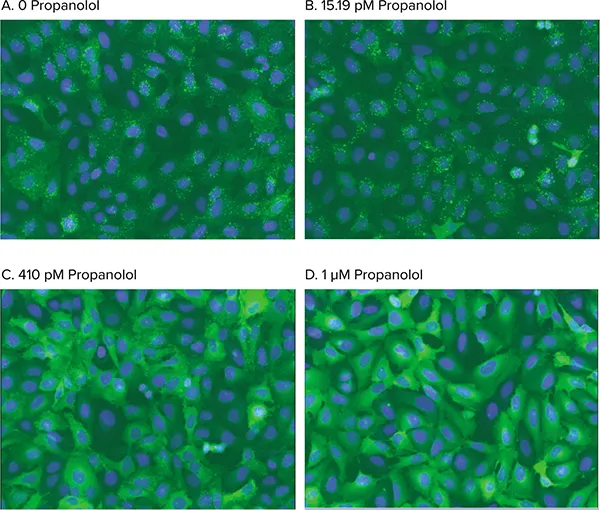
図5. 小胞形成のアゴニスト刺激。尾部修飾 ß2AR の刺激によるアレス チン-GFP 転移の用量依存的阻害の分析像。セルを 0 (A), 15.19 pM (B), 410 pM (C), または 1 µM (D) プロパノールで処理し、50 nM イソプロテレノールで刺激した。Transfluor Assay Application Moduleは、アンタゴニスト阻害によってブロックされた小胞形成を正確に同定した。
用量反応および用量阻害分析
ピット形成細胞株と小胞形成細胞株の両方において、アゴニストであるイソプロテレノールとアンタゴニストであるプロプラノロールの時間依存性応答を、MetaXpress®ソフトウェア内のTransfluorアッセイアプリケーションモジュールに基づくカスタムジャーナルを用いて測定した。各用量は、4回の反復実験にわたって1つのウェルで実行された。
AcuityXpress™ ソフトウェアを使用し、ヒルカーブフィット処理により、細胞あたりのピットまたは小胞面積に基づいてEC50値とIC50値を決定し、時間経過の各タイムポイントについてプロットした。
表示されたデータは1回のタイムコース実験のものです。β2AR 増強型セルは、ベース、アゴニストとアンタゴニストの併用、 アゴニストのみの 3 条件で処理した。β2AR野生型細胞は、ベーサルとアゴニストのみの2条件で処理した。
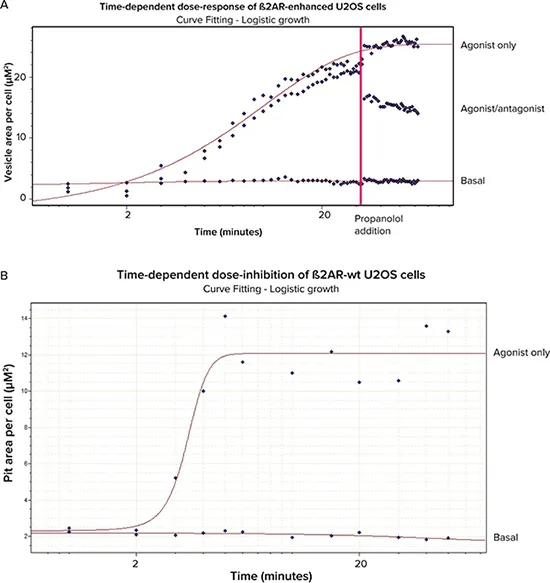
図6. 用量反応曲線と用量阻害曲線。A. ベース、アゴニスト/アンタゴニスト処理、アゴニストのみの β2AR増強セル。) B. β2AR野生型細胞(ベースおよびアゴニストのみ)。
結論
環境制御およびカイネティクスオプションモジュールを搭載したImageXpressマイクロシステムは、カイネティックTransfluorアッセイを成功裏に実施した。MetaXpress®ソフトウェアのカイネティック解析ジャーナルは、Transfluor Assayで活性化されたGPCRへのß-arrestin-GFPトランスロケーションによって形成された細胞を明確に同定し、ピットとベシクルを測定した。AcuityXpressソフトウェアで解析したデータを表示したグラフは、60分のエンドポイント測定を行った場合、反応が安定し、よく分離していることを示している。これらの結果は、Transfluor アッセイと組み合わせた環境制御およびフルイディクスモジュールを装備した ImageXpress Micro システムが、GPCR モジュレーターのスクリーニングにおいてカイネティクス実験を行うロバストなツールであることを示している。小胞形成反応のタイムラプスムービーをご覧になりたい方は、弊社ウェブサイトをご覧ください。
参考文献
- Oakley, R.H., Hudson, C.C., Cruickshank, R.D., Meyers, D.M., Payne, R.E. Jr., Rhem, S.M., Loomis, C.R. The cellular distribution of fluorescently labeled arrestins provides a robust, sensitive, and universal assay for screening G-protein-coupled receptors. Assay Drug Devel Tech 2003; 1:21-30.
- Oakley、R.H.、Laporte、S.A.、Holt、J.A.、Barak、L.S.、Caron、M.G. クラスリンを介したエンドサイトーシスにおけるβ-アレスチンとGタンパク質共役型レセプターとの会合は、レセプターの再感作のプロフィールを規定する。J Biol Chem 1999; 274:32248-32257.
- Catalano、S.; de Bruin、S.; Bosworth、J.; Gliksman、N.; Best、K.; Rickert、P. MetaXpress、AcuityXpressおよびTransfluorアッセイシステムを用いたGPCR活性化のハイコンテントスクリーニング。Molecular Devicesアプリケーションノート。
ImageXpress®マイクロコンフォーカルハイコンテントイメージングシステムについてさらに詳しく>>
PDF版(英語)