Application Note SpectraMax i3x マルチモードマイクロプレートリーダーでの
発光細胞生存能および細胞毒性アッセイ
- ウェルあたり10セルまでの高感度発光検出
- 最適なシグナル検出のためのマイクロプレートおよびリードハイト最適化ウィザード
- 結果の迅速な解析のための設定済みソフトウェアプロトコル
PDF版(英語)
はじめに
Molecular Devices SpectraMax® i3x MultiModeマイクロプレートリーダーを細胞生存率および細胞毒性用の発光アッセイと組み合わせることで、培養中の生存細胞数を高感度かつ迅速に測定し、実験処理による細胞毒性効果を定量化することができます。プロメガ社のCellTiter-Gloアッセイは、光を発生させるためにATPを必要とするルシフェラーゼ酵素を使用する。このアッセイで生成される発光シグナルは、培養物中のATP量に依存し、その量は生存細胞数に依存する。BioVision社のBioluminescence細胞毒性アッセイキットは、アデニル酸キナーゼ(AK)の測定に基づいています。アデニル酸キナーゼは、すべての細胞に存在するユビキタスタンパク質で、細胞膜の完全性が失われると培地中に放出されます。AKはADPをATPに変換し、発光反応によって検出されます。
材料
- CellTiter-Glo 発光細胞生存能アッセイ (Promega P/N G7570)
- 生物発光細胞毒性アッセイキット(BioVision P/N K312-500)
- HeLa細胞(ATCC P/N CCL-2)
- 黒色/透明96ウェル組織培養プレート(Corning P/N 3904)
- ソリッド白色96ウェル組織培養プレート(Corning P/N 3917)
- ソリッド白色384ウェル組織培養プレート(Greiner P/N 781080)
- SpectraMax i3x マルチモードマイクロプレートリーダー
方法
試薬の調製
CellTiter-Glo Buffer と基質は使用前に解凍し、室温に平衡化した。CellTiter-Glo Buffer のボトルの内容物を CellTiter-Glo Substrate の入った琥珀色のボトルに移し、キットの技術情報誌の指示に従い、穏やかに転倒混和した。
Bioluminescent Cytotoxicity Assay Kit の場合、AK 検出試薬のバイアルを 1.1 mL の AK Assay Buffer で再構成し、穏やかに混合した後、室温で 15 分間平衡化させた。このAKストック試薬をアッセイバッファーで10倍に希釈し、AK検出試薬ワーキング溶液とした。
細胞数と発光シグナルとのシグナリング
HeLa細胞を、10%ウシ胎児血清ペニシリン/ストレプトマイシン添加MEM中で培養した。セルをトリプシン処理し、培地に懸濁し、カウントした。96ウェルアッセイフォーマットでは、1ウェル当たり50,000細胞から10細胞までの連続希釈液を、1ウェル当たり100μLの細胞懸濁液でプレーティングした。384ウェルフォーマットでは、1ウェル当たり12,500から6細胞までの連続細胞希釈液を、1ウェル当たり25µLでプレーティングした。バックグラウン ド発光値を得るために、細胞を含まない培地を封じ込めたコン トロールウェルを用意した。
細胞標準曲線用の正確な細胞数を確保するため、細胞は直ちにアッセイした。100μL(96ウェルアッセイ)または25μL(384ウェルアッセイ)のCellTiter-Glo試薬を各ウェルに添加した。プレートをプレートシェーカーで 2 分間穏やかに混合した後、室温で 10 分間インキュベートし、発光を安定化させた。
ATP標準曲線
ATPの1:10希釈系列をソリッド白色96ウェルプレートと384ウェルプレートに10uMから1nMまでの濃度でセットアップし、細胞を封じ込めなかったブランクウェルも加えた。ATPの測定にはCellTiter-Gloアッセイを用いた。最良の結果を得るために、マイクロプレートの最適化とリードハイトの最適化を行った。
細胞生存率および細胞毒性アッセイ
HeLa細胞を96ウェル組織培養処理白色または透明底マイクロプレートに1ウェル当たり15,000個播種し、一晩接着増殖させた。翌日、細胞にスタウロスポリンとアニソマイシンを添加してアポトーシスを誘導した。化合物は1:2希釈系列として、最高濃度50μMから始めて24nMまで添加した。化合物で24時間処理した後、細胞をCellTiter-GloおよびBioVision細胞毒性キットでアッセイした。
細胞生存率アッセイでは、100μLのCellTiter-Glo試薬を、処理細胞を封じ込めたソリッド白色プレートの各ウェルに添加した。細胞溶解のため、試薬添加後約 10 分後にプレートを読み取った。
BioVision 細胞毒性キットの場合、各処理ウェルから培地 100 µL を除去し、ソリッド白色プレートに移した。各ウェルにAK試薬作業溶液100µLを添加し、30分以内にプレートを読み取った。
インストゥルメンテーションとサンプル分析
SpectraMax i3x リーダーの設定は、表 1 に示すように行った。
平均RLUおよび標準偏差の計算、細胞希釈系列およびATP標準曲線のグラフ化、IC50曲線生成のための4パラメータカーブフィッティングは、SoftMax® Proソフトウェアを用いて行った。CellTiterGlo アッセイ用の設定済みプロトコールは、ソフトウェアのプロトコールライブラリに含まれている。
| パラメータ | 選択された設定 |
|---|---|
| 光学構成 | モノクロメーター |
| 読み取りモード | LUM |
| 読み取りタイプ | エンドポイント測定 |
| 波長 | 全波長 |
| プレーティングタイプ(各アッセイフォーマット特異性 | 96ウェルCostar clear 384ウェルグライナークリア |
| PMTと光学系 積分時間:1000ms |
読み取り高さ: 5.86~8.09mm(アッセイにより異なる) |
| その他の設定 | 読み取り前最適化オプションの表示 |
*SoftMax ProソフトウェアのMicroplate Optimization Wizardを使用して、384ウェルマイクロプレートプレートの定義を最適化した。
**Read Height Optimization Wizardを使用して、各アッセイに最適なシグナルを検出できるようにリードハイトを最適化した。
表1. 発光測定用のインストゥルメンテーション。
結果
SpectraMax i3xリーダーは、96ウェルおよび384ウェルアッセイフォーマットの両方で、ウェルあたりわずか10個のセルを検出することができた。したがって、標準的な比色分析法およびほとんどの蛍光分析法の検出限界以下の細胞数で測定することができる。CellTiter-Gloアッセイは、使用した細胞濃度の全範囲にわたって直線的で、r2 > 0.99と3桁以上の桁にまたがっていた(図1)。
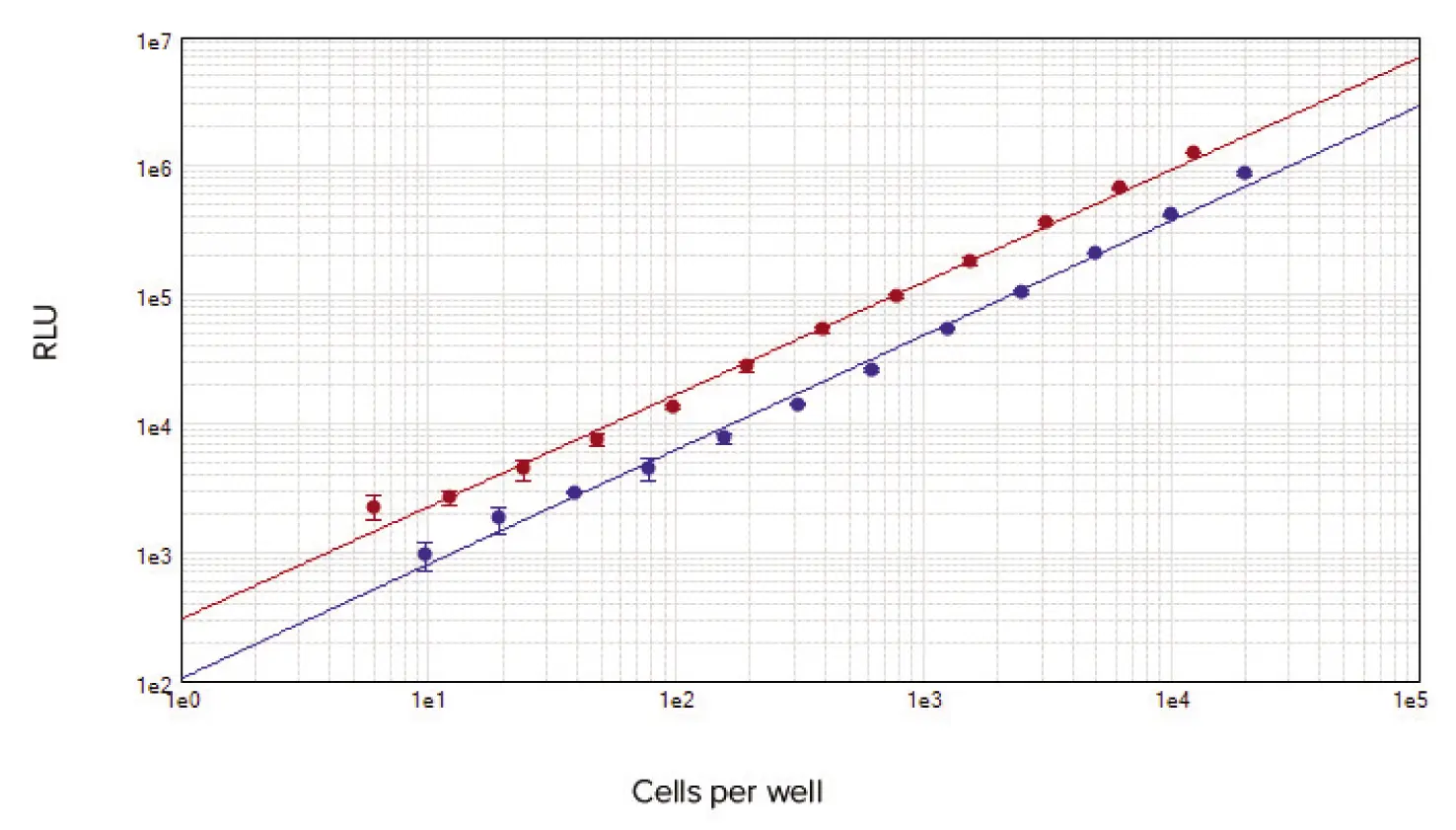
図 1. 96ウェル(青丸)および384ウェル(赤丸)アッセイフォーマットのセル標準曲線を示す。各フォーマットにおいて、ウェルあたり少なくとも10個以下のセル数を検出することができる。いずれの標準曲線でも、r2 > 0.99。
ATP標準曲線は、アッセイ性能の検証や細胞内ATP含量の算出に使用できます。ここでは、1 nMから10 uMまでのATP標準物質の発光シグナルは、今回アッセイした細胞数で観察された発光出力の全範囲をカバーしていた(図2)。測定値は少なくとも40年間にわたって直線的であった。
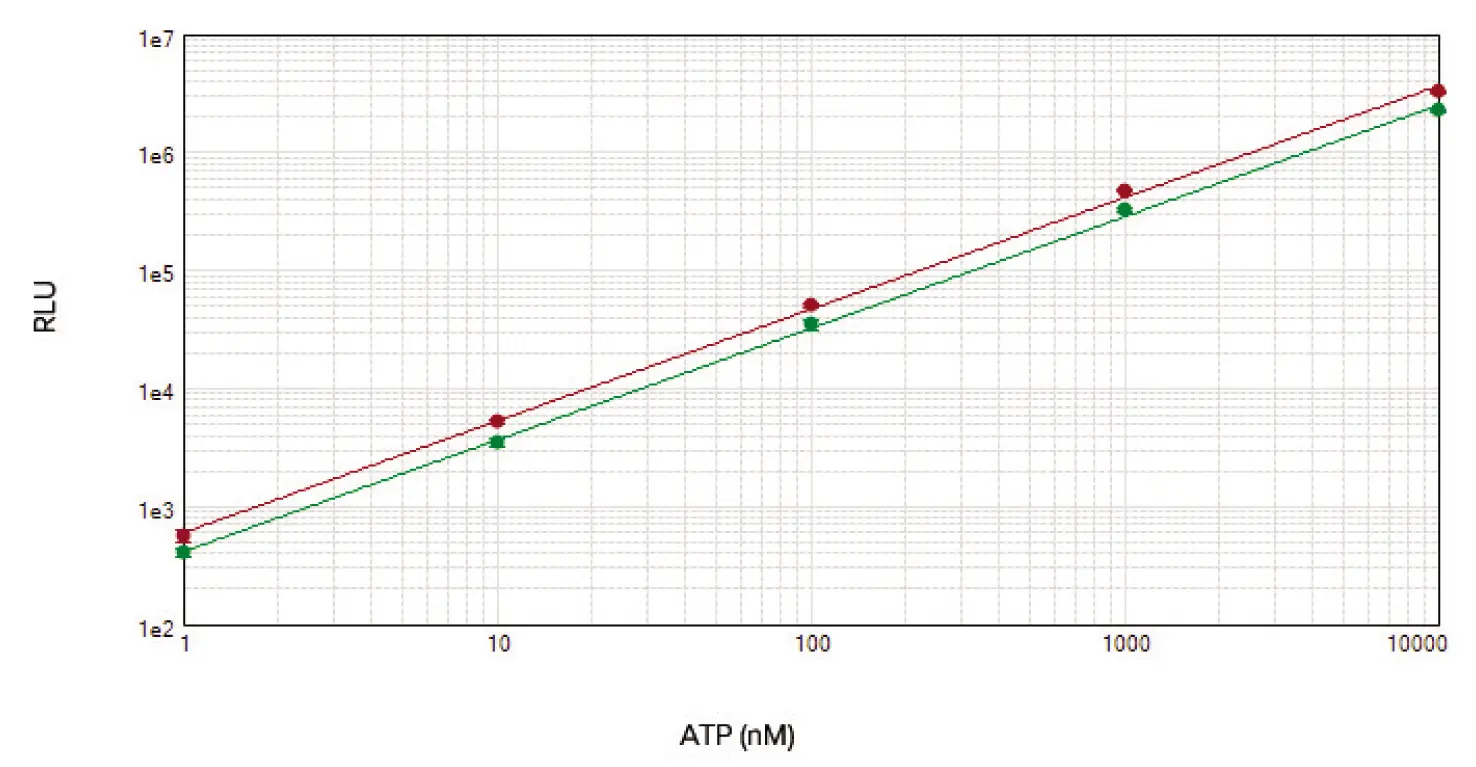
図2. 96ウェル(赤丸)および384ウェル(緑丸)アッセイフォーマットのATP標準曲線を示す。両標準曲線とも、r2 = 0.999。
化合物スタウロスポリンとアニソマイシンで処理したセルについて、ATPレベルを測定することにより細胞生存率をアッセイし(図3)、アデニル酸キナーゼ酵素をアッセイすることにより細胞毒性をアッセイした(図4)。どちらのアッセイでも、スタウロスポリン(それぞれ0.34 µMと0.15 µM)およびアニソマイシン(3.30 µMと2.28 µM)については同様のIC50値が得られた。
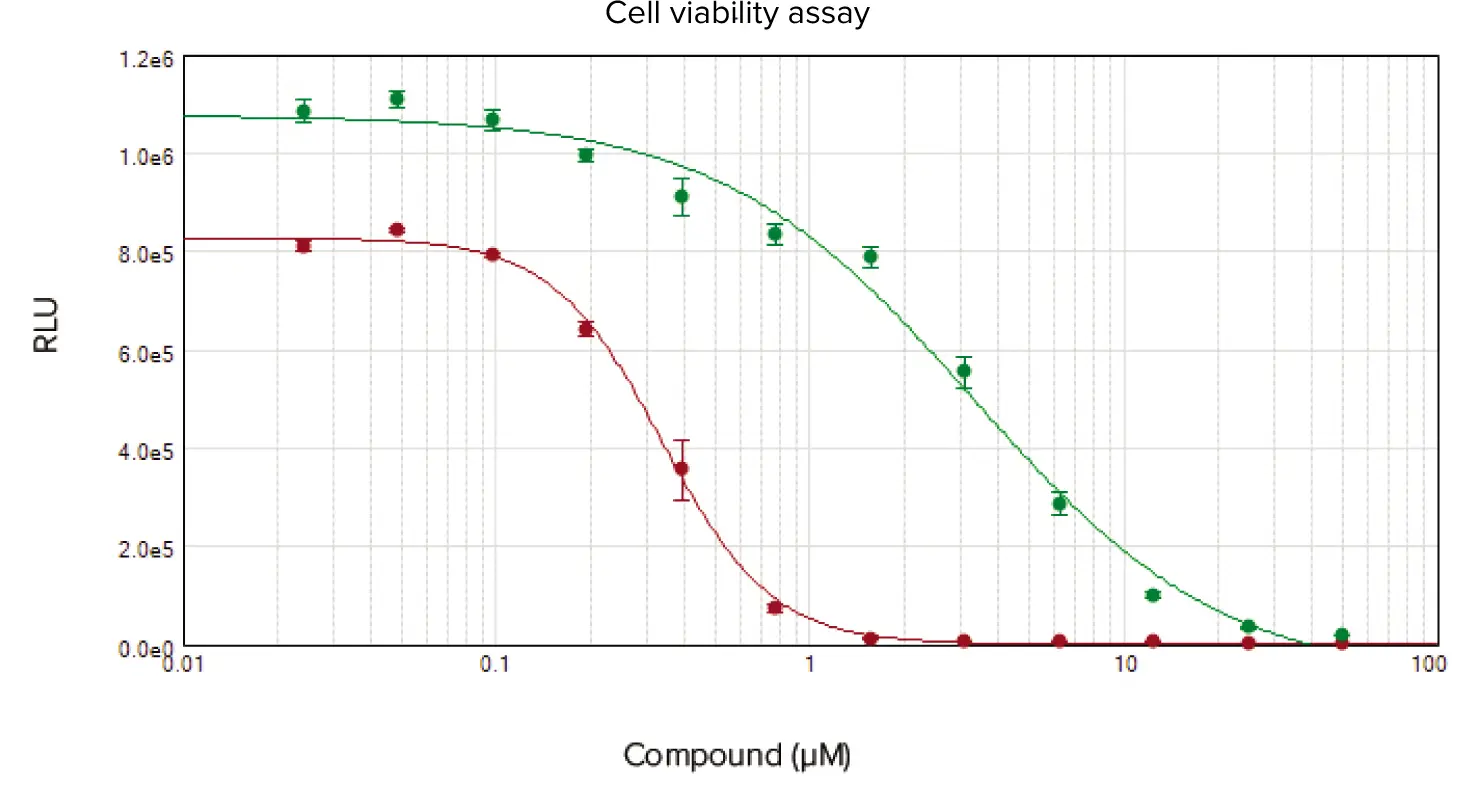
図3. スタウロスポリン(赤丸)とアニソマイシン(緑丸)で24時間処理したHeLa細胞の濃度反応曲線。スタウロスポリンのIC50値は0.34 µMであったのに対し、アニソマイシンは3.30 µMであった。
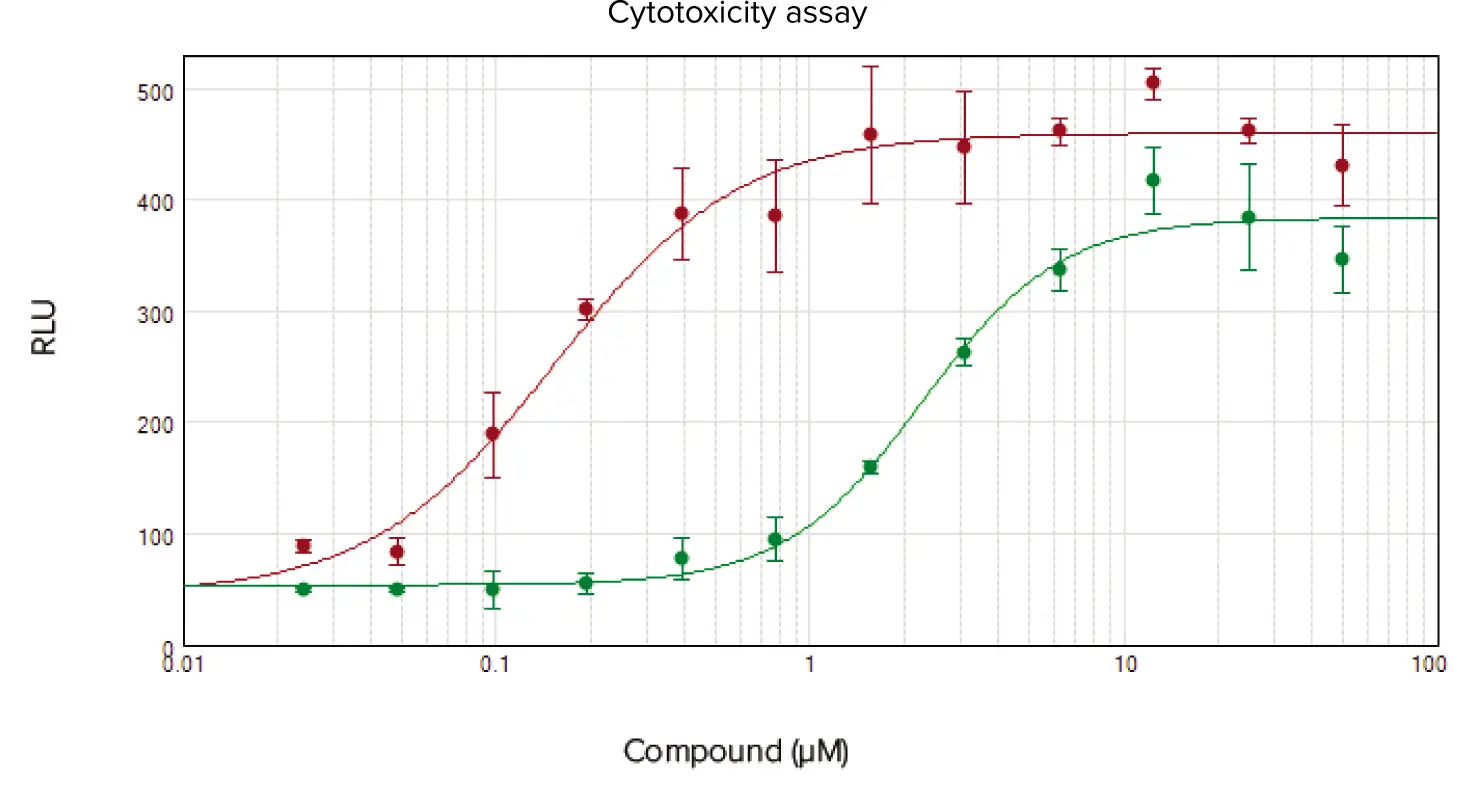
図4. スタウロスポリン(赤丸)とアニソマイシン(緑丸)で24時間処理したHeLa細胞の濃度反応曲線。細胞はBioVision細胞毒性アッセイキットを用いてアデニル酸キナーゼ活性をアッセイした。スタウロスポリンのIC50値は0.15μMであったのに対し、アニソマイシンは2.28μMであった。
結論
SpectraMax i3xリーダーは、ATPベースの細胞生存率およびアデニル酸キナーゼベースの細胞毒性アッセイ用の発光アッセイにおいて優れた感度を提供し、ウェルあたりわずか10個の細胞を検出することができる。4パラメータカーブフィット処理とIC50値の算出は、すべてSoftMax® Proソフトウェア内で行われます。マイクロプレートとリードハイトの最適化ウィザードは、最適なシグナル検出を保証し、ソフトウェアによって自動化される。
発光アッセイに加えて、SpectraMax i3x リーダーは、CellTiter-Glo および BioVision 細胞毒性アッセイと、追加の検出モードを必要とする他のアッセイとのマルチプレックス要件を提供する。このマルチモードリーダーは、特許取得済みの Spectral Fusion™ 照明による吸光度検出と蛍光強度検出を提供し、シグナル強度を最大化しながら波長の柔軟性を実現する。
時間分解蛍光検出やウェスタンブロット検出を含むユーザー交換可能なカートリッジや、オプションのSpectraMax® MiniMax™ 300イメージングサイトメーターモジュールを追加することで、リーダーの検出機能が拡張され、他のリーダーをはるかに上回るアプリケーションオプションが可能になります。すべてのインストゥルメンテーションは、SoftMax Proソフトウェアを使用して操作します。SoftMax Proソフトウェアには、CellTiter-Gloをはじめとする120以上のアッセイ用の設定済みプロトコルが含まれており、データの収集と解析を容易にします。
SpectraMax i3x Multi-Mode Detection Platformについてさらに詳しく >>
PDF版(英語)