Application Note 3Dハイコンテント画像および解析による毒性影響のin vitro評価のための
アッセイモデルとしての肺オルガノイド
- 3Dイメージング、再構成、解析を用いて肺オルガノイドの成長と分化をモニターし可視化する。
- 各オルガノイド内の個々の細胞の特性評価と測定
- レーザー光源で画質を犠牲にすることなく、画像をより速く取得
PDF版(英語)
はじめに
オクサナ・シレンコ博士|シニアリサーチサイエンティスト|モレキュラーデバイス
アンジェリン・リム博士|アプリケーションサイエンティスト|モレキュラー・デバイス
メアリー・カシノス|細胞培養技術者|モレキュラー・デバイス
生物製剤の研究やスクリーニングにおいて、実組織の複雑性を再現するオルガノイドモデルの人気が高まっている。生体内のヒト肺をモデル化するために、我々は初代ヒト肺上皮細胞を、気道の形態的・機能的特徴を再現する3次元構造の形成を促進する条件下で培養した。肺オルガノイド培養では、上皮幹細胞および前駆細胞を、混合成長因子を添加したECM中で培養した。その後、オルガノイドは自己組織化し、多系統の上皮細胞のクラスタリングを保持する複雑な構造になった。このような特殊な特徴を持つオルガノイド培養は、創薬スクリーニングや疾患モデリングなど、基礎的・応用的アプローチの両方において、幅広い応用が期待できるシステムである。
我々は、肺オルガノイドの増殖と分化をモニターするハイコンテントイメージャー法について述べる。3D再構成により、オルガノイド構造をさらに複雑に解析することができた。オルガノイド内では、細胞の形態、生存率、様々な細胞マーカーの発現も測定できる。3D肺オルガノイドはマトリゲルドームに埋め込まれた。発育中のオルガノイドは、空洞や小胞構造を含む複雑な形態を持つ球状の対物レンズで構成されていた。8週間の発生期間中、サイズと複雑さの増大がモニターされた。オルガノイドは透過光でモニターされ、その後染色され、マトリゲルを10倍から40倍の倍率で20-30Z平面を使って画像化された。ImageXpress® Confocal HT.aiハイコンテントイメージングシステムの新構成にレーザー光源を使用することで、照明パワーが飛躍的に向上し、明るさ、アッセイ感度、イメージング速度が大幅に向上した。
方法
細胞:3D肺オルガノイド
3D肺オルガノイドは初代ヒト肺上皮細胞(ScienCells, Co.) 細胞はScienCells社のプロトコールに従って2Dで2週間培養した。その後、Stem Cell Technologies社のプロトコール(PneumaCult™ Airway Organoid Kit)に従った試薬を用いて、細胞を90%マトリゲル(Corning社製)でマトリゲルドームに播種した。細胞は3Dオルガノイドを形成し、PneumaCult気道オルガノイド播種培地を用いて2週間2日おきに栄養を与え、PneumaCult気道オルガノイド分化培地を用いてさらに6週間分化させた。オルガノイドはさまざまなプレートフォーマットで増殖させ(結果のセクションを参照)、化合物で処理したり、さまざまなマーカーで染色したりして、形態と生存率を評価した。オルガノイドの成長と発育は、4倍または10倍の倍率で1週間ごとに透過光でモニターした。以下にワークフローの概略を示す:
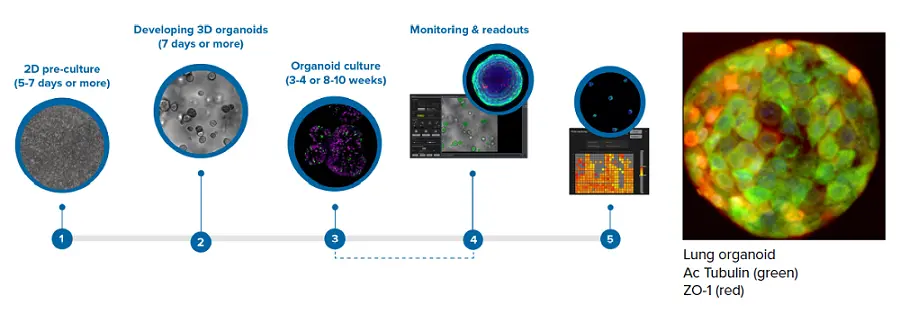
結果
3D肺オルガノイドの培養とイメージング
初代肺上皮細胞から培養を開始し、Stem Cell Technologies社の試薬とプロトコールを用いて、マトリゲルドーム内でオルガノイドを増殖させた(Methodsのセクションを参照)。
簡単に述べると、細胞を2Dで展開し、GFで還元したマトリゲルと混合し、24ウェルプレートまたは他のプレートフォーマットのマトリゲルドームにプレーティングした。
- 2D展開
- マトリゲルドーム3D
- 分化
- 実験テキスト
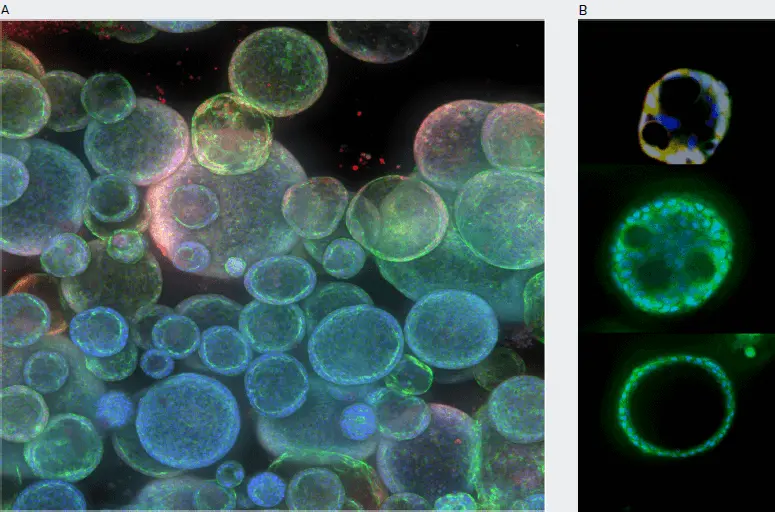
図1. 共焦点イメージングを用いてオルガノイド構造の複雑さをモニター。生きたオルガノイドをヘキスト核色素、ミトトラッカー、カルセインAMで染色した。共焦点画像は5-10μm間隔で、10倍または20倍で撮影した。A. 最大プロジェクション画像。B. シングルZ共焦点画像。管腔、空洞、突起の観察と測定が可能で、より成熟した表現型の出現と一致する。
オルガノイド成長のモニタリングと3D画像解析
オルガノイドの成長と発生は、透過光イメージングまたはヘキスト染色を用いてモニターした。マトリゲル中の生きたオルガノイドの自動撮像は、共焦点オプション、4倍または10倍の倍率で行った。単一Z平面または3Dプロジェクション画像の画像解析を行い、オルガノイドのおおよその数とサイズを決定した。培養6-8週間にわたり、時間依存的なサイズの増大が観察された。
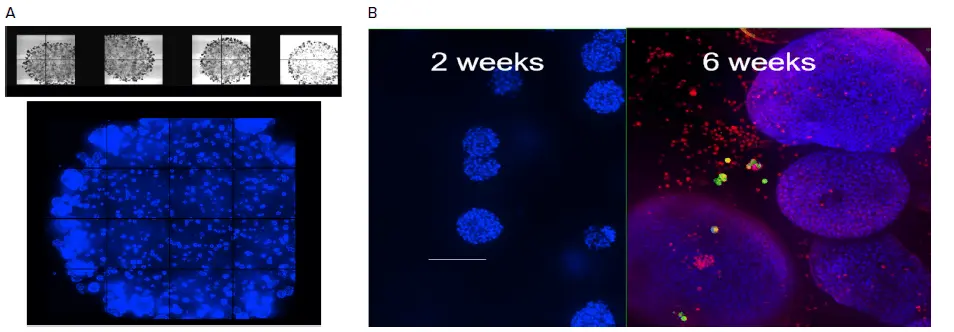
図2. 培養4週目のマトリゲルドーム内のオルガノイド、TL画像(4X)またはヘキスト色素による染色(10X)。オルガノイドの平均直径は時間とともに増大した。B. オルガノイドの大きさの比較、ヘキスト(青)で染色した2週間のサンプル、ヘキストとミトトラッカーオレンジ(赤)で染色した6週間のサンプル。オルガノイドは共焦点オプションを用い、10μm間隔で23枚の画像をZ-スタック取得した。最大プロジェクション画像。
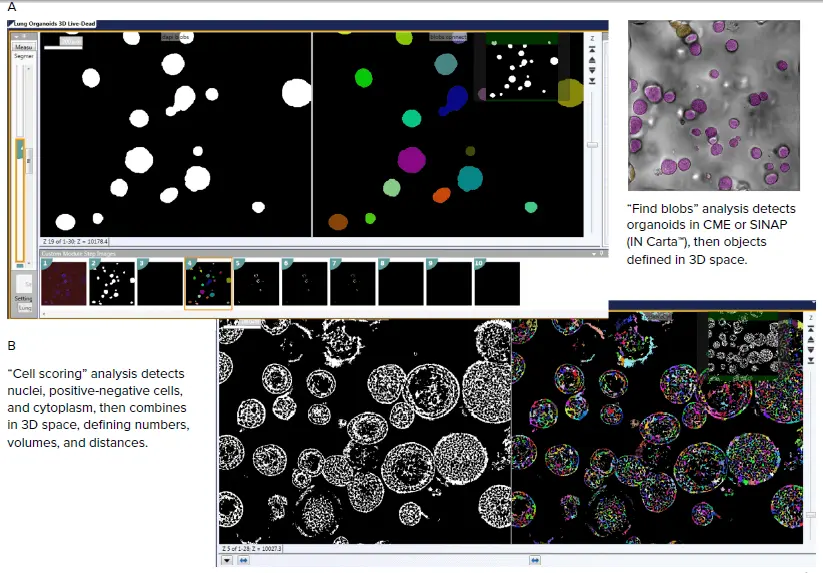
図3. 3D画像解析を用いてオルガノイド構造の複雑さを再現した画像解析。カスタムモジュールエディターを使用して、オルガノイド(A)、セルまたはサブ細胞構造(B)を検出、カウント、特性評価できる。解析は各Z平面で行われ、ソフトウェアが情報を組み合わせて3D空間での測定値を与える。
表現型の変化と複合効果の測定
オルガノイドは疾患モデリングや複合効果の評価に非常に有用なツールである。オルガノイドにおける表現型の変化を定量的に評価するためには、オルガノイドのイメージングと解析を自動化することが重要であり、実験や試験のスループットを向上させる。プロジェクション画像の2D解析は、ハイスループットなアッセイに利用できる。下の例は、コントロールのオルガノイドと炎症性サイトカインや細胞毒性物質で処理したオルガノイドのLive-Dead解析である。
共焦点イメージングと3D画像解析は、複雑な3D生物学のアッセイを捉えるのに特に有用である。3Dオルガノイドは中空で、内部に内腔や空洞があり、光が透過しやすいため、マトリゲルに埋め込まれた複数の微小組織を「透過してイメージング」することができる。白血病の治療に使われるイブルチニブなどの抗がん剤の中には、肺毒性作用を引き起こすものがあることが示されている。我々は、3D肺オルガノイドを用いて抗癌剤イブルチニブの毒性試験を行った。
興味深いことに、イブルチニブのEC50〜3μMで有意な細胞毒性が観察されたが、同じ細胞を2次元培養した場合には100μM濃度でのみ毒性作用が観察された。この結果は、選択された薬剤の細胞毒性作用に対する3Dモデルの感度がより高いことを示している可能性があり、化合物の効果を評価するためには、より複雑なモデルを用いることの重要性を強調している。
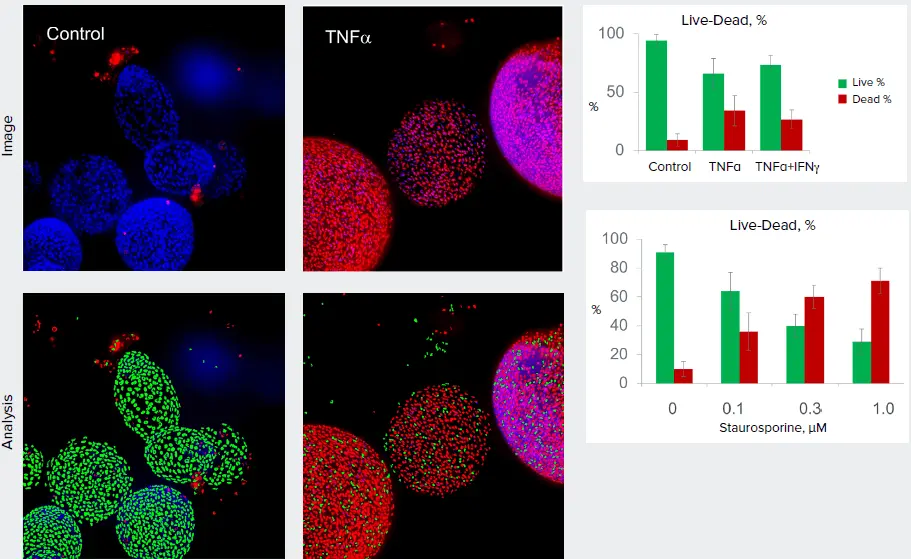
図4. オルガノイドを5 nMのTNFαで3日間処理した。オルガノイドをHoechst(青、核染色)とEtHD(赤、死細胞の染色)で染色し、10倍拡大、最大投影で画像化した。画像は2Dで解析し、生細胞と死細胞の数をカウントした。
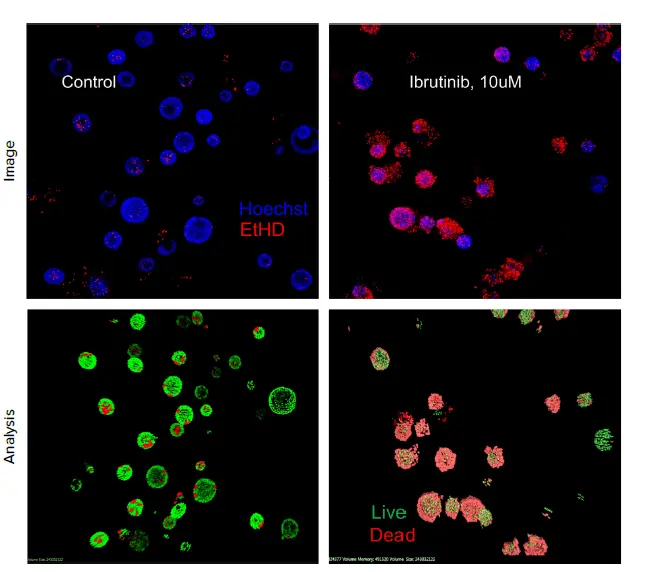
図5. オルガノイドを6週間発生させた後、異なる濃度のイブルチニブで72時間処理した。その後、死細胞を検出するためにEtHD-1でオルガノイドを染色し、ImageXpress® Confocal HT.aiシステムを用いてイメージングした。EtHD-1陽性細胞(死細胞)と陰性細胞(生細胞)の数は、3D解析を用いてカウントした。
結論
- Stem Cell Technologyのプロトコルを用いて、3D肺オルガノイドの形成と開発に成功した。オルガノイドの発生と成長は、オルガノイドのサイズ、体積、複雑さを評価できる自動イメージングによってマトリゲル中でモニターされた。
- 3D解析と組み合わせた共焦点イメージングにより、オルガノイド内の異なる表現型を持つ細胞のカウントと測定(細胞数、生死判定、特異性マーカーによる細胞スコアリングなど)だけでなく、細胞内容の定量的な特徴付けが可能になった。
- このモデルは、医薬品やその他の化合物の毒性評価に用いることができる。
PDF版(英語)