Application Note AquaMax 2000/4000マイクロプレートウォッシャーと
細胞洗浄用ヘッドによる細胞洗浄性能の最大化
- 角度のついた注入ピンで、細胞をやさしく洗浄
- 洗浄後の細胞残存率95%以上
- 手作業による細胞洗浄に比べ、アッセイ性能が向上
PDF版(英語)
はじめに
カルシウム流動アッセイや細胞ベースアッセイを含む多くの細胞 ベースのアプリケーションでは、細胞の損失を最小にし、細胞生存能と最 適なアッセイ性能を保証するために、マイクロプレート内の細 胞を穏やかに、しかし徹底的に洗浄する必要がある。吸引や分注速度、吸引高さなどの重要な洗浄パラメーターは、使用する特異性細胞に合わせて洗浄条件をカスタマイズできるように調整可能でなければなりません。細胞単層に直接分注すると接着力の弱い細胞が破壊される傾向があり、吸引中に失われるため、マイクロプレートウェルへの液供給の角度も重要である。効果的な細胞洗浄の基準には以下が含まれる:
- 洗浄後の細胞残存率が高い。
- 良好な洗浄効率(不要物の除去)
- アッセイにおける洗浄細胞の最適なパフォーマンス
Molecular DevicesのAquaMax® 2000/4000マイクロプレートウォッシャー用の細胞洗浄用ヘッドは、角度のついた注入ピンを使用して、細胞の攪乱を最小限に抑えながら洗浄液を分注します。分注速度と吸引高さを調節することで、接着力の弱い細胞でも洗浄液の乱れを最小限に抑えることができます。AquaMaxマイクロプレートウォッシャーと細胞洗浄用ヘッドによる洗浄後、標準的な非コーティング組織培養マイクロプレート表面上の接着力の弱いHEK293細胞の優れた残存率と生存率を実証しています。細胞洗浄用ヘッドで高い洗浄効率が得られ、FlexStation® 3マルチモードマイクロプレートリーダーで行う蛍光カルシウム流動アッセイで、洗浄したCHO-M1細胞の優れた反応が可能になります。
材料
細胞残存率試験
- AquaMax 4000マイクロプレートウォッシャー(Molecular Devices社製 Cat.)
- 96ウェル細胞洗浄用ヘッド(Molecular Devices社製 Cat.)
- 384ウェル細胞洗浄用ヘッド(Molecular Devices社製 Cat.)
- HEK293セル
- HEK293細胞用培地: MEM + 10% FBS + 1% pen/strep
- 黒壁透明底96ウェル(Corning Cat.#3904)および384ウェル(Corning Cat.#3912)組織培養マイクロプレート
- カルセインAM(Invitrogen Cat.)
- カルシウムおよびマグネシウムを含む1Xダルベッコ酸緩衝生理食塩水(PBS)
- ImageXpress® Velos™レーザースキャニングサイトメーター(Molecular Devices社製)
洗浄効率
- 黒色96ウェルマイクロプレート(Greiner Cat.)
- フルオレセインナトリウム塩(Sigma-Aldrich Cat.)
カルシウム流動アッセイ
- CHO-M1細胞: M1ムスカリン受容体を安定的にトランスフェクトしたCHO細胞。
- CHO-M1細胞の増殖培地: ハムF12+10%FBS+pen/strep+50μg/mL G418
- カルシウムアッセイ用洗浄バッファー HBSS/20mM HEPES/2.5mM probenecid (Sigma Cat. #8761)
- Fluo-4 AM(Invitrogen Cat.)
- 塩化アセチルコリン(Sigma Cat.)
- カルバコール(Sigma Cat.)
- FlexStation 3 マルチモードマイクロプレートリーダー(Molecular Devices社製 Cat.)
測定方法
細胞残存率の測定
HEK293細胞を96ウェルおよび384ウェルの非コーティングマイクロプレートに1ウェル当たり10,000個、または1ウェル当たり5,000個プレーティングした。最終濃度が0.5 µMになるようにウェルにカルセインAMを添加し、細胞を37℃で30分間インキュベートした。過剰のカルセインAM色素は、試験洗浄の前に穏やかな予備洗浄で除去した(表1)。試験洗浄は、表2に概説した洗浄プログラムを用いて行った。比較のため、96 ウェル細胞洗浄用ヘッドとストレート注入ピンを用いて、いくつかのセルを同等の設定で洗浄した。洗浄前と洗浄後のプレートをImageXpress® Velos™レーザースキャニングサイトメーターでスキャンし、マイクロプレートの各ウェルで細胞が覆っている面積を測定した。ImageXpress Velosはマイクロプレート全体をスキャンするため、全ウェルの完全なデータが得られた。
| ステップ | アクション | 96セル洗浄用ヘッド 設定 | 384セル洗浄用ヘッド |
|---|---|---|---|
| 1 | 吸引 |
レート = 5 下降速度 = 高速 滞留時間 = 2.0 秒 プローブ高さ = 5.0 mm |
レート = 5 下降速度 = 高速 滞留時間 = 0秒 プローブ高さ = 5.0 mm |
| 2 | 調剤 |
レート = 1 容量 = 200 µL |
レート = 5 容量 = 80 µL |
| 3 | 吸引 | (ステップ1と同じ) | (ステップ1と同じ) |
| 4 | リピート | ステップ2から1回 | ステップ2から1回 |
表1. 細胞残存率テストのための予備洗浄設定。
| ステップ | アクション | 96セル洗浄用ヘッド 設定 | 384セル洗浄用ヘッド |
|---|---|---|---|
| 1 | 吸引 |
レート = 5 下降速度 = 高速 滞留時間 = 2.0 秒 プローブ高さ = 3.0 mm |
レート = 5 下降速度 = 高速 滞留時間 = 0秒 プローブ高さ = 3.0 mm |
| 2 | 調剤 |
レート = 1または2 容量 = 300 µL |
レート = 5 容量 = 80 µL |
| 3 | 吸引 | (ステップ1と同じ) | (ステップ1と同じ) |
| 4 | リピート | ステップ2から2時間 | ステップ2から2時間 |
表2. 細胞残存率テストのための洗浄設定。
洗浄効率
洗浄効率を調べるため、細胞培養液中の 1 µM フルオレセインを黒色 96 ウェルマイクロプレートにウェル当たり 100 µL 添加した。マイクロプレートをSpectraMax® M5 Multimodeマイクロプレートリーダーで読み取り、初期蛍光レベルを測定した。その後、96ウェル細胞洗浄用ヘッドを用いてマイクロプレートをPBSで洗浄した。1回の洗浄は、4回または6回の吸引-吐出サイクルで構成され、上記表2に概説したのと同じ吐出および吸引設定を行った。接着の弱い細胞に適した吸引高さ3.0 mmを選択した。洗浄後、マイクロプレートをSpectraMax M5 Multimodeマイクロプレートリーダーで再度読み取り、洗浄後の蛍光レベルを測定した。
洗浄後の蛍光値を洗浄前の値と比較し、洗浄効率を決定した。
カルシウム流動アッセイ
96ウェルおよび384ウェル細胞洗浄用ヘッドで洗浄した細胞の 性能を評価するため、蛍光カルシウム色素Fluo-4を用いてカ ルシウム流動アッセイを行った。アッセイ前日に、CHO-M1細胞をウェル当たり50,000個(96ウェル)または12,500個(384ウェル)の密度でプレーティングした。セルに2μM Fluo-4を1時間負荷した。96ウェルおよび384ウェルの細胞洗浄用ヘッド付きAquaMax 4000マイクロプレートウォッシャーを用いて、細胞をカルシウム洗浄バッファーで3回洗浄した。洗浄プログラ ムは、プログラムされた一連の吸引と分注ステップで構成された(表3)。比較のため、96ウェルプレートのセルを手動で洗浄した。注:384ウェルフォーマットで手動洗浄を試みたが、非常に面倒であったため、そのデータは示していない。
| ステップ | アクション | 96セル洗浄用ヘッド 設定 | 384セル洗浄用ヘッド |
|---|---|---|---|
| 1 | 吸引 |
レート = 5 下降速度 = 高速 滞留時間 = 2.0秒 プローブ高 = 1.0, 2.0, または 3.0 mm |
レート = 5 下降速度 = 高速 滞留時間 = 0秒 プローブ高さ = 2.0 mm |
| 2 | 調剤 |
レート = 1または2 容量 = 300 µL |
レート = 5 容量 = 80 µL |
| 3 | 吸引 | (ステップ1と同じ) | (ステップ1と同じ) |
| 4 | リピート | ステップ2から1回 | ステップ2から1回 |
| 5 | 調剤 |
レート = 1または2 ボリューム = 300 |
レート = 5
体積 = 80 |
| 6 | 吸引 | レート = 5
下降速度 = 高速 滞留時間 = 2.0 秒 プローブ高さ = 4.5 mm |
レート = 5
下降速度 = 高速 滞留時間 = 0 秒 プローブ高さ = 4.5 mm |
表3. カルシウム流動アッセイ*の洗浄設定。*注:吸引高さを4.5mmにプレーティングした場合、96ウェルプレートでは各ウェルに100μL、384ウェルプレートでは25μLの残液が残った。
カルシウムフラックスはFlexStation 3 Microplate ReaderでFlex(カイネティック高速測定)リードタイプを使用して測定した。二つの異なるアゴニスト、アセチルコリンとカル バコールがテストされた。アセチルコリン濃度は15 pMから300 nm、カルバコール濃度は0.5 nMから10 μMの範囲でセルを刺激した。FlexStation 3システムの統合型ピペッターを用いてアゴニストをアッセイウェルに供給し、1.6秒(96ウェルフォーマット)または2.5秒(384ウェルフォーマット)間隔で90秒間蛍光測定を行った。各ウェルのカイネティック測定値について、最大RFU値から最小蛍光値(RFU)を差し引き、グラフ化用の縮小データ値を得た。すべてのデータは、SoftMax® Proソフトウェアを用いて取得、解析、グラフ化された。
結果
細胞残存率
AquaMax 4000マイクロプレートウォッシャーと96ウェル細胞洗浄用ヘッドを使用し、上記の洗浄条件でHEK293細胞を洗浄したところ、洗浄後にマイクロプレートウェル内に保持された細胞の割合は95%を超えました。これは、同じインストゥルメンテーション設定と96ウェル・マイクロプレート洗浄用ヘッド(ストレート注入ピン付き)を用いて洗浄した細胞の平均残存率が約44%であったのとは対照的であった(図1)。384ウェル細胞洗浄用ヘッドでも、説明した洗浄条件で同様に95%を超える細胞残存率を達成した(図2)。
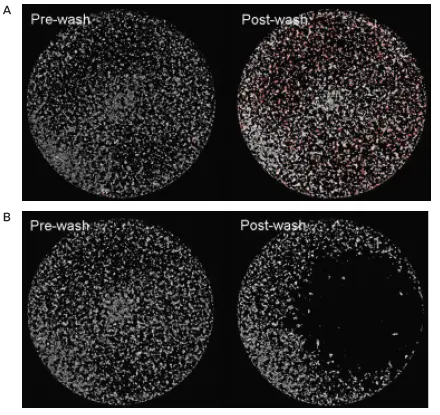
図1. 洗浄したHEK293細胞の96細胞洗浄用ヘッドによる残存率。(A)96ウェル細胞洗浄用ヘッドで洗浄したHEK293細胞の細胞残存率95%以上、(B)96ウェルマイクロプレート洗浄用ヘッドで洗浄したHEK293細胞の細胞残存率44%のイメージング。いずれの場合も、左右の画像は洗浄前後の全く同じウェルのものである。(画像上の赤色部分は、蛍光シグナルレベルが最大値の50%であることを示す)。
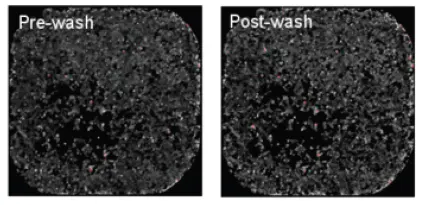
図2. 洗浄したHEK293細胞の384細胞洗浄用ヘッド残存率。384ウェル細胞洗浄用ヘッドで洗浄したHEK293細胞の細胞残存率95%以上のイメージング。左と右の画像は、洗浄前と洗浄後の全く同じウェルのものである。(画像上の赤色部分は、蛍光シグナルレベルが最大値の50%であることを示す)。
洗浄した細胞の残存率に重要な影響を与えたその他のインストゥルメンテーション設定は、吸引高さと分注速度であった。吸引高さ(液体吸引時のマイクロプレートウェル底面からの吸引ピンの高さ)は、細胞残存率に大きな影響を与えた。最小吸引高さ3.0 mmは、それ以下の吸引高さよりも細胞残存率が高く、HEK293のような接着の緩い細胞に推奨される(表4)。96ウェル細胞洗浄用ヘッドを用いた以前の研究では、分注速度1または2が最も高い細胞残存率を示した(データは示さず)。分注速度1または2を用いて洗浄したセルのデータから、2つの分注速度間の結果にほとんど差がないことが示された(表4)。
| 複製 | 吸引高さ 2 mm | 吸引高さ 2.5 mm | 吸引高さ 3.0 mm | |
|---|---|---|---|---|
| 分注速度 1 | 分注速度 2 | |||
| プレーティング1 | 87.6 | 94.5 | 96.2 | 98.0 |
| プレーティング2 | 80.6 | 98.5 | 98.6 | 100 |
| プレーティング3 | 88.7 | 96.2 | 95.7 | 97.1 |
表 4. 96ウェル細胞洗浄用ヘッドを用いた、吸引高さと分注速度の異なるHEK293細胞の細胞残存率値。
384ウェル細胞洗浄用ヘッドでは、分注速度および吸引速度は、プレート全体に均一に分注および吸引するために最大値または最大値に近い値に設定する必要があります。したがって、この洗浄ヘッドでは、分注速度や吸引速度を低速または中速にすることは決して推奨されません。ピンの角度により、分注速度が速くても、吸引-分注を複数回繰り返してもセル層が乱れることはありません。吸引の滞留時間を0秒に設定することも、最適な細胞残存率に不可欠であった。滞留時間を0秒から1秒にわずかに増加させただけでも、ウェルからセルが著しく吸引された(表5)。
| 複製 | 滞留時間(秒) | 細胞残存率 |
|---|---|---|
| プレーティング1 | 1.0 | 89.5 |
| プレーティング2 | 0 | 95.7 |
| プレーティング3 | 0 | 95.7 |
表 5. 384ウェル細胞洗浄用ヘッドを用いた、吸引滞留時間の異なるHEK293細胞の細胞残存率値。
洗浄効率
ウェルあたり 100 µL の 1 µM フルオレセインを封じ込めたマイクロプレートを、PBS で 4 回または 6 回の吸引-ディスペンス サイクルを通して洗浄すると、ウェルから蛍光の 99%以上が除去された(表 6)。洗浄後に検出された平均RFUは、アスピレート-ディスペンス サイクルの回数を4回から6回に増やすと、約3倍に減少した。PBSのみを封じ込めたウェルの平均バックグラウンドは約0.3RFUであった。
| 吸引ディスペンスサイクル数 |
洗浄前の平均蛍光 (RFU) |
洗浄後の平均RFU | 洗浄により除去された蛍光 |
|---|---|---|---|
| 4 | 1958.5 | 6.9 | 99.6 |
| 4 | 2108.2 | 6.5 | 99.7 |
| 6 | 2214.9 | 1.9 | 99.9 |
| 6 | 2028.3 | 2.2 |
99.9 |
***表 6. 96ウェル細胞洗浄用ヘッド*の洗浄効率値。**注:蛍光はSpectraMax M5マルチモードプレートリーダーを用いて検出した。吸引および分注ステップの設定は、表2に概説したものと同じであった。
カルシウム流動アッセイ
96ウェルおよび384ウェル細胞洗浄用ヘッドを用いて洗浄した細胞の性能を評価するために、Fluo-4蛍光カルシウム色素を用いてカルシウム流動アッセイを行った。Fluo-4では、バックグラウンド蛍光を最小限に抑えるため、アッセイを行う前に余分な色素を洗い流す必要がある。
AquaMax 4000マイクロプレートウォッシャーと96ウェルおよび384ウェルの細胞洗浄用ヘッドで洗浄したCHO-M1細胞は、テストしたアゴニストに対して優れたアッセイ結果を示し、アッセイのEC80値において広いダイナミックレンジと良好なZ'ファクターを示した(図3~5)。マルチチャンネルピペッターで手動洗浄したセ ルと比較して、AquaMaxプレートウォッシャーで洗浄したセルは、カ ルシウムアッセイウィンドウが大きかった(図3および4)。
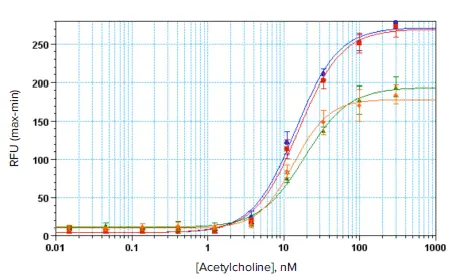
図3. 96ウェルアッセイフォーマットにおけるCHO-M1細胞のアセチルコリン濃度応答曲線。青と赤のプロットは、細胞洗浄用ヘッド付きマイクロプレートウォッシャーAquaMaxを用いて細胞を洗浄した2つの別々のアッセイを示す。緑とオレンジのプロットは、マルチチャンネルピペッターを用いて手動で洗浄した細胞を用いた2つの別々のアッセイを表す。AquaMaxで洗浄したアッセイのEC80におけるZ'ファクターは0.87と0.82、EC50値は14.2と15.4 nMであった。手動で洗浄したアッセイのEC80におけるZ'ファクターは0.83と0.59で、EC50値は18.7と13.5 nMであった。
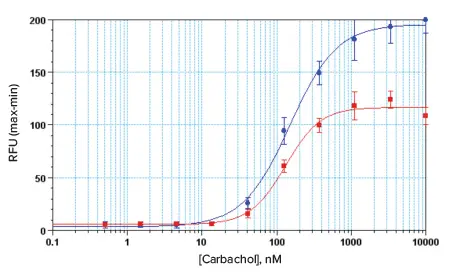
図4. 96ウェルアッセイフォーマットにおけるCHO-M1細胞のカルバコール濃度応答曲線。青のプロットはAquaMaxマイクロプレートウォッシャーと細胞洗浄用ヘッドで洗浄した細胞を表し、赤のプロットは手動で洗浄した細胞を表す。AquaMaxで洗浄したアッセイのEC80におけるZ'ファクターは0.73で、EC50値は148 nMであった。手動で洗浄したアッセイのEC80におけるZ'ファクターは0.75で、EC50値は129 nMであった。
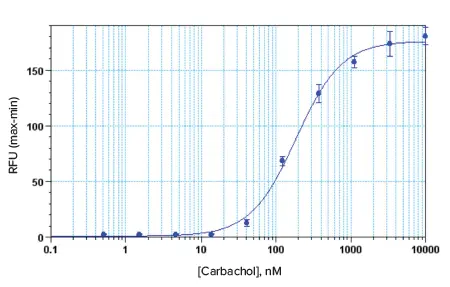
図5. 384ウェルアッセイフォーマットにおけるCHO-M1細胞のカルバコール濃度応答曲線。EC80におけるZ'ファクターは0.79で、EC50値は185 nMであった。
結論
ここで示されたデータは、AquaMax 2000/4000 マイクロプレートウォッシャー用の新しい96ウェルおよび384ウェルの細胞洗浄用ヘッドが、細胞の損失を最小限に抑えながら効率的に細胞を洗浄し、最適なアッセイ性能を実現できることを示しています。弱接着細胞に適した洗浄条件を使用した場合でも、ウェルからの蛍光物質の99%以上の除去が観察された(96ウェル細胞洗浄用ヘッドのデータを示す)。通常の組織培養用マイクロプレートにプレーティングしたHEK293細胞は、96ウェルおよび384ウェルの細胞洗浄用ヘッドで洗浄条件を最適化した場合、95%以上保持された。最後に、細胞洗浄用ヘッドで洗浄したセルで実施したFluo-4カルシウムアッセイでは、洗浄方法にかかわらず同様のEC50値で、手動の細胞洗浄で得られたものと同等以上のZ'因子が得られた。
細胞洗浄用ヘッドの角度のついた注入ピンにより、マイクロプレートウェルの側面に洗浄液が供給されるため、アッセイシグナルやウェル間のばらつきを減少させる可能性のある細胞の吹き出しを避けることができます。AquaMax 2000/4000マイクロプレートウォッシャーでは、分注速度、吸引速度、吸引高さを調整できるため、接着力の弱い問題のある細胞種でも最適な洗浄設定を選択できます。96ウェルおよび384ウェルの細胞洗浄用ヘッドは、既存のAquaMax 2000/4000マイクロプレートウォッシャーに追加することができ、レバーを回すだけで数秒で取り付けることができます。
AquaMax 2000/4000マイクロプレートウォッシャーの利点
- 洗浄用ヘッドは完全に交換可能で、工具なしで数秒で取り付けることができるため、幅広いプレートおよび細胞洗浄アプリケーションに対応するモジュラーシステムを構築できます。
- プレートの割り出しや象限処理なしでウェルの同時洗浄が可能なため、洗浄時間が短縮されます。
- マイクロプレートウォッシャーは、タッチスクリーンインターフェースにより完全にプログラム可能で、外部コンピューターは不要です。
- 外付けポンプがないため、ベンチスペースが節約できます。
- 包括的な自動洗浄ユーティリティにより、ダウンタイムが少なくメンテナンスが容易。
- ロボット工学に基づいた設計により、Molecular Devices社のStakMax®マイクロプレートスタッカーと同様に、主要なオートメーションシステムとの統合が可能です。テキスト
その他のソリューション
AquaMax 殺菌剤キット
AquaMax Sterilant Kit(Molecular Devices社カタログ番号:R8156)は、AquaMaxマイクロプレートウォッシャー用の完全な洗浄液を提供し、トラブルのない操作を保証します。
StakMaxマイクロプレートスタッカー
StakMax®マイクロプレートスタッカーは、Molecular Devicesマイクロプレートリーダーおよびウォッシャー用のセットアップが簡単で、パワフルかつ信頼性の高いマイクロプレートスタッキングソリューションです。本システムは、20枚、40枚、50枚のプレートマガジンに対応し、バーコード読み取りも可能です。
製品ビデオ
AquaMaxマイクロプレートウォッシャーのビデオなどは、www.youtube.com/MolecularDevicesInc
AquaMax Microplate Washerについて詳しく >>
PDF版(英語)