Application Note FLIPR TetraシステムでiCell心筋細胞2の
カルシウムオシレーションを測定
- 細胞培養時間の短縮によるアッセイワークフローと品質の向上
- 創薬プロセスの早い段階で安全性問題を引き起こす可能性のある化合物を特定
- ScreenWorks Peak Pro ソフトウェアによるデータ解析の簡素化
PDF版(英語)
はじめに
Carole Crittenden | Applications Scientist | Molecular Devices
Oksana Sirenko, PhD | Research Scientist | Molecular Devices
化合物の有効性と安全性のスクリーニングにかかるコストは増加の一途をたどっており、創薬プロセスの早い段階で特性評価を改善する革新的な技術が必要とされている。FDAは、心臓のhERGチャネルを阻害してTorsades de pointesのような症状を引き起こすようなオフターゲット効果によって医薬品が市場から撤去される必要がないように、医薬品の安全性を確保するための化合物試験のガイドラインを開発している。この取り組みは、包括的in vitro催不整脈アッセイまたはCiPAプロジェクトと呼ばれている。
人工多能性幹細胞(iPSC)由来の心筋細胞は、心機能と安全性の両方に対する化合物の影響を評価するために使用されるため、特に魅力的なin vitroモデル系である。カルシウムシグナルのオシレーションは細胞質カルシウム濃度の変化を反映するため、EarlyTox™心毒性キットのようなカルシウム感受性色素を使用することが可能です。ScreenWorks® Peak Pro ソフトウェアは、心筋細胞に対する化合物の影響をハイループットスクリーニングフォーマットで特徴付けるために、ピーク周波数、10%振幅でのピーク幅、およびその他のパラメータを解析します。
Cellular Dynamics International社は、従来のiPSCよりも凍結からの回復が早い強化版iPSC由来心筋細胞を開発した。この開発により、FLIPR® Tetraハイスループット・セルラー・スクリーニング・システムで拍動心筋細胞のカルシウム過渡に対する化合物の影響をスクリーニングする際に、増殖期間を5~7日短縮することができ、ワークフローが改善されます。ワークフローの例を図1に示す。ここでは、hERG チャネルを阻害することが知られているがん化合物と、hERG を阻害することが知られている化合物の試験について説明します。
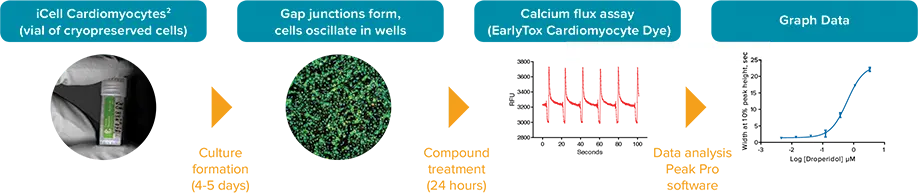
図1. FLIPR Tetraシステムを用いたiPSC2心筋細胞アッセイのワークフロー。
材料
- 細胞、プレーティング培地、維持培地を含むiCell®心筋細胞2キット(Cellular Dynamics,International社提供)
- 0.1% (w/v) ゼラチン
- 384ウェル黒色透明底プレート(Corning PN 3712)
- EarlyTox 心毒性キット(Molecular Devices PN R8210)
- 試験化合物およびDMSO(Sigma Aldrich)
- FLIPR Tetra ハイスループット細胞スクリーニングシステム(Molecular Devices社製)
FLIPR Tetra ハイスループット細胞スクリーニングシステム(Molecular Devices)
iCell Cardiomyocytes2 User Guideの指示に従い、0.1%ゼラチンでプレーティングし、384ウェルの黒色透明底培養プレートを調製した。iCell Cardiomyocytes2を解凍し、25μLのプレーティング培地に8,000個/ウェルでプレーティングした。セルは37℃、5% CO2、100%湿度で24時間培養した。セルは細胞単層を形成し、プレーティング培地を維持培地と培地交換した。セルは1日おきに維持培地で培養した。5日目には細胞はオシレーションを起こし、使用可能な状態になった。
iCell Cardiomyocytes2を用いてプレーティングを準備する。
iCell Cardiomyocytes2 ユーザーガイドの指示に従い、0.1%ゼラチンをプレーティングし、384 ウェル、黒色、透明底の培養プレートを調製した。iCell Cardiomyocytes2を解凍し、25 µLのプレーティング培地に8,000個/ウェルでプレーティングした。セルは37℃、5% CO2、100%湿度で24時間培養した。セルは細胞単層を形成し、プレーティング培地を維持培地と培地交換した。セルは1日おきに維持培地で培養した。5日目には、細胞は一緒にオシレーションし、使用可能な状態になった。
スクリーニング用プレートの準備
スクリーニングのために、化合物のストック溶液を100%DMSO中10mMで調製した。試験溶液は、維持培地で10-100μMに調製した。FLIPR Tetraシステムで読み取る前に、24時間ウェルに溶液を添加した。培地中のDMSOの最終濃度は0.15%(v/v)であった。化合物は、Half-log希釈で30μMまたは100μMの濃度で、二重(n=2)またはトリプリケート(n=3)で試験した。
FLIPR Tetraシステムを用いたカルシウムオシレーションの観察
アッセイ24時間前に、最終濃度30µMから始まる様々な化合物のHalf-log希釈液を、培地交換をしながらiPSC心筋細胞2に添加した。アッセイの2時間前に、維持培地中の2倍濃度のEarlyTox心毒性色素25μLを各ウェルに添加し、37℃、5%CO2でインキュベートした。細胞のオシレーションに伴うカルシウム濃度による蛍光の変化は、インキュベーターから取り出した直後にFLIPR Tetraシステムで読み取った。ScreenWorksソフトウェアの読み取りプロトコルで使用したセットアップパラメータを表1に示す。データはScreenWorks Peak Pro Softwareモジュールを用いて解析し、グラフはGraphPad Prism 6で作成した。
| モード | 設定 |
|---|---|
|
LED励起波長 |
515-575 nm |
|
フィルター発光波長 |
515-575 nm |
|
LED強度 |
50% |
|
カメラゲイン |
80 |
|
露光時間 |
0.05 second |
|
読み取り間隔 |
0.125 second |
表1. FLIPR Tetraシステムの読み取りパラメータ
心筋細胞のオシレーションピークパラメーターに対する化合物の影響
化合物添加24時間後のカルシウムオシレーションをFLIPR Tetraシステムを用いて読み取った。iPSC2は、ギャップジャンクションを形成し、カルシウム感受性色素で測定されたピーク周波数を与えるために一緒に振動することで、以前のバージョンのiPSCと同じように機能した。セルがアッセイできるようになったのは、以前のバージョンの細胞より4~5日早く、同様の結果を得ながら、混入のリスクが低く、全体的な時間枠が短くなったため、スクリーニングのワークフローが改善されたことが示された。
研究された化合物には抗がん化合物が含まれる: キナーゼ阻害剤であるスニチニブ、イマチニブ、スタウロスポリン(毒性のため臨床化合物ではない)、アルキルスルホン酸塩であるブスルファン、アントラサイクリン系のドキソルビシン、トポイソメラーゼII阻害剤であるエトポシド、細胞のチューブリン産生を阻害するパクリタキセルなどである。化合物添加後24時間で、いくつかのカルシウムオシレーションパターンはコントロールパターンから大きく変化した(図2)。スニチニブは対照と比較して、ピーク高さの10%におけるピーク幅が非常に大きく、さらにオシレーションの速度が遅かった。同様のパターンを示した他の抗がん化合物には、イマチニブとスタウロスポリンがあった。hERGは心臓の拍動の回復に寄与するカリウムチャネルをコードする遺伝子群であり、長いQ-T症候群やTorsades de pointes症候群の原因となる。パクリタキセル、ブスルファン、エトポシドはhERG活性を持たないことが知られており、カルシウムオシレーションを同じように遅くすることはなく、ピーク高さの10%でより広いピークを持つこともなかった。濃度反応曲線は、ドキソルビシンとスニチニブの24時間曝露後にピーク頻度の減少を示した。パクリタキセルもピーク頻度に影響を与えなかった化合物の一例である(図3)。
抗がん化合物に加えて、抗精神病薬でドパミン受容体遮断薬であるドロペリドール、三環系抗うつ薬でセロトニン受容体阻害薬であるアミトリプチリン、制酸薬であるシサプリドという、長いQ-T間隔延長で知られるhERG遮断化合物もアッセイで試験された。iPSC2sに24時間添加すると、3つの化合物ともピーク頻度が遅くなり、ピーク振幅10%におけるピーク幅が増加した(図4)。カルシウムオシレーションアッセイで試験した全化合物のIC50値のまとめを表2に示す。
| 試験化合物 | 作用機序 |
ピーク周波数 IC 50 (µM) |
|---|---|---|
| スニチニブ | キナーゼ阻害剤 | 0.58 |
| スニチニブ | キナーゼ阻害剤 | 0.61 |
| スタウロスポリン | キナーゼ阻害剤 | 4.02 |
| ドキソルビシン | アントラサイクリン | 51.8 |
| シサプリド | 制酸剤 | 0.01 |
| ドロペリドール | ドパミン拮抗薬 | 0.2 |
| アミトリプチリン | セロトニン拮抗薬 | 1.68 |
| パクリタキセ | チューブリン形成を阻害 | >100 |
| ブルスファン・アルキルスルホン | アルキルスルホン酸塩 | >100 |
| エトポシド | トポイソメラーゼII阻害剤 | >100 |
| ヘキソールシノール | 防腐剤 | >100 |
表2. iPSC2心筋細胞におけるカルシウムオシレーションに対する化合物の効果。
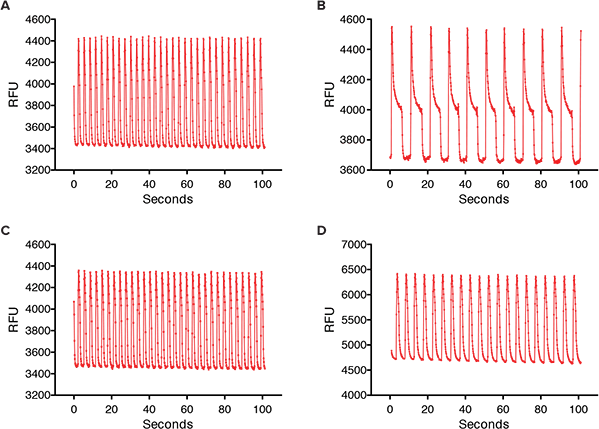
図2. iPSC2心筋細胞におけるカルシウムオシレーション。(A) FLIPR Tetraシステムで測定したコントロールのカルシウムオシレーション。(B)iPSC2細胞を1μMスニチニブに24時間暴露した後のカルシウムオシレーション。(C)iPSC2細胞を1μMパクリタキセルに24時間暴露した後のカルシウムオシレーション。(D)iPSC2細胞を1μMドキソルビシンに24時間暴露した後のカルシウムオシレーション。
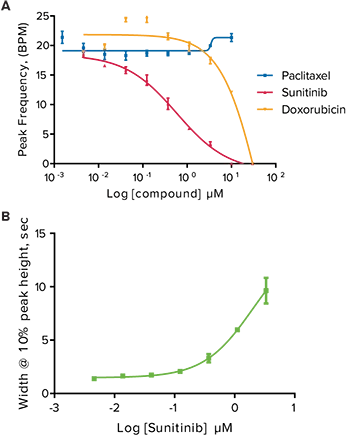
図3. 振動する心筋細胞のピークパラメーターに対する抗がん化合物の効果。(A)高濃度のスニチニブ、ドキソルビシン、パクリタキセルに24時間暴露したiPSC2細胞のカルシウムオシレーションのピーク周波数(BPM)。パクリタキセルはピーク周波数を遅くしなかった。(B)スニチニブの濃度上昇に伴うピーク高さ10%におけるピーク幅の増加。
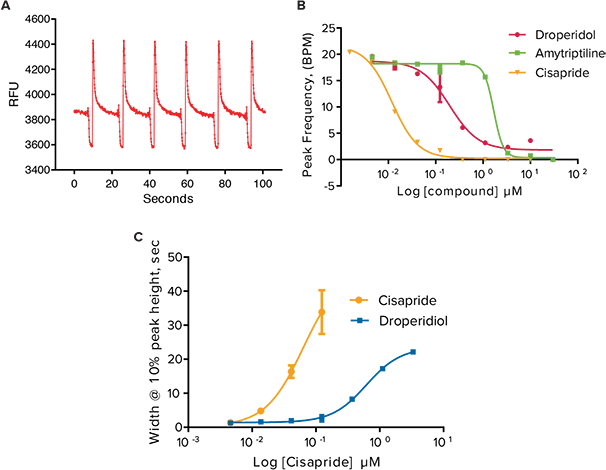
***図4. オシレーションしているiPSC心筋細胞を24時間暴露した後のピークパラメーターに対する選択したhERG遮断薬の効果。(A)**Cisapride 1μM曝露後のカルシウムオシレーションパターン。**(B)*
ドロペリドール、アミトリプチリン、シサプリド曝露後のピーク周波数。(C)ピーク高さ10%におけるピーク幅の増加。
結論
iPSC2心筋細胞は、FLIPR Tetraシステムでのカルシウムオシレーションアッセイを細胞解凍後10-14日ではなく、4-5日でモニターできるようにすることで、スクリーニングアッセイのワークフローを改善した。ScreenWorks Peak Pro ソフトウェアは、心筋細胞に対する化合物の効果を示すオシレーションパターンを容易に解析し、薬剤スクリーニングプロセスの効率的なツールとなりました。このアッセイは、リード化合物探索プロセスに進む前に、心臓に有害または有益な影響を及ぼす可能性のある化合物を同定するために、プロセスの初期段階で実施することができます。
リソース
- Sirenko, Oksana, et al. "Phenotypic Assays for Characterizing Compound Effects on Induced Pluripotent Stem Cell-Derived Cardiac Spheroids". ASSAY and Drug Development Technologies, vol. 15, no. 6, 2017, pp.280-296., doi:10.1089/adt.2017.792.
- Sirenko, Oksana, et al. "In vitro cardiotoxicity assessment of environmental chemicals using an organotypic human induced pluripotent stem cell-Derived model.". Toxicology and Applied Pharmacology, vol. 322, 2017, pp.60-74., doi:10.1016/j.taap.2017.02.020.
- Sirenko, Oksana, et al. "Assessment of beating parameters in human induced pluripotent stem cells enables quantitative in vitro screening for cardiotoxicity.". Toxicology and Applied Pharmacology, vol. 273, no. 3, 2013, pp.500-507., doi:10.1016/j.taap.2013.09.017
- "iCell Cardiomyocytes 2 ユーザーガイド". セルラー・ダイナミクス・インターナショナル、2016年8月
PDF版(英語)