Application Note ホモジニアスで安定した発光アッセイを用いて、
がん細胞の生存率を測定する。
- ウェルあたり20セルまでの高感度発光検出
- セル数とATP含量の相関が容易
- 便利な単一試薬ワークフロー
PDF版(英語)
はじめに
ジョイス・イタタニ|アプリケーションサイエンティスト|モレキュラー・デバイス
キャシー・オルセン|Sr.アプリケーションサイエンティスト|モレキュラー・デバイス
発光細胞生存能アッセイは、様々な実験条件の影響をモニターするための感度と容易なワークフローを提供する。ホタル・ルシフェラーゼ反応を用いて、異なる処理あるいは実験条件下における生存細胞の相対数を測定する方法である。代謝的に活性なセルは、ルシフェラーゼ反応に必要なATPを産生する。ATPが反応における制限成分である場合、生成される光の量は生存細胞数に比例し、それを読み取る役割を果たす(図1)。
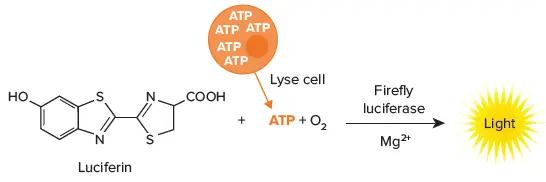
図1. 細胞生存率の測定に使われるルシフェラーゼ反応。細胞は溶解され、ルシフェラーゼ反応に加えられ、そこで光を生成するのに必要なATPが供給される。生きているセルが多いほど、より多くの光が生成される。
ここでは、SpectraMax® iD5 マルチモードマイクロプレートリーダーで Promega の CellTiter-Glo 2.0 Cell Viability Assay1 の性能を検証しました。ATPと生細胞の両方を用いて標準曲線を作成し、アッセイの感度と直線性を実証した。
細胞毒性評価におけるCellTiter-Glo 2.0アッセイの有用性を確認するため、エストロゲン受容体(ER)陽性乳がん細胞株であるMCF7を選択的エストロゲン受容体モジュレーター(SERM)であるタモキシフェンで処理し、細胞死を誘導した。
材料
- CellTiter-Glo 2.0 Assay(プロメガ社、商品番号 G5241)
- 96ウェルソリッド白色組織培養処理マイクロプレート(コーニング社製 cat.)
- MCF7細胞(乳がん細胞株、ATTC cat.)
- タモキシフェン(Tocris社のカタログ#6342)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(Molecular Devices cat.)
方法
ATP標準曲線
ATPの1:10連続希釈液を培地で調製した。白色96ウェルマイクロプレートの3連ウェルに、1nMから10μMまでの100μLのサンプルを添加した。バックグラウンド発光を測定するため、培地のみを含むコントロールも加えた。100μLのCellTiter-Glo 2.0試薬を各ウェルに加え、マイクロプレートをプレートシェーカーに2分間置いた後、室温で10分間インキュベートした。その後、SpectraMax iD5 リーダーで表 1 に示す設定を用いて発光を検出した。
| パラメータ | セッティング |
|---|---|
| Read mode | 発光 |
| タイプを読む | エンドポイント |
| 波長 | 全波長 |
| プレーティングタイプ | 96ウェルCostar |
| PMT and optics | 積分時間: 1000 ms 読み取り高さ: 3.54 mm |
表1. SpectraMax iD5リーダーでの発光測定用インストゥルメンテーション設定。All Wavelengths設定(波長選択なし)は、リーダーで検出される発光を最大にするために選択した。読み取り高さは、SoftMax® ProソフトウェアのRead Height Adjustment設定を使用して最適化した。
セル数と発光出力の相関性
MCF7細胞は、ソリッド白色96ウェルマイクロプレートに1ウェル当たり20~20,000個播種した。バックグラウンドコントロールウェルには培地のみを封じ込めた。セルとコントロールは、1ウェル当たり100μLで二重に行った。細胞を37℃、5% CO2で3時間ウェルに接着させた。マイクロプレートを30分間室温に平衡化し、100μLのCellTiter-Glo 2.0試薬を各ウェルに添加した。プレートをプレートシェーカーに2分間置いて溶解を誘導し、室温で10分間インキュベートした後、SpectraMax iD5リーダーで発光を測定した。
細胞生存率アッセイ
MCF7細胞をソリッド白色96ウェル組織培養処理マイクロプレートに1ウェル当たり15,000個播種し、37℃、5%CO2で一晩接着させた。バックグラウンド発光を測定するため、細胞を含まない培地を封じ込めたコントロールウェルも加えた。翌日、0.2μMから100μMまでのタモキシフェンの1:2連続希釈液をセルに添加した。セルを48時間インキュベートした。ウェルあたり100μLのCellTiter-Glo 2.0を添加する前に、マイクロプレートを30分間室温に平衡化した。プレートを2分間振って細胞溶解を誘導し、室温で10分間インキュベートして発光シグナルを安定化させてから読み取った。細胞のATP含量は、SoftMax® Proソフトウェアで事前に設定したCellTiter-GloプロトコルのATP標準曲線を用いて算出することができます。
結果
結果CellTiter-Glo 2.0アッセイを用いてATP標準曲線を作成した。SpectraMax iD5 リーダーを用いて検出したところ、この曲線は 4 桁の ATP 濃度にわたって直線的であった(図 2)。
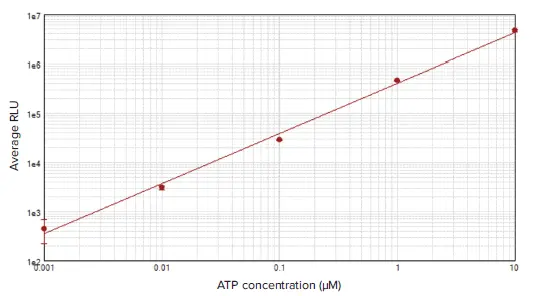
図2. ATP標準曲線。SoftMax® Proソフトウェアのlog-logカーブフィット処理(r2 = 0.996)を用いて、平均発光量対ATP濃度をプロットした。
96ウェルプレートに1ウェル当たり20~20,000個播種したMCF7細胞からなる標準曲線は、r2=0.993と全範囲にわたって直線的であり(図3)、生存細胞数の広い範囲にわたってこのアッセイの有用性が検証された。タモキシフェンで48時間処理したMCF7細胞を細胞毒性アッセイし、得られた濃度応答曲線をSoftMax® Proソフトウェアの4パラメータカーブフィットを用いてプロットした(図4)。この曲線から、19.7 μMのIC50値がソフトウエアによって自動的に算出された。この結果は、MCF72における他の発表結果と一致している。
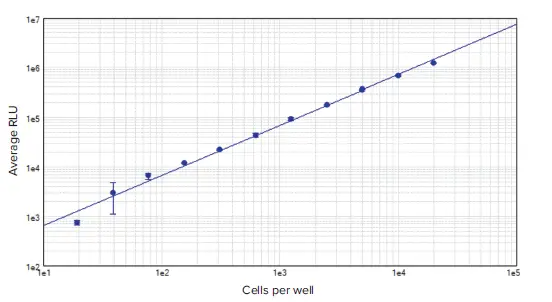
図3. 96ウェルフォーマットでのMCF7細胞希釈系列。CellTiter-Glo 2.0アッセイを用いて、1ウェルあたり20細胞という低濃度の細胞を検出することができた(r2 = 0.993)。
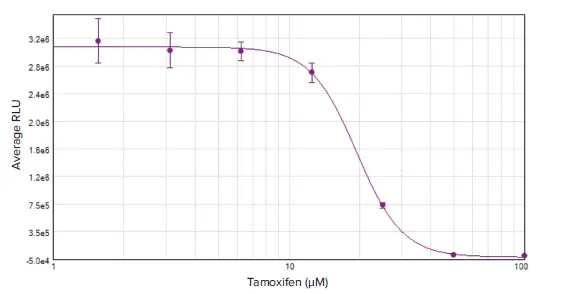
図4. タモキシフェンで処理したMCF7セル。結果は4パラメータカーブフィットを用いてプロットした(IC50 = 19.70 μM)。
結論
実験的処理に対する細胞生存能のスクリーニングは、ホモジニアスで安定なアッセイを用いるのが最も容易である。CellTiter-Glo 2.0アッセイは、マイクロプレートで培養した細胞に直接添加する単一試薬で構成されており、様々な保存条件下で安定である。シグナル半減期は3時間以上であり、様々なスクリーニングやその他のワークフローに対応します。
発光シグナルのSN比を向上させる超低温PMTを搭載したSpectraMax iD5リーダーとともに使用することで、このアッセイは、1ウェルあたり20細胞までの幅広い細胞数の線形検出を可能にする。SpectraMax iD5 リーダーは、CellTiter-Glo アッセイと、追加の検出モードを必要とする他のアッセイとのマルチプレックス要件も提供します。
参考文献
- テクニカルマニュアル CellTiter-Glo 2.0 アッセイ。プロメガ社。
- Li AP, Bode C, and Sakai Y. ヒトの薬物毒性評価のための新しいin vitroシステム、統合離散多臓器細胞培養(IdMOC)システム:5大臓器の正常ヒト細胞およびMCF-7腺癌乳癌細胞に対するタモキシフェンの細胞毒性比較。Chemico-Biological Interactions 150 (2004) 129-136.
PDF版(英語)