Application Note 生細胞の不連続タイムラプスイメージングを用いて
細胞遊走を測定する
- 再現性のある自動細胞遊走実験の実施
- 主要なタイムポイントのみを取得することで、時間と保管スペースを節約
- プレート全体のタイムラプス応答を一度に可視化
- ハイコンテント解析による信頼性の高い統計結果の確保
PDF版(英語)
はじめに
ジェイン・ヘスレー|イメージングアプリケーションサイエンティスト|モレキュラーデバイス
細胞遊走は、胚発生、創傷治癒、がん転移、免疫応答など、多くの生物学的事象に必要不可欠なプロセスである。多くの場合、免疫細胞はサイトカインシグナルやケモカイン勾配に応答して自然免疫系が活性化する際に炎症部位に遊走し、損傷組織を除去して組織を再生する1, 2。しかし、免疫細胞の遊走と蓄積は、関節リウマチのような多くの自己免疫疾患の発症にもつながる3。さらに、がん患者の腫瘍微小環境におけるセル運動性の亢進は、がんの進行を悪化させる可能性がある4。従って、新たな治療法や治療薬を開発するために、特定の疾患の病因を研究する際にセル運動性を測定することは極めて重要である。
細胞の運動性は、傷のある領域への細胞の移動を観察するために、手作業で「傷」を作る細胞遊走アッセイを用いて、制御された環境で測定されることが多い。しかし、手作業で傷を作製するのは手間と時間がかかるため、この手法はハイスループットスクリーニング研究には不向きである。
ここでは、96ウェルおよび384ウェルのマイクロプレートで細胞遊走イメージングとリアルタイム解析を行い、ハイスループットの細胞遊走実験を可能にする、スケールアップした方法を示す(図1)。Platypus Technologies社によって開発されたこのアダプター式細胞遊走アッセイを用いると、細胞の遊走能力に影響を与える可能性のある複数の化合物を、適切な複製を用いながら1回の制御された実験でスクリーニングすることができる。細胞はまず、溶解可能な生体適合性ゲルを封じ込めたマイクロプレートにプレーティングされ、細胞のない排除ゾーンが形成される。プレーティングの数時間後、ImageXpress Pico自動細胞イメージングシステムを用いてイメージングを開始し、無細胞ゾーンへの細胞の遊走を測定する。CellReporterXpress™画像取得・解析ソフトウェアで利用可能な不連続タイムラプス機能により、異なるタイムポイントで取得したウェルを1つのファイルに保存し、タイムラプス実験としてシームレスに解析・プロットすることができる。この方法を用いて、化学療法化合物であるサイトカラシンD、コルヒチン、ノコダゾールで処理したHT 1080(線維肉腫)細胞の創傷治癒の違いを示すことに成功した。
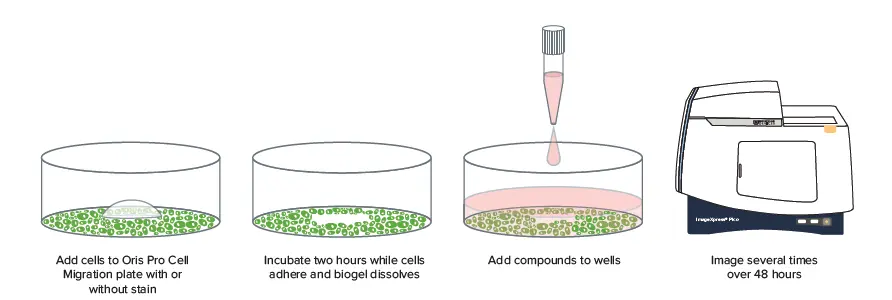
図1. ImageXpress Picoシステムを用いた細胞遊走実験。細胞遊走に対する化合物の効果を測定するため、2時間から45時間の間の異なるタイムポイントでプレーティングを行った。
材料
- HT 1080線維肉腫細胞株(ATCC, P/N CCL-121)
- SiR-アクチンキット(細胞骨格社、P/N CY-SC001)
- シトシンß-D-アラビノフラノシド塩酸塩(Ara C)(Sigma Aldrich, P/N C1768)
- Oris ™ Pro セル遊走アッセイ(Platypus Technologies, P/N PRO384CMA1)
- ImageXpress Pico自動細胞イメージングシステム(Molecular Devices社製)
- CellReporterXpress 画像取得および解析ソフトウェア(Molecular Devices社製)
方法
HT 1080細胞をまず、シトシンß-D-アラビノフラノシド塩酸塩(Ara C)とSiR-Actinでそれぞれ最終濃度20μMと0.1μMに処理した。Araセルは細胞分裂を阻害し、阻止円内の細胞の存在が細胞分裂ではなく細胞遊走のみに起因することを確実にする一方、SiR-Actinは生きた細胞のアクチンを染色する無害な蛍光色素である。処理後、細胞を384ウェルOris Proセル遊走プレートに10,000個/ウェル、最終容量30μLでプレーティングし、インキュベーターに戻した。
細胞が接着し、ゲルが2時間溶解した後、30μLの化学療法化合物を、ウェルにすでにある30μLの細胞に加えた。細胞は、ImageXpress Picoシステムを用いた不連続的タイムラプスを用いてイメージングされ、45時間の間に8つのタイムポイントで生細胞のプレートをイメージングすることができた。
この機能は、シームレスなタイムラプス解析のために1つの実験に画像を追加し、細胞が排除ゾーンに完全に遊走するには数日かかるため、余計なデータを生成しすぎることを排除する(図2)。4倍の倍率で、透過光(5ms未満の露光)とCy5蛍光(500-1000msの露光)の両方を用いて、ウェル全体の単一画像を取得した。透過光(Transmitted Light, Large Cell)と蛍光分析(Cell Scoring - Cy5 nuclei and cytoplasm)の両方に最適化された分析プロトコルを用いて、取得と同時に数値結果を作成した(図3)。
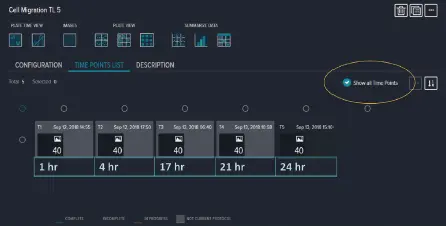
図2. 各撮影タイムポイント間の間隔を変化させた不連続タイムラプス実験。
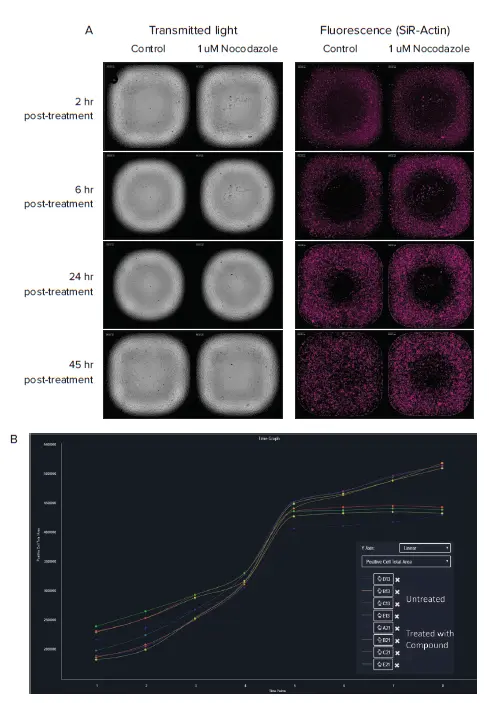
図3. A. HT 1080コントロール細胞(左)の透過光と蛍光(SiR-Actin)イメージの例と、代表的な4つの時点における1μM Nocodazoleで処理した細胞(右)の比較。ノコダゾールは排除領域への遊走を遅らせた。B. CellReporterXpressソフトウェアによる排除領域への遊走の可視化。未処理のコントロール細胞は、化合物処理細胞と比較して遊走が速かった。
予想通り、コルヒチン、サイトカラシンD、ノコダゾールを用いて細胞を処理すると、コントロール細胞と比較して細胞の遊走が有意に減少した(図4)。細胞遊走の減少は、SiR-Actinで染色した細胞から得られた蛍光イメージャーでも観察された(図5)。このことは、SiR-Actinを保持する細胞株では、蛍光SiR-Actin標識の有無にかかわらず細胞遊走アッセイを実施できることを示している。
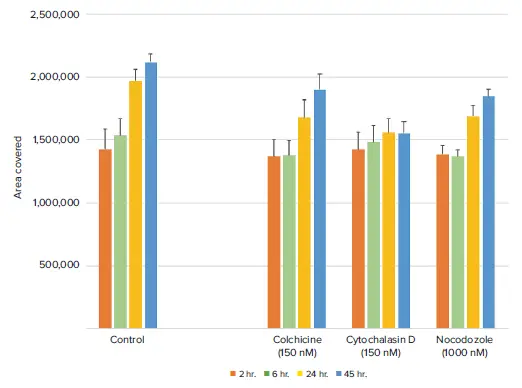
図4. 経時的な透過光解析により、化合物処理ウェルは細胞遊走の減少を示した。シトカラシンDは遊走阻害効果が最も長く持続した。
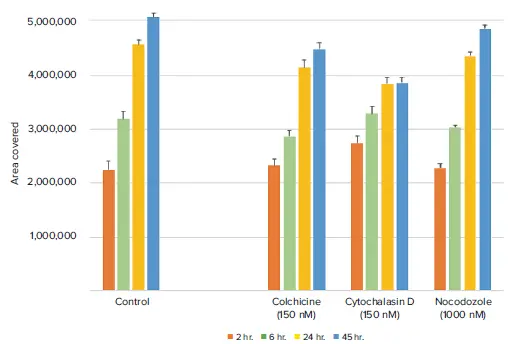
図5. 経時的な蛍光標識細胞の分析から、化合物処理ウェルでは細胞の遊走が減少していることが示された。データは透過光を用いて得られた結果と相関する。
結論
ImageXpress PicoシステムとCellReporterXpressソフトウェアを用いて、384ウェルOris ProマイクロプレートにプレーティングしたHT 1080細胞の45時間にわたる細胞遊走を画像化し解析した。予想されたように、化学療法化合物であるコルヒチン、サイトカラシンD、ノコダゾールによる処理は、コントロールと比較して細胞の遊走速度を有意に減少させた。透過光と蛍光を用いて得られたデータには相関があり、SiR-Actinのような蛍光染色で標識した細胞でも、そうでない細胞でも、実験期間中に細胞が色素を保持できる限り、細胞の遊走が観察できることを示している。
ImageXpressピコシステムにより、研究者は無細胞領域への細胞の遊走を経時的に定量することができる。例えば、生細胞イメージングを維持するために必要な環境制御オプションがインストゥルメンテーションに装備されていない場合や、長時間のタイムラプス実験中に他のユーザーも同じインストゥルメンテーションで画像を取得する必要がある場合は、定義された間隔で自動的に、またはプレートをインストゥルメンテーションから出し入れして手動でタイムラプス画像を取得することができます。インストゥルメンテーションは、96ウェルおよび384ウェルのオリスプロマイクロプレートで、低倍率対物レンズ(4Xまたは10X)を用いたこれらのアッセイに対応でき、複数の視野が必要な場合は、ソフトウェアが自動的にサイトをつなぎ合わせる。統合されたCellReporterXpressソフトウェアで解析プロトコルをセットアップするのは簡単で、透過光または蛍光イメージャーを使用して、細胞単層で覆われたウェルの面積を報告し、プレート画像の取得中に結果を得ることができる。
参考文献
- Barrett CS、Millena AC、Khan SA. (2017) 前立腺がん細胞の遊走と浸潤に対するTGF-β効果はFosBを必要とする。前立腺 77(1):72-81
- Julier Z, Park AJ, Briguez PS, Martino MM. (2017) 免疫系の調節による組織再生の促進。Acta Biomater 53:13-28
- Nevius E, Gomes AC, Pereira JP. (2016) Inflammatory Cell Migration in Rheumatoid Arthritis: A Comprehensive Review. Clin Rev Allergy Immunol 51(1):59-78
- 白石真理, 新谷祐子, 石田博之, 佐波亮, 山口晃, 足立浩史, 八代倫, 鈴木啓介. (2016) Alternatively activated macrophage determine repair of the infarcted adult mouse heart. J Clin Invest 126(6):2151-66
PDF版(英語)