Application Note FlexStation 3 リーダーで
カルシウム放出活性化 Ca2+(CRAC)チャネル活性を測定
- 洗浄不要のアッセイフォーマットで時間を節約
- 特許取得済みのマスキング色素技術により、バックグラウン ド蛍光を低減し、SB比を改善。
- FLEXStationの2波長対応により、絶対Ca2+濃度の計算が容易
PDF版(英語)
はじめに
小胞体(ER)からのCa2+の枯渇は、様々なタイプの細胞において、細胞膜を介したCa2+の流入を活性化する。この過程は、蓄積作動型カルシウム流入(SOCE)として知られており、細胞内へのCa2+の流入を制御する最も一般的な様式である。SOCE電流の中で最もよく知られているのは、Ca2+放出活性化Ca2+電流(ICRAC)であり、マスト細胞で最初に報告され、その後Jurkat細胞やRBL細胞など他の細胞種でも記録されている。枯渇した貯蔵物質がSOCEを活性化するメカニズムには、小胞体Ca2+センサーであるSTIM1の複雑な細胞運動が関与しており、STIM1は細胞膜近傍の点状に再分布し、CRACチャネルの孔形成サブユニットとして機能するORAI1、ORAI2、ORAI3サブユニットからなる細胞膜チャネルを活性化する。
CRACチャネルの重要性は、SOCEを消失させるORAI1およびSTIM1遺伝子の機能喪失または変異を有するヒト患者において明らかである。これらの患者は、重度の免疫不全、自己免疫、先天性筋緊張低下、エクリン汗腺の機能喪失を特徴とする、CRACチャネル症と呼ばれる独特の病態を呈する。CRAC機能の異常は、急性膵炎、異常細胞増殖、乳癌転移にも関与している。簡便で信頼性が高く、感度の高いCRACチャネルアッセイの開発は、これらのヒト疾患の治療を目的とした新規治療薬の検出に貢献する可能性がある。
FlexStation® 3 マルチモードマイクロプレートリーダーは、試薬 をコンパウンドプレートからアッセイプレートに直接移し替えるた めの8または16チャンネルピペッターを内蔵した5モードリー ダーである。ハイスループット環境で使用できる最も信頼性が高く、一貫性があり、ロバスト性の高いアッセイを行うためには、最適な色素を選択することが重要であることを示す。
材料と方法 セル培養
セル培養
RBL細胞はEuropean Collection of Authenticated Cell Cultures (ECACC)から入手し、2mMグルタミン、1mMピルビン酸ナトリウム、1% Non-Essential Amino Acids、10%ウシ胎児血清を添加したEMEM中で培養した。セルは5% CO2に設定した加湿インキュベーター内で37℃に維持した。セルプレートは、Corning CellBIND黒壁透明底384ウェルマイクロプレート(cat. #3683)に1ウェルあたり10,000細胞を50μLの増殖培地中に分注し、5% CO2に設定した37℃の加湿インキュベーター内で一晩接着させて調製した。
色素の調製
カルシウムフリーローディングバッファー: 40 mM NaCl、100 mM KCl、17 mM NaHCO3、0.1 mM EGTA、12 mM グルコース、1 mM MgCl2、5 mM HEPES緩衝液、pH 7.4。
FLIPR カルシウム 6 測定キット
カルシウム 6 測定試薬(コンポーネント A)のバイアルを冷凍庫から取り出し、室温に平衡化します。カルシウムフリーローディングバッファー10mLを加え、コンポーネントAバイアルを溶解する。バイアル瓶の内容物が完全に溶解するまでボルテックス(1~2分)して混合する。実験間の再現性を確保するために、内容物を完全に溶解させることが重要である。10mLの緩衝液に10mLの再構成Component A/bufferを加え、全量を20mLとする。
Fluo-4 NW カルシウムアッセイキット
カルシウムを含まないローディングバッファー 10 mL をコンポーネント A のボトル 1 本に加える。色素が完全に溶解するように、色素ローディング溶液を1~2分間激しく振盪またはボルテックスする。
Fura-2 QBT™ カルシウムキット
カルシウム6測定試薬(コンポーネントA)のバイアルを冷凍庫から取り出し、室温に平衡化します。カルシウムを含まないローディングバッファー10mLを加え、コンポーネントAバイアル1本の内容物を溶かします。バイアル瓶の内容物が完全に溶解するまでボルテックス(1~2分)して混合する。実験間の再現性を確保するために、内容物を完全に溶解させることが重要である。再構成Component A/バッファー10 mLをバッファー10 mLに加え、全量を20 mLとする。
色素負荷
セルプレートをインキュベーターから取り出し、増殖培地を除去し、2.5 mM probenecid を封じ込めた 1X dye loading solution 30 μL と交換した。プレートを37℃で2時間(Calcium 6)または1時間(Fura-2 QBTおよびFluo-4 NW)インキュベートした後、アッセイ前に室温(R.T.)で15分間放置した。
アッセイ
化合物プレートは、100%DMSOストック(阻害剤用量反応曲線およびコントロール)をタプシガルギンを含むカルシウムフリーバッファーで希釈して調製し、小胞体カルシウム貯蔵量を枯渇させた。タプシガルギンの最終アッセイ濃度は1μMであった。10μLの試験化合物またはコントロール(+タプシガルギン)を添加し、プレートを暗所、R.T.で15分間インキュベートした。試験した化合物はチャネルの既知の阻害剤3種である: YM-58483、La3+、2-アミノエトキシジフェニルボリネート(2-APB)である。
Ca2+ シグナルを誘導するために、SoftMax® Pro 7 データ収集・解析ソフトウェアが作動しているFLEXstation 3 リーダーを用い、10 μLの塩化カルシウム(CaCl2、最終アッセイ濃度1 mM)を加え、その結果生じるシグナルを、Calcium 6およびFluo4 NWについて、励起波長485 nm、発光波長525 nm、自動発光カットオフ515 nmで2分間測定した。Fura-2 QBTについては、励起波長は340/380 nm、Emission波長は510 nmで、カットオフは不要であった。
結果
最初の実験は、その後の阻害試験で使用するCaCl2のIC80濃度を確認するために行われた。選ばれたCaCl2の濃度は1mMであった(図1)。
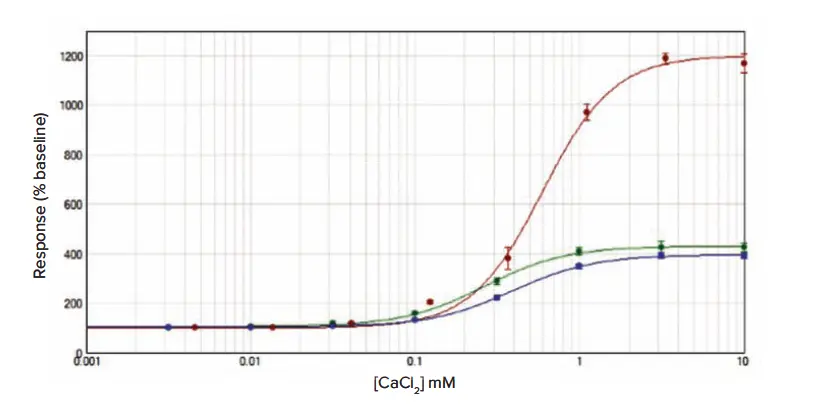
図1. カルシウム6(赤点、EC50 0.6±0.03mM)、Fluo4 NW(緑点、EC50 0.3±0.02mM)またはFura-2 QBT(青点、EC50 0.4±0.01mM)を負荷したRBL細胞におけるCaCl2に対する濃度効果曲線。データは平均値±s.e.m.(n = 12)であり、ベースラインに対する増加率で正規化した
その後の阻害曲線研究のデータを図2、3、4に示し、平均IC50推定値(± s.e.m.)を平均アッセイZ'因子とともに表1に示す。
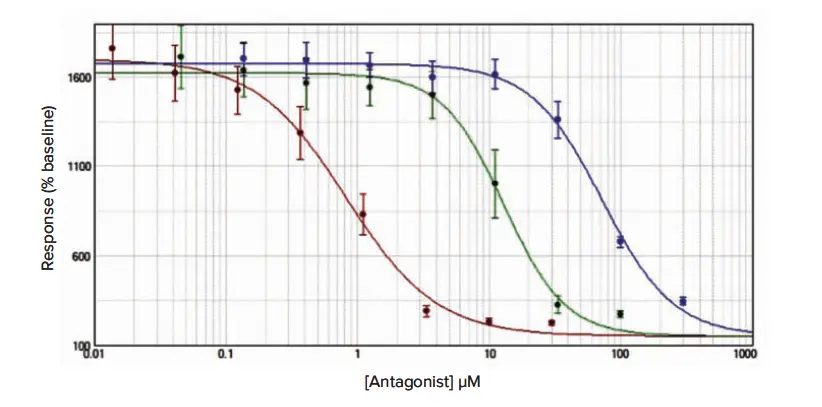
図2(カルシウム6): 接着RBL細胞におけるCRACチャネル阻害アッセイ。カルシウム6をメソッドセクションに概説されたプロトコールに従って負荷し、YM-58483(赤点)、2-APB(緑点)、La3+(青点)による阻害曲線を得た。データは平均値±s.e.m.(n = 12)であり、ベースラインに対する増加率で正規化した。
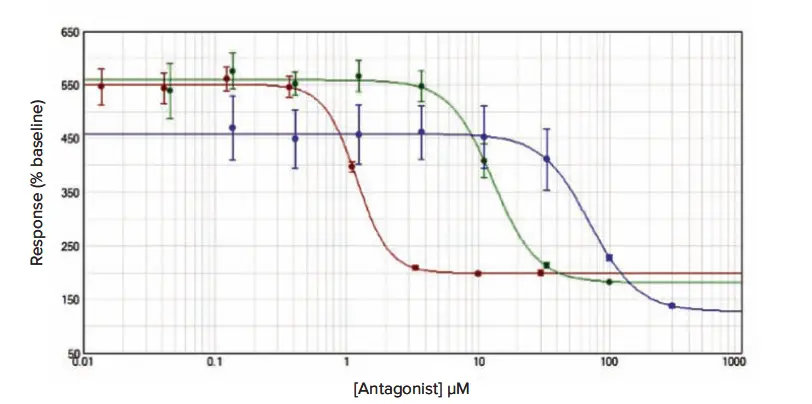
図3(Fluo-4 NW): 接着細胞RBLにおけるCRACチャネル阻害アッセイ。メソッドセクションに概説したプロトコールに従ってFluo4 NWを負荷し、YM-58483(赤点)、2-APB(緑点)、La3+(青点)による阻害曲線を得た。データは平均値±s.e.m.(n = 12)であり、ベースラインに対する増加率で正規化した。
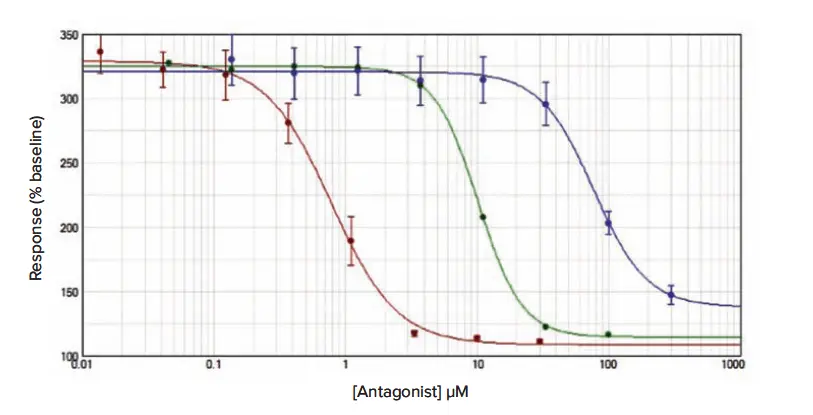
図4(Fura-2 QBT)。接着RBL細胞におけるCRACチャネル阻害アッセイ。Fura-2 QBTをメソッドセクションに概説されたプロトコールに従って負荷し、YM-58483(赤点)、2-APB(緑点)、La3+(青点)による阻害曲線を得た。データは平均値±s.e.m.(n = 12)であり、ベースラインに対する増加率で正規化した。
| YM 58483 | 2-APB |
La 3+ |
||
|---|---|---|---|---|
| カルシウム 6 | IC
50 |
0.82 ± 0.09 | 12.93 ± 1.76 | 72.27 ± 3.90 |
| カルシウム 6 | Z'因子 | 0.60 | 0.53 | 0.46 |
| フルオ 4 NW | IC
50 |
1.19 ± 0.03 | 13.00 ± 1.04 | 70.33 ± 3.97 |
| フルオ 4 NW | Z'因子 | 0.13 | 0.25 | 0.09 |
| フーラ2 QBT | IC
50 |
0.79 ± 0.06 | 11.17 ± 0.19 | 76.51 ± 5.91 |
| フーラ2 QBT | Z'因子 | 0.25 | 0.40 | 0.31 |
表1. 異なるカルシウム感受性色素を負荷したRBL細胞において、YM-58483、2-APBおよびLa3+で得られた平均IC50推定値。結果は平均値±s.e.m.(n≥8)。
結論
我々は、RBL細胞株を用いたカルシウム放出活性化 (CRAC)チャネルアッセイにおいて、FLEXstation 3リーダーを 用いて3種類の「洗浄不要」カルシウムインジケーターを比較 した。Fura-2 QBTおよびCalcium 6アッセイキットは、GPCRおよびイオ ンチャネルターゲットのアッセイ開発とスクリーニングを迅速化 するために設計されたホモジニアス蛍光ベースの製剤であり、バッ クグラウンド蛍光を低減しSB比を改善する特許取得済みマスキン グ色素技術に基づいている。Fluo-4 NW (no-wash) Calcium Assay Kitは、細胞内カルシウムを検出するための代替法を提供するが、マスキング色素は使用しない。
CaCl2の最適EC50濃度を決定するための初期実験では、FLIPRカルシウム6アッセイキットが他の2つのアッセイキットよりも蛍光シグナルが大きく、ロバスト性が高いという利点が示された。CaCl2のEC50値は、使用した色素間で一貫していた。
FLEXstation 3リーダーで作成したアンタゴニストデータを 比較した場合も、同様の結果が得られた。薬理学的プロフ ァイルは3つの治療グループ間で一貫していたが(Table 1)、Z'ファクターを計算することによって決定 されるアッセイのロバスト性は有意に変化した。Fluo-4 NWキットで作成されたデータはロバスト性が低い傾向があり、その結果アッセイの忠実度は低かった。Fura-2 QBTカルシウムキットは特許取得済みマスキング技術を採用しており、レシオメトリックカルシウムインジケーターである利点があるが、FLIPRカルシウム6アッセイキットで最も高いシグナルとそれに関連するZ'ファクターが得られた。
PDF版(英語)