Application Note SpectraMax i3xリーダーで酸化代謝と解糖系活性を測定
- 培養細胞や微生物における細胞外酸素欠乏と酸性化のリアルタイム測定
- 2つのシンプルな混合-測定アッセイワークフローによる高感度TRF検出
- SoftMax Proプロトコルの事前設定により、より迅速なデータ取得と解析が可能
PDF版(英語)
はじめに
キャサリーン・サロモ|アプリケーションサイエンティスト|Molecular Devices GmbH
ライアン・マクガリーグル(Ryan McGarrigle)博士|リサーチ・サイエンティスト|アジレント・テクノロジー・アイルランド(Agilent Technologies Ireland Ltd.
コン・キャリー(MSc)|テクノロジー・スペシャリスト|アジレント・テクノロジー・アイルランド(Agilent Technologies Ireland Ltd.
セルが生き延びるためには、ほとんどの重要なバイオプロセスを実行するために、ATPという形の燃料が必要である。この燃料は解糖とミトコンドリア呼吸によって生成される。どちらもATPを産生するが、解糖は酸素がなくても機能するのに対し、ミトコンドリアは酸化的リン酸化(OXPHOS)の最終段階で酸素を必要とする。これらの経路は、環境ストレス、基材の利用可能性、低酸素状態に適応しながら、細胞のエネルギー需要を満たすためにダイナミックに変化する。一般に、変化の測定は、単一点の測定(例えばATPエンドポイント)よりも代謝反応に関するより多くの情報を与える。呼吸の乱れは、薬物毒性後のミトコンドリア機能障害の鋭敏な指標である。ミトコンドリア機能の光学収差は、神経変性からがんに至るまで、さまざまな疾患に関与している。
これらの経路がエフェクター化合物にどのように反応するかを理解することで、細胞の全体的な機能や細胞の運命を決定する根本的なメカニズムについて有用な知見を得ることができる。
最近の試薬とプレートリーダー技術の進歩により、標準的なマイクロタイタープレート上での簡便な代謝分析が可能になった。ここでは、SpectraMax® i3x マルチモードマイクロプレートリーダーでの Agilent MitoXpress® Xtra 酸素消費アッセイと Agilent pH-Xtra™ 解糖アッセイの使用について説明します。グルコースオキシダーゼ (GOx) を用いた酵素アッセイと細胞ベースアッセイを用いて、標準的な 96 ウェルプレートを用いて酸素消費と解糖を評価しました。
MitoXpress Xtra酸素消費アッセイは、酸素消費をリアルタイムで直接測定できる。試薬は、酸素感受性、水溶性、セル不透過性の蛍光プローブである。蛍光発光は酸素によって消光されるため、シグナルはウェル内の酸素濃度に反比例する。酸素が消費されると蛍光が増加するので、カイネティック測定を用いれば、シグナルの増加速度をモニターすることにより、ミトコンドリアの活性を推測することができる。
pH-Xtra Glycolysis Assayは、細胞外酸性化の直接的なリアルタイムカイネティック解析を可能にする。グルコースが解糖経路で処理されると、ピルビン酸を生成してクレブスサイクルでさらに酸化するか、乳酸を生成して細胞外環境を酸性化する。このpHの変化はpH-Xtraを用いて測定することができ、解糖系活性に関する知見を得ることができる。MitoXpress Xtraと同様に、pH-Xtraは生物学的範囲にわたって正のシグナル応答を示し、細胞外酸性化の柔軟でハイスループットな評価を可能にし、反応中に消費されることはありません。細胞外酸性化の速度は、経時的な蛍光シグナルの変化から計算される。
MitoXpress Xtra または pH-Xtra 試薬で最高の感度を得るには、プレートリーダーで時間分解蛍光検出モードを使用することを推奨します。SpectraMax i3x リーダーには、吸光度、蛍光、発光の検出モードがあります。MitoXpress Xtra および pH-Xtra 試薬の時間分解蛍光検出は、時間分解(TRF)検出カートリッジ を追加することで可能になります。TRF 検出カートリッジには専用の光源とエミッションフィルターが封入されており、高いパフォーマンスを実現します。SoftMax®Proソフトウェア7.0.3以降では、softmaxpro.orgで入手可能な設定済みプロトコルを使用することで、酸素消費量とグリコール活性の進行の取得と解析の両方が実現します。
材料
- HepG2細胞 (ATCC cat. #HB-8065)
- アスペルギルス・ニガー由来グルコース酸化酵素IV型(Sigma-Aldrich cat.)
- 完全培地
⚪︎ダルベッコ変法イーグル培地-高グルコース(DMEM、Sigma-Aldrich cat.)
⚪︎ウシ胎児血清(Sigma-Aldrich cat.)
⚪︎ペニシリン/ストレプトマイシン(Sigma-Aldrich cat.)
- 試験化合物
⚪︎アンチマイシンA(シグマアルドリッチ社製、商品番号A8674)
⚪︎カルボニルシアニド4-(トリフルオロメトキシ)フェニルヒドラゾン(FCCP、Sigma-Aldrich cat.#C2920)
⚪︎2-デオキシ-D-グルコース(2-DG、Sigma-Aldrich cat.#D8375)
⚪︎オリゴマイシンA(Sigma-Aldrich cat.)
- ミトエクスプレス エクストラ 酸素消費アッセイ(ギレント・テクノロジー.#MX-200-4)、封じ込め:
⚪︎ミトエクスプレス エクストラ試薬
⚪︎高感度オイル
- pH-Xtra解糖アッセイ (ギレント・テクノロジー.#MX-200-4)、封じ込め:
⚪︎pH-Xtra試薬
⚪︎呼吸バッファー錠剤
- マイクロプレート
⚪︎96 ウェル、クリアボトム、組織培養処理マイクロプレート(Sarstedt 社、cat. #83.3924.300)
⚪︎SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices、cat. #i3x)とTRF検出カートリッジ(Molecular Devices、cat. #0200-7008)。
方法
信号制御
シグナル/ブランク比(S:B)とシグナル倍数増加(F0:F)の両方を評価するため、96ウェルプレートを用いた無細胞カイネティック実験をセットアップした。コントロールウェルは MitoXpress Xtra 酸素消費アッセイと同様に設定した:
- ブランク(B)=培地
- シグナルコントロール(S、F)=培地とMitoXpress Xtra試薬
- GOxコントロール(F0) = 0.1 mg/mL GOxを使用して脱酸素した培地と試薬
以下のコントロールはpH-Xtra Glycolysis Assayのために調製された:
- ブランク (B) = レスピレーションバッファー
- シグナルコントロール(S、F)=呼吸バッファーおよびpH-Xtra試薬
- GOxコントロール(F0) = 0.1mg/mLのpHXtra試薬とGOxの両方を封じ込めた呼吸緩衝液。
細胞ベースアッセイ
HepG2細胞は、96ウェル、透明底、組織培養処理済みマイクロプレートに、1ウェル当たり50,000細胞で播種した。外周のウェルはセルには使用せず、エッジ効果を避けるためにPBSで満たした。均一な分布を確保するため、インキュベーター(湿度95%、37℃、5%CO2)で一晩培養する前に、細胞を室温で15分間インキュベートした。
MitoXpress Xtra 酸素消費アッセイでは、MitoXpress Xtra 試薬を 1 mL の脱イオン水で再構成し、37℃に加温した。ウェル底からセルが外れないように、完全な増殖培地で注意深く洗浄した。あらかじめ温めた完全増殖培地80μLを各ウェルに加え、プレートをプレートヒーターにプレーティングして37℃に平衡化した。再現性ピペットを用いて、10μLのMitoXpress Xtra試薬を、ブランクと指定されたウェルを除くすべてのウェルに添加し、代わりに10μLの水を添加した。トリプリケートウェルに10μLの10X化合物(FCCP、オリゴマイシン、アンチマイシンA)、または最終濃度0.1%のDMSOを封じ込めた水を加えた。各ウェルの上に100μLのHSオイルを加え、サンプルへの酸素の混入を制限した。その後、プレートをSpectraMax i3xリーダーに移し、SoftMax Proソフトウェア7.0.3以降で事前に設定したプロトコルを使用してデータ取得を開始した。
pH-Xtra解糖アッセイでは、まず測定前に、セルを37℃、湿度95%のCO2フリー条件下で2.5時間インキュベートした。その間に、pH-Xtra試薬を1mLの脱イオン水に溶解し、37℃に加温した。呼吸バッファー錠剤を50 mLの脱イオン水に溶解して呼吸バッファーを作製し、pHを7.4に調整した後、溶液をフィルター滅菌した。マイクロプレート内のセルを呼吸緩衝液で注意深く洗浄した。あらかじめ温めておいた80μLの呼吸緩衝液を各ウェルに加え、プレートをプレートヒーターにプレーティングして37℃に平衡化した。リピーターピペットを用いて、各ウェルに10μLのpH-Xtra試薬を加えた。10μLの10X化合物(2-デオキシグルコース、オリゴマイシン)、または0.1%DMSOを封じ込めた水を、トリプリケートで各ウェルに加えた。
データ収集と分析
TRF 検出カートリッジを用いたアッセイデータの取得には SpectraMax i3x リーダーを使用した。MitoXpress Xtra および pH-Xtra 試薬の TRF モードにおける最適な測定パラメータを表 1 に示す。リードあたり 100 パルスがこのアッセイに最適であることがわかった(データは示さず)。リーダーの温度は、測定の少なくとも 15 分前から 37℃に設定した。マイクロプレートをリーダーに挿入し、SoftMax Pro ソフトウェアを用いて、カイネティックデータのトレースを経時的強度として記録した。カイネティック測定は、45~200分間にわたって2~4分間隔で読み取るように設定した。各実験では、可能な限り短い間隔が選択された。
| パラメータ | pH-Xtra解糖アッセイ | ミトエクスプレス エクストラ 酸素消費アッセイ |
|---|---|---|
| 光学構成 | TRF-EUSA | |
| タイプを読む | カイネティック | |
| 波長(検出カートリッジに自動設定) |
Ex: 370 nm Em: 616 nm |
蛍光 Ex: 370 nm Em: 642 nm |
| プレーティングタイプ | 96ウェルスタンダードClrbtm | |
| PMT and optics | 積分時間:0.1 ms 励起時間: 0.05 ms パルス数: 100 測定遅延時間: 0.1 ms 読み取り高さ: 2.30 mm |
積分時間:0.1 ms 励起時間: 0.05 ms パルス数: 100 測定遅延時間: 0.03 ms 読み取り高さ: 2.30 mm |
| タイミング | 総走行時間:1~2時間 インターバル:2~4分 |
|
表 1. SpectraMax i3x リーダーでの MitoXpress Xtra および pH-Xtra アッセイに最適な設定。
データを Excel にエクスポートする前に、ソフトウェアでブランク補正を行った。エクセルの傾き関数を使用して、酸素消費(MitoXpress Xtra)または解糖活性(pH-Xtra)のレートを計算しました。勾配は、サンプルシグナル曲線の適切なセクションを調べるために、グラフの直線部分で決定した。
SoftMax Pro 7.0.3以降の互換性のあるMolecular Devicesプレートリーダーで使用するための設定済みプロトコルは、www.softmaxpro.org からダウンロードできます。リーダの推奨取得設定は、プロトコルのインストゥルメンテーション設定セクションに記載されています。データをソフトウェアで直接処理するには、カイネティックリダクションを使用して速度を計算する。カイネティックデータトレースの直線部分は、Reductionダイアログでラグとエンドタイムを手動で選択することで調整できる。
結果
ミトエクスプレス エクストラ 酸素消費アッセイ
最適なインストゥルメンテーションを評価するため、シグナル/ブランク比(S:B)とシグナル倍 率(F0:F)の両方を、無細胞カイネティック実験を用いて計算した。SpectraMax i3x リーダーは、図 1 に示すように、10 を超える S:B を達成した。シグナル倍数増加を決定するために、GOxを用いて脱酸素したGOxコントロール(F0)を測定した。このGOxコントロールは、酸素化シグナルコントロール(F)と比較して、シグナルが約3倍増加したことから、アッセイが正しく設定され、酸素欠乏を測定していることが示された。
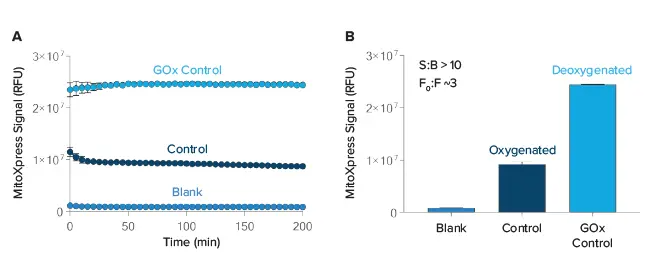
図1. ブランクに対するシグナルとシグナル倍数増加の測定。(A) ブランクウェルとコントロールウェルのシグナルトレースをプロットした。データトレースの平均値は、初期温度平衡化を避けるために15~20番目のデータポイントから計算し、(B)にプロットした。シグナル対ブランク比(S:B)およびシグナル倍数増加(F0:F)を計算した(n = 2, ± SD)。
細胞ベースアッセイを用いて、SpectraMax i3x リーダーと MitoXpress アッセイとの適合性を評価した(図 2)。セルを酸素消費に影響する 2 種類の化合物、オリゴマイシンと FCCP で処理した。未処理のセルでは、培地中の酸素が枯渇するにつれて MitoXpress Xtra シグナルが増加した。ATP合成酵素の阻害を介して酸素消費を減少させるオリゴマイシンで処理すると、未処理細胞よりも酸素消費が減少した(図2、オリゴマイシン)。FCCPは、ATP合成酵素からの呼吸複合体のカップリングを解除することによって酸素消費量を増加させ(図2、FCCP)、そのためFCCP処理細胞では未処理細胞よりも酸素消費速度が有意に高かった。
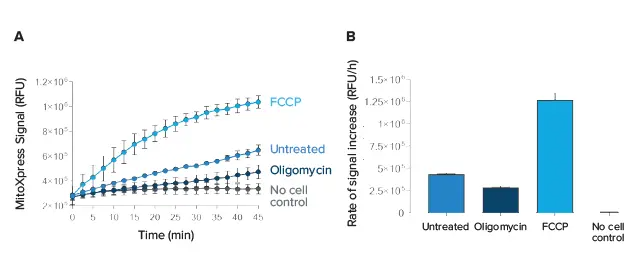
図 2. MitoXpress Xtraを用いた細胞ベース酸素消費アッセイ。(A)HepG2細胞に対するMitoXpress Xtra試薬のシグナルプロファイル。セルはオリゴマイシンとFCCPで処理した。(B)カイネティックの直線部分の傾きを取ることにより、速度を算出した(n = 3、± SD)。
pH-Xtra解糖アッセイ
MitoXpress Xtra アッセイと同様に、pH-Xtra Glycolysis アッセイでもシグナル/ブランク比を測定し、最適なリーダー設定を確認した。コントロールウェルでは、S:B 比が 100 より大きくなった(図 3)。シグナルコントロールは、呼吸バッファーの開始pHを表していた。MitoXpress Xtra と同様に、シグナルの倍数増加は GOx コントロールを用いて決定した。このコントロールは、グルコースと反応する際にバッファーを酸性化してH+イオンを生成する(図3)。シグナル倍数比は有意なシグナル増加(すなわち比 >3)を示し、アッセイが正しく設定され、酸性化を測定していることを示した。
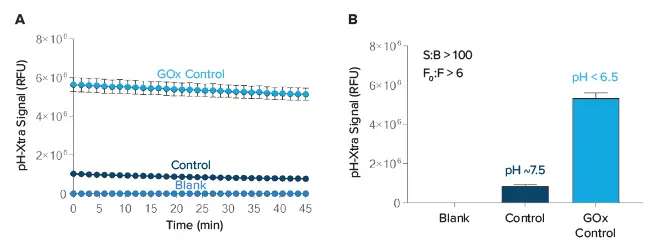
図3. pH-Xtraのシグナル対ブランクおよび最大強度の計算。シグナルトレース(A)はコントロールウェルとブランクについてプロットした。すべてのデータトレースの平均を15~20番目のデータポイントから計算し、(B)にプロットした。シグナル/ブランク比(S:B)、シグナル倍率(F0:F)を算出した(n = 2、± SD)。
pH-Xtra Glycolysis Assayの細胞外酸性化評価能力を図4に示す。細胞はオリゴマイシンと2-DGという細胞外酸性化を調節する2種類の化合物で処理した。オリゴマイシン処理は、ミトコンドリアのATP産生を阻害することによってpH-Xtraシグナルを増加させ(図4、オリゴマイシン)、セルが解糖系ATP産生を増加させることによってATPの損失を説明するようにした。2-DG処理は、グルコースのリン酸化を競合的に阻害することによりシグナル変化率を低下させ、解糖による乳酸産生を減少させた(図4、2-DG)。
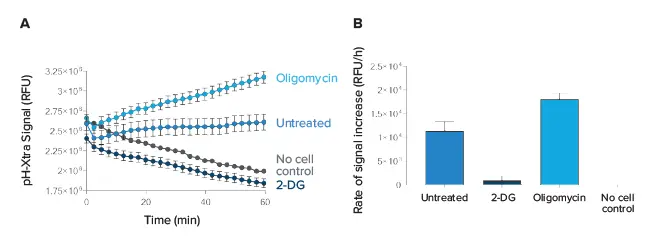
図4. 細胞ベースpH-Xtra解糖アッセイ。(A) pH-Xtra Glycolysis Assayを用いたHepG2細胞のTRFシグナルプロファイル。セルはオリゴマイシンまたは2-DGで処理した。(B)カイネティックトレースの直線部分の傾きを取ることにより、レートを算出した。速度はNo Cell Control(n=3、±SD)に補正した。
結論
SpectraMax i3x リーダーは、Agilent Technologies 社がアッセイに設定したシグナル性能基準を大幅に上回る性能を示し、ミトコンドリア機能と解糖系フラックスの解析のための細胞ベースアッセイの測定に成功しました。Molecular Devices プレートリーダー用の SoftMax Pro ソフトウェアプロトコルは、MitoXpress Xtra および pH-Xtra 用にあらかじめ設定されており、シグナル性能のテストだけでなく、アッセイデータの取得や解析にも使用できます。レートはExcelまたはSoftMax Proソフトウェアのシグナルプロファイルから直接生成でき、ソフトウェア内でグラフ化するためにさらに縮小したり、外部のグラフ作成ソフトウェア用に簡単にエクスポートすることができます。
PDF版(英語)