Application Note 定量的発光アッセイでウイルス誘発性細胞障害効果を測定
- 試薬添加後わずか10分で結果が得られる、混合して読み取るだけの簡単な方法
- スクリーニングに適した安定した高感度ルミネセンスリードアウト
- SoftMax Proソフトウェアでデータを作成し、結果を自動解析
PDF版(英語)
はじめに
ジョイス・イタタニ|アプリケーション・サイエンティスト|モレキュラー・デバイス
キャシー・オルセン博士|シニア・アプリケーション・サイエンティスト|モレキュラー・デバイス
哺乳類細胞のウイルス感染は、しばしば細胞の生存率を低下させ、形や大きさの変化、隣接細胞との融合など、細胞に目に見える影響を引き起こす。これらの変化は細胞病理効果(CPE)と呼ばれ、光学顕微鏡や画像システムを用いて評価したり、より定量的な手段を用いて測定したりすることができる。
プロメガ社のVirusal ToxGlo Assay Kitは、生存細胞に存在する細胞性ATPを測定し、ルミネッセンスリードアウトで細胞生存率を定量する簡単な方法を提供する。ウイルス誘発性CPEによるATPの枯渇は、発光シグナルの減少につながり、宿主細胞におけるウイルス誘発性CPEの定量を可能にする。ミックス&リードのシンプルなワークフローにより、アッセイ結果はSpectraMax® iD5 Multi-Mode Microplate Readerで容易に検出され、SoftMax® Proソフトウェアを用いて解析されます(図1)。
ここでは、Viral ToxGloアッセイを使用して、ウイルスに感染した哺乳類細胞におけるウイルス感染性および組織培養感染量(TCID50)を測定する方法と、化合物の抗ウイルス効力を測定する方法を示します。ここで紹介する研究は、これまでに報告されている2つのウイルス感染モデルを用いて行われた: マディンダービー犬腎臓(MDCK)細胞をインフルエンザA(H1N1)ウイルスに感染させ1、MRC-5ヒト肺線維芽細胞をヒトコロナウイルス229E株(HCoV-229E)に感染させた2。抗ウイルス作用を示す2つの化合物であるリバビリン3およびレムデシビル4をウイルス曝露細胞に適用し、それぞれの抗ウイルス力を測定した。
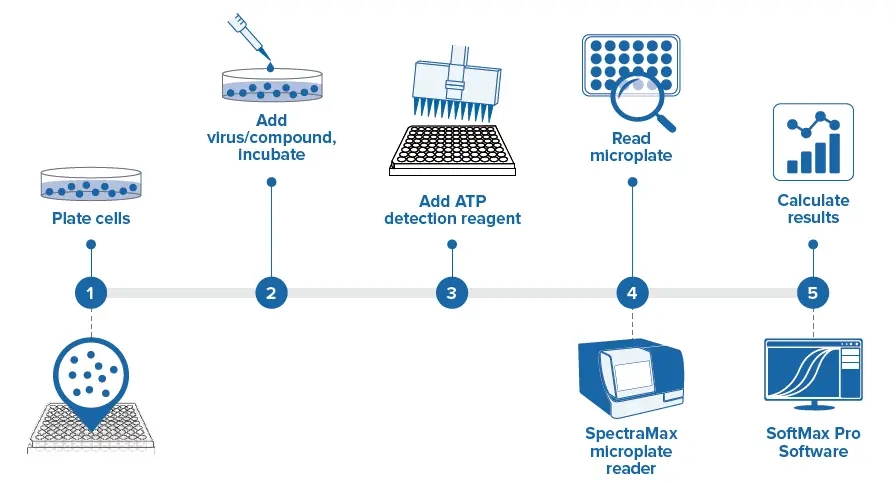
図1. Viral ToxGloアッセイのワークフロー。
材料
- Viral ToxGlo Assay Kit (プロメガ社製 cat. #G8942)
- MDCK(NBL-2)細胞株(ATCC cat.)
- MRC-5細胞株(ATCC cat.)
- 増殖培地(MDCKおよびMRC-5用): MEM(Corning cat. #10-010-CV)+10%ウシ胎児血清(FBS、Avantor® Seradigm cat. #1500-500)+ペニシリン/ストレプト
- マイシン(Thermo Fisher cat. #15070-063)
- インフルエンザAウイルス(H1N1)、(ATCC cat.)
- ヒトコロナウイルス 229E (ATCC cat. #VR-740) 蛍光偏光(FP-FLUO)検出カートリッジ(Molecular Devices cat. #0200-7009
- リバビリン(Sigma cat.)
- レムデシビル(MedChemExpress cat.)
- 96ウェル白色組織培養処理クリアボトムマイクロプレート (Corning cat. #3610)
- Nunc白色シールテープ (ThermoFisher cat. #236272)
- SpectraMax iD5 マルチモードマイクロプレートリーダー(Molecular Devices社製)
測定方法
TCID50の測定
ウイルス感染性と組織培養感染量(TCID)は、ウイルスストックの連続希釈液を調製し、これを標的細胞に加え、指定された曝露時間をかけて測定した。暴露終了後、Viral ToxGloアッセイを用いて、細胞生存率の指標となるATPを測定した。TCID50または50%細胞病理効果(CPE)は、測定された細胞生存率を50%減少させるウイルス希釈度である。この値は、その後の抗ウイルス剤の効力に関する研究に用いられた。
細胞は、底が透明な96ウェルの白色マイクロプレートに10,000細胞/ウェルでプレーティングした。細胞は37℃、5%CO2で一晩付着増殖させた。ウイルスストックの最初の1:1000(H1N1)または1:5(HCoV-229E)希釈を培地で行った。最初のウイルス希釈液46μLをカラム1のウェル(初期容量100μL/ウェル)に添加することにより、セルプレートで半対数(3.16倍)連続希釈を行った。その後、46μLをカラム1からカラム2に移し、さらにカラム10まで移した。その後46μLをカラム10から除去し、すべての実験ウェルの容量を100μL/ウェルに維持した。ウイルス無添加と細胞無添加のコントロールウェルも含まれる。細胞をウイルスとともに37℃、5%CO2で3日間(MDCK/H1N1)または6日間(MRC-5/HCov-229E)インキュベートした。
細胞障害作用はViral ToxGloキットを用いて測定した。3日間または6日間のウイルス処理の最後に、ATP検出試薬をアッセイウェルに添加し、プレートを室温で10分間インキュベートして細胞を溶解させた。発光シグナルを最大にするため、読み取り前に各クリアボトムマイクロプレートの底にNuncの白色シーリングテープを貼った。SpectraMax iD5リーダーで、表1に示す設定を用いてプレートを読み取った。
| パラメータ | 設定値 |
|---|---|
| 読み取りモード |
発光 |
| 読み取りタイプ | 終点 |
| 波長 | 全波長 |
| プレートタイプ | 96ウェルコスター |
| PMTおよび光学系 |
積分時間:1000ms 読み取り高さ:1.12 mm |
| その他の設定 | 読み取り前の最適化オプションを表示 |
表 1. Viral ToxGlo アッセイ用の SpectraMax iD5 リーダー設定。設定はSoftMax Proソフトウェアのプレートセクションで指定する。Read Heightは、More Settingsの「Show Pre-Read Optimization Options」の横のボックスをチェックし、読み取りを開始すると表示される指示に従って最適化する。
結果は、SoftMax Proソフトウェアの4パラメータ曲線フィットを用いて、RLU対ウイルス希釈倍率としてプロットし、これらの曲線からそれぞれの細胞株における各ウイルスのTCID50値を求めました(図2)。H1N1ウイルス株の999,000倍希釈はMDCKの生存率を50%低下させたが、HCoV-229Eウイルス株の43倍希釈はMRC-5細胞で同様の生存率低下をもたらした。
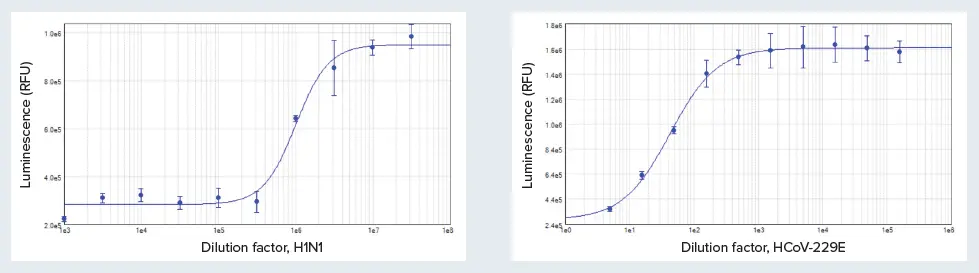
図2. MDCK細胞上のH1N1ウイルスの濃度反応曲線(A)およびMRC-5細胞上のHCoV-229Eの濃度反応曲線(B)。TCID50は、H1N1では1:999,000、HCoV-229Eでは1:43の希釈で観察された。
化合物の抗ウイルス力の測定
化合物リバビリンとレムデシビルのウイルス処理細胞に対する細胞障害作用の軽減効果を評価するために、MDCK細胞またはMRC-5細胞を、底が透明な96ウェルの白色マイクロプレートに、50μLの培地中に1ウェル当たり10,000細胞ずつプレーティングした。培地のみを含む無細胞のコントロールウェルも含まれた。細胞は37℃、5% CO2インキュベーター内で一晩接着させ、増殖させた。
MDCK細胞には、1000μMから0.02μMまでのリバビリンの1:3連続希釈液を25μL添加した。MRC-5細胞には、17μMから0.003μMまでのレムデシビルの1:3連続希釈液を25μL添加した。TCID50を超える最適な細胞障害効果を与えるストックウイルスの希釈液(H1N1では1:1000、HCov-229Eでは1:5)を、それぞれウェルあたり25μLの量でMDCK細胞またはMRC-5細胞に添加した。化合物のオフターゲット細胞毒性を測定するために、上記と同じ化合物希釈系列を用いて、リバビリンまたはレムデシビルをウイルスのない細胞に添加した。処理した細胞プレートを37℃、5%CO2で3日間(MDCK)または6日間(MRC-5)インキュベートした。
ウイルスと化合物とのインキュベーション後、Viral ToxGlo ATP検出試薬をアッセイウェルに添加し、プレートを室温で10分間インキュベートして細胞を溶解させた。SpectraMax iD5リーダー(設定、表1)で発光シグナルを読み取る前に、透明底のマイクロプレートの底にNuncの白色シールテープを貼った。
結果は、SoftMax Proソフトウェアの4パラメータ曲線フィットを用いて、RLU対化合物濃度としてプロットし、曲線から各化合物のEC50値を求めた。リバビリンは、H1N1ウイルスに暴露したMDCK細胞の生存率を部分的に回復させ、そのEC50は89 μMであった(図3A)。しかし、ウイルスを含まないリバビリン単独で処理した細胞では、100μMを超えると毒性作用が観察された。HCoV-229Eに暴露されたレムデシビル処理MRC-5細胞の生存率はほぼ完全に回復し、EC50値は215 nMであった(図3B)。レムデシビルのオフターゲット効果は最小で、16μM以上でのみ見られた。
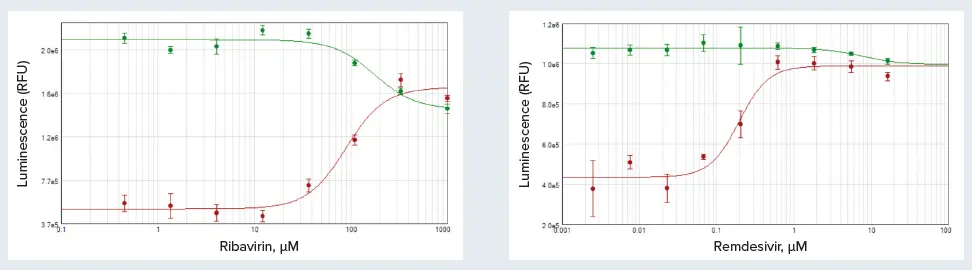
図3. MDCK単独またはH1N1ウイルス処理(A)およびMRC-5単独またはHCoV-229Eウイルス処理(B)に対するリバビリンのオフターゲット(緑)およびオンターゲット(赤)効果。リバビリンEC50 = 89 μM、レムデシビルEC50 = 215 nM。
結論
ウイルス感染による細胞生存率への影響を、時間のかかる顕微鏡で評価するのとは対照的に、Viral ToxGloアッセイは、混ぜて読むだけの簡単な形式を提供する。検出と結果の解析は、処理細胞に試薬を添加してからわずか10分後に行うことができる。SpectraMax iD5リーダーはこのアッセイの高感度検出を提供し、SoftMax Proソフトウェアは抗ウイルス化合物のオンターゲットおよびオフターゲット効果だけでなく、TCID50を簡単に決定することができる。
参考文献
- Niles, A et al. Determine Viral-Induced Cytopathic Effect Using a Luminescent Assay: https://www.promega.com/ resources/pubhub/determine-viral-induced-cytopathic-effectusing- a-luminescent-assay/
- Funk, CJ et al. Infection of human alveolar macrophages by human coronavirus strain 229E. J. Gen. Virol. (2012), 93, 494–503
- Khalili, JS et al. Novel coronavirus treatment with ribavirin: Groundwork for an evaluation concerning COVID-19. J. Med. Virol. 2020; 1–7.
- Parang, K et al. Comparative antiviral activity of remdesivir and anti-HIV nucleoside analogs against human coronavirus 229E (HCoV-229E). Molecules 2020, 25, 2343.
PDF版(英語)