Application Note SPECTRAmax® GEMINI-XS 分光蛍光光度計における
緑色蛍光タンパク質の測定
PDF版(英語)
はじめに
Simon Lydford1, Thomas Giller2, 1Molecular Devices Limited, 2Axovan Ltd.
GFP(Green Fluorescent Protein)は、クラゲのオワンクラゲ1が産生する238アミノ酸からなる極めて安定なタンパク質で、可視スペクトルの低緑色領域で蛍光を発する。ここ数年、GFPは分子生物学や細胞生物学で最も広く使われているツールのひとつとなっている。さらに、GFPは追加の基材を必要とせず、非常に可視的な蛍光を発することができるため、遺伝子発現のマーカーとして、細胞系譜のトレーサーとして、あるいは侵襲的で扱いにくい蛍光染色技術に代わる生体内共有結合蛍光標識として利用されている。GFPは非侵襲的にモニターすることができ、生細胞における定量的マーカーとして使用することができる。GFPはまた、細胞内でのタンパク質-GFPキメラの局在や移動をリアルタイムで研究するためのタグとしても使用できる2。
しかし、GFPの使用にはいくつかの技術的な困難があった。一つの大きな懸念は、タンパク質の励起と発光スペクトルである。野生型GFPには2つの励起ピークがあり、395nm(長紫外域)に大きな励起ピーク、475nm(青色)に小さな励起ピークがあり、509nm(緑色)に発光ピークがある。野生型GFPの場合、395nmでタンパク質を励起すると、蛍光が急速に消光することがわかっている。最近、GFP遺伝子のいくつかの改変型が、異なるスペクトル特性を持つようになった。例えば、主要な励起ピークは490nmにレッドシフトされ、発光ピークは509nmにとどまっている。おそらくより重要なことは、これらの修飾は一般に蛍光出力を増加させることである3。
GFPシグナルは弱く、特に低レベルで発現している場合には検出しにくいので、蛍光セルは通常、レーザー走査型共焦点顕微鏡や同様の機器を用いて観察される。シグナルが弱いため、スループットを向上できるマイクロプレート分光蛍光光度計では使用できません。Spectramax® Gemini-XS は高感度光学系4 を組み込んだデュアルモノクロメーター・マイクロプレート蛍光光度計システムであり、低レベルの検出限界での実験決定を可能にします。このアプリケーションノートでは、分光蛍光光度計 Gemini-XS を使用して、96 ウェルマイクロプレート内で緑色蛍光タンパク質(GFP)を発現している比較的少数のセルを検出できる実験プロトコルを説明します。
材料と方法
ヒト胚性腎臓293細胞(HEK-293)に、野生型GFP発現プラスミド(pS65T, Clontech, 販売終了品; サイトメガロウイルス即時型初期プロモーターがGFPの発現を促進する)を、Lipofectamineを用いて、製造者の指示に従って一過性にトランスフェクトした(Gibco/Invitrogen, Cat. No. 18324-012)。セルは、標準的な細胞培養条件下で、162cm2のフラスコでコンフルエ ンスまで増殖させた。蛍光顕微鏡で観察したところ、発現レベルは75%以上であった。
GFP発現細胞をトリプシンで除去し、培地(MEM Alpha、Gibco-RBL Cat.No.22571-020)で洗浄した。96ウェルマイクロプレート(ウェルCostar、黒壁透明底、Cat.No.3603)のカラムに適当な数の細胞を交互に播種し、モックトランスフェクション細胞で希釈して、ウェルあたりの細胞数を200,000個に一定に保った。その結果、最終的に100μlの容量で、1ウェル当たり6,250個(カラム12)から200,000個(カラム2)のGFP発現細胞が得られた。これらのセルは、カラム2、4、6、8、10、12に交互に播種した。一方、カラム1、3、5、7、9、11には、ウェル当たり20万個のモックトランスフェクト細胞を播種した。その後、プレートを48時間インキュベーターに戻した。
最初に、最大S/B比を得るための最適な励起波長と発光波長/カットオフフィルターの組み合わせを選択するために、励起と発光のスキャンを実行した5。以後のすべての実験で選択されたパラメータは以下の通りである: GFP; λΕX - 472 nm、λΕM - 512 nm、495 nmの発光カットオフフィルター。
結果
その結果、蛍光強度と細胞数の間には直線的な関係があることが示されました(図 1)。SpectraMax Gemini-XS分光蛍光光度計は、一元配置分散分析(ANOVA)により決定されたように、すべての細胞数で特異性GFPシグナルを検出することができました(表1)。この分析により、48時間培養後、1ウェル当たり6,250 GFP発現細胞の初期播種密度で、GFPトランスフェクト細胞とモックトランスフェクト細胞の間に有意差(P < 0.01)があることが示された(表1)。細胞の約75%が実際にGFPを発現しているので、これはおよそ4,690 GFP発現細胞/ウェルの検出限界に相当する。
| ウェルあたりのGFP発現細胞の初期数 | ||||||
|---|---|---|---|---|---|---|
| 200,000 | 100,000 | 50,000 | 25,000 | 12,500 | 6,250 | |
| GFP発現細胞からのシグナル 発現セルからのシグナル (RFU) |
177 ± 9 | 106 ± 10 | 71 ± 5 | 51 ± 3 | 44 ± 2 | 39 ± 4 |
| 200,000 | 200,000 | 200,000 | 200,000 | 200,000 | 200,000 | |
| シグナル 模擬トランスフェクトからのシグナル セルからのシグナル(RFU) |
30 ± 1 | 29 ± 2 | 31 ± 1 | 32 ± 2 | 34 ± 2 | 32 ± 2 |
| ANOVA P値 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 | < 0.01 |
表1:トランスフェクト細胞内でのGFP検出の特異性と感度。データはGFP発現セルとモックトランスフェクトセルから検出された相対蛍光単位(RFU)。データは平均RFU±標準偏差、n=8で記載。
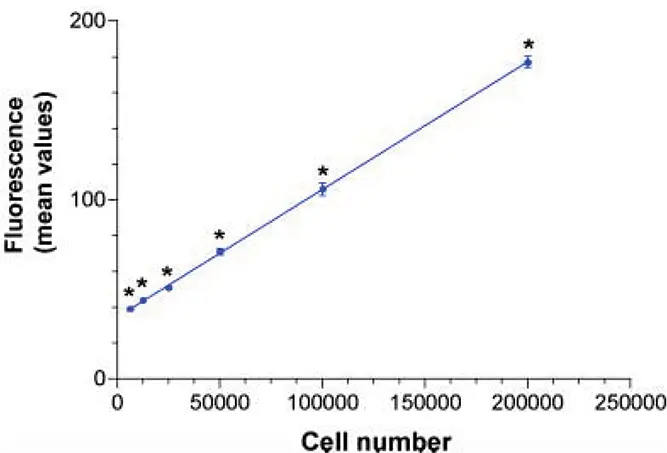
図1:トランスフェクト細胞内でのGFP検出の直線性と感度。細胞はMaterials and Methodsの記載に従って連続希釈した。アスタリスクは、モックトランスフェクト細胞とGFP発現(-)細胞間の有意差を示す。データは平均RFU±標準偏差、n=8で示す。
GFP発現細胞の懸濁液と比較して、1μMフルオレセイン溶液を検出する能力について、2種類のマイクロプレートを比較するために一連の実験がデザインされた(表2)。興味深いことに、フルオレセインシグナルはGreinerプレートの11190RFUからABgene Thermo-Fast® 96スカート付きブラックPCRプレートの32787RFUに増加した(カタログ番号AB-0800、プレーティング時にブラックを指定)。さらに重要なことは、ABgeneの黒色PCRプレートを用いた場合、GFP発現細胞から検出されるシグナルがほぼ3倍増加したことである(表2)。黒いPCRプレートを用いて検出可能なシグナルが大きくなった理由として、PCRプレートの各ウェルの底面が高く、ウェルが標準マイクロプレートよりも狭いことが考えられます。この特徴はサンプルを光学系に近づけ、一定の体積で効果的に光路長を増加させる。
| フルオレセイン(150 µl) | セル懸濁液(100 µl) | バッファー(100 µl) | |
|---|---|---|---|
| グライナー フロロスター | 11190 ± 36 | 17.1 ± 0.5 | 0.25 ± 0.03 |
| AB遺伝子サーモファスト | 32787 ± 179 | 46.4 ± 1.9 | 0.80 ± 0.07 |
| シグナルが1倍増加 | 2.9 | 2.7 | 3.2 |
表2:2種類のマイクロプレートで得られた蛍光シグナルの比較。フルオレセイン溶液とGFP発現細胞懸濁液からのシグナルをGreinerプレートとABgeneプレートで比較した。代表的なデータは平均RFU±標準偏差(S.D.)、n=8で示した。
ディスカッション
GFPとその変異体は、色素や検出抗体などの二次試薬とインキュベートする必要がないため、生きたセルにおける遺伝子発現やタンパク質の局在を蛍光検出するのに便利なマーカーである。さらに、これらの蛍光タンパク質をコードするベクターは、単純なトランスフェクションマーカーとしても一般的に使用されている。さらに、GFP蛍光は安定しており、生物種に依存せず、基質や補酵素を必要としない。ライフサイエンスや創薬研究においてGFPの利用が急増しており、ハイスループットに対する要求がますます高まっているため、蛍光活性化セルソーティング(FACS)や蛍光顕微鏡などの従来の検出技術では、もはや要求を満たすことはできない。アッセイを96ウェルマイクロプレート技術に移行することで、スループットは大幅に向上します。
本レポートでは、デュアル・スキャニングモノクロメーターと特許取得済みの光学感度を備えたSpectraMax Gemini-XSマイクロプレート分光蛍光光度計が、比較的少ない数のGFP発現セルの検出に使用できることを実証しています。レンズの代わりに楕円ミラーを使用した特許取得済みの光学設計により、感度とデータの再現性が向上している。初期播種密度6,250 GFP発現細胞/ウェルでも、Gemini-XSはモックトランスフェクション細胞より1.2倍増加したシグナルを確実に検出することができます。SpectraMax Gemini-XSは実験中に最大4つの異なる波長をモニターできるため、Clontech Living Colors™ Fluorescent Proteinsのような多色標識実験に使用できます。
蛍光タンパク質を用いた SpectraMax Gemini-XS の実用的な用途としては、細胞のアポトーシスやネクローシスの識別(アポトーシスによる蛍光の減少6 )、細菌の生存率の測定7 、あるいは細胞の生存率/ゲノムの安定性に関与する相同 DNA 組換え修復の測定8 などが考えられます。
謝辞
貴重なご意見とコメントをいただいたスイス、バーゼルのPaul Bucher CompanyのGeorg Kienzle博士とMolecular Devices CorporationのAnne T. Ferguson博士に感謝する。
特許取得済み
変異体緑色蛍光タンパク質(GFP)またはそのタンパク質をコードするDNA配列を封じ込めた製品は、米国特許第5,625,048号、同第5,777,079号、同第5,804,387号およびその他米国内外の特許出願中であるため、オーロラ・バイオサイエンス社からのライセンスが必要です。営利を目的としない研究機関や団体で、本製品を非商用または営利目的で使用する場合は、オーロラ・バイオサイエンス社からライセンスを受ける必要があります。
- Morise, H., Shimomura, O., Johnson, F.H. & Winant, J. (1974). オワンクラゲの生物発光系における分子間エネルギー移動。生化学, 13(12): 2656-2662.
- Milligan, G. (1999). 緑色蛍光タンパク質を用いたGタンパク質共役型受容体の制御ダイナミクスの探索。Br. J. Pharmacol., 128: 501- 510.
- Cubitt, A.B., Heim, R., Adams, S.R., Boyd, A.E., Gross, L.A. & Tsien RY. (1995). 緑色蛍光タンパク質の理解、改良、利用。Trends Biochem. Sci., 20(11): 448-455.
- SPECTRAMAX ® Gemini XS 製品文献
- McGown, E.L. (1999). SPECTRAmax ® GEMINI マイクロプレート分光蛍光光度計を用いた励起および発光波長の選択 - 基本原理。MAXline アプリケーションノート 30。
- Strebel, A., Harr, T., Bachmann, F., Wernli, M. & Erb, P. (2001). アポトーシスとネクローシスを測定する新しいツールとしての緑色蛍光タンパク質。Cytometry, 43(2): 126-133.
- Dykes, G.A., Moorhead, S.M. & Roberts, S.L. (2001). 大腸菌157:H7およびサルモネラ菌の、冷蔵保存された真空または炭酸ガスパックされたプライマル・ビーフカット上での生存率。Int. J. Food Microbiol: 401-405.
- Slebos R.J. & Taylor, J.A. (2001). ヒト癌細胞株における相同組換え能力を評価するための新しい宿主細胞再活性化アッセイ。Biochem. Biophys. Commun., 281(1): 212-219.
PDF版(英語)