Application Note SpectraMax iD3リーダーによる
細胞生存能アッセイで細胞の健康状態を測定する
- SpectraMax iD3リーダー用に完全に最適化されたアッセイにより、アッセイ開発時間を短縮
- シンプルでホモジニアスなワークフローにより、セルハンドリングを最小化
- 高解像度のタッチスクリーンにより、メソッドの迅速なセットアップが可能
- SoftMax Proソフトウェアの設定済みプロトコルにより、データ解析が迅速化
PDF版(英語)
はじめに
生存率とアポトーシス経路という多角的な視点から細胞の健全性を 測定することで、薬剤候補、経路活性化剤と阻害剤、レポーター遺伝子な ど、様々な実験的治療の影響についての洞察を得ることができる。
細胞の健全性をアッセイする最も一般的な方法の一つは、マイクロプレートリーダーを用いた蛍光検出である。このアプリケーションノートでは、SpectraMax® iD3 マルチモードマイクロプレートリーダーでのEarlyTox™ Cell Viabilityアッセイキット一式の使用について報告します(図1)。
図1. 細胞生存率アッセイの代表的な実験ワークフロー。
アーリートックス生死判定キット
このキットには、哺乳類細胞での使用に適した、生細胞用または死細胞用の2種類のマーカーが封入されています。カルセインAMは広く使用されている生細胞マーカーである。非蛍光性のカルセインAMは無傷の細胞膜を透過し、細胞内のエステラーゼによって蛍光性のカルセインに変換される。生細胞は細胞質内で強い緑色蛍光で染色される。細胞増殖アッセイや、生細胞染色のみを必要とするその他のアッセイでは、EarlyTox™ Live Cell Assay Kit(Explorer キットは P/N R8342、Bulk キットは P/N R8343)に含まれるように、カルセイン AM を単独の試薬として使用することができます。
エチジウムホモダイマー-III(EthD-III)は実質的に無蛍光で、無傷の細胞膜に対して不透過性です。細胞膜の完全性が損なわれ、細胞死に至ると、EthD-IIIは細胞内に侵入し、核酸と結合する。細胞膜の完全性に影響を及ぼす細胞毒性イベントは、この方法を用いて正確に評価できる。
カルセインおよびEthDIIIからの蛍光シグナルは、SpectraMax iD3リーダーを使用して検出でき、SoftMax® ProソフトウェアのEarlyTox Live Dead事前設定プロトコルを使用して迅速に解析できます。
EarlyToxグルタチオンアッセイキット
このキットは、GSHに高い親和性を持つ細胞透過性色素モノクロロビマン(MCB)を用いて、細胞のGSHレベルを検出します。この色素とGSHとの反応は、内因性のグルタチオン転移酵素(GST)酵素によって触媒され、394 nmで励起、490 nmで発光する青色蛍光を生じる。蛍光強度は、細胞内に存在するGSHの量に対応し、アポトーシスとともに増加する。代表的な競合アッセイとは異なり、EarlyToxグルタチオンアッセイは、マイクロプレートフォーマットで生きたインタクトな細胞に使用することができ、細胞の採取や遠心分離、溶解など、結果のばらつきにつながる時間のかかる操作を必要としません。SoftMax Proソフトウェアでのインストゥルメンテーションと解析は、設定済みのEarlyTox Glutathioneプロトコルを用いて簡素化されます。
EarlyToxカスパーゼ-3/7 R110アッセイキット
EarlyTox Caspase-3/7 R110 Assay Kitは、マイクロプレートリーダー用に特異的に設計されたシングルステップの均一性アッセイを提供します。蛍光基材(Ac-DEVD)2-R110は2つのDEVDコンセンサス標的配列を含み、細胞溶解液中で酵素により2つのステップで完全に加水分解される。両方のDEVDペプチドの加水分解により、緑色蛍光色素ローダミン110(R110)が放出され、490 nmで励起、520 nmで発光し、蛍光が大幅に増加する。簡略化されたワークフローは、このようなアッセイに通常必要とされるセル数を削減し、また複数のステップで通常遭遇する変動性も削減します。設定済みのEarlyTox R110取得および解析プロトコルは、SoftMax Proプロトコルライブラリに含まれています。
材料
- EarlyTox™ 生死判定アッセイキット
⚪︎エクスプローラーキット(2プレートサイズ、Molecular Devices P/N R8340)
⚪︎バルクキット(10プレートサイズ、Molecular Devices P/N R8341) - EarlyTox™グルタチオンアッセイキット
⚪︎エクスプローラーキット(2プレートサイズ、Molecular Devices P/N R8344)
⚪︎バルクキット(10プレートサイズ、Molecular Devices P/N R8345) - アーリートックス™カスパーゼ-3/7 R110アッセイキット
⚪︎エクスプローラーキット(2プレートサイズ、Molecular Devices P/N R8346)
⚪︎バルクキット(10プレートサイズ、Molecular Devices P/N R8347) - HeLa細胞(ATCC P/N CCL-2)
- スタウロスポリン(Sigma P/N S5921)
- 96ウェル黒色透明底マイクロプレート(Corning P/N 3904)
- SpectraMax iD3マルチモードマイクロプレートリーダー
方法
セル治療
HeLa細胞を、黒色透明底マイクロプレートに、1ウェル当たり100μLで20,000個プレーティングした。37℃、5%CO2インキュベーター内で一晩接着させ、増殖させた。その後、アポトーシスを誘導するためにセルを処理した。Live/Deadアッセイでは、10μMから40nMまでのスタウロスポリンの1:2希釈液で24時間処理した。グルタチオンとカスパーゼ-3/7 R110アッセイでは、5μMから5nMまでのスタウロスポリンの1:2希釈液で4時間処理した。各濃度で4レプリケートした。
アーリートックス生死判定キット
カルセインAMとEthD-IIIのストック溶液をPBSに加え、各染料の濃度が6 µMになるように、カルセインAM/EthD-IIIの2X作業溶液を調製した。各アッセイウェルに100 µLの2X作業溶液を加え、最終容量を200 µLとし、各染料の最終濃度を3 µMとした。プレートを室温で1時間インキュベートした。その後、SpectraMax iD3リーダーで、SoftMax Proソフトウェアであらかじめ設定したプロトコルを用いて、表1に示す設定で上下から読み取った。注:培地を除去した後、カルセインAMおよびEthD-IIIの1X溶液を添加することは任意であり、必要に応じてバックグラウンド蛍光を減少させるのに役立つ。
SoftMax Proソフトウェアにあらかじめ設定されたEarlyTox Live Deadアッセイプロトコルは、緑/赤比を自動的に算出し、化合物濃度に対してプロットします。このプロトコールは、そのような分析が必要な実験細胞サンプル中の生細胞と死細胞のパーセンテージを計算することができます。このような計算を行うには、アッセイプレートにコントロールを追加設定する必要があります。
EarlyToxグルタチオンアッセイキット
10mMのMCB原液20μLを10mLのPBSで希釈し、20μMのMCB作業溶液を調製した。アッセイプレート内のセルから培地を除去し、100μLのMCB作業溶液で置換した。細胞を37℃でインキュベートした。試薬添加の1時間後と2時間後に、表1に示した設定を用いて、蛍光強度をSpectraMax iD3リーダーで測定した。
| パラメータ | アーリートックス・ライブ/デッド | アーリートックス・グルタチオン | アーリートックス カスパーゼ-3/7 R110 |
|---|---|---|---|
| Read mode | 蛍光 | 蛍光 | 蛍光 |
| Read mode | エンドポイント | エンドポイント | エンドポイント |
| 波長 |
Lm1: Ex = 495 nm, Em = 530 nm Lm2: Ex = 530 nm, Em = 645 nm |
Ex = 394 nm, Em = 490 nm | Ex = 470 nm, Em = 520 nm |
| PMT and Optics | PMTゲイン: 自動 積分時間: 500 ms 下方測定を行う |
PMTゲイン: 自動 積分時間: 500 ms 下方測定を行う |
PMTゲイン: 自動 積分時間: 500 ms 下方測定を行う |
表1. SpectraMax iD3マルチモードマイクロプレートリーダーの設定。蛍光検出機能を持つ他のSpectraMaxリーダーでも同様の設定が可能です。
EarlyToxカスパーゼ-3/7 R110アッセイキット
基質アッセイバッファーは、細胞溶解/アッセイバッファーに酵素基質(AC-DEVD)2-R110(2 mM)を50 µL/1mLの割合で加えて調製した。各ウェルに100 µLの基質アッセイバッファーを加え、最終容量を200 µLとし、最終濃度を50 µMの基質とした。その後、サンプルを室温でインキュベートした。試薬添加1時間後と2時間後に、SpectraMax iD3リーダーで、表1に示す設定を用いて蛍光を測定した。
結果
アーリートックス生死判定キット
スタウロスポリンで処理したHeLa細胞は明確な濃度応答を示し、これは生細胞(緑色蛍光)と死細胞(赤色蛍光)のシグナルの比として容易に定量化できた(図2)。全体的に、RFU値は1時間インキュベートしたセルよりも2時間インキュベートしたセルの方が高かった(データは示さず)。データの4パラメータカーブフィット処理から算出したEC50値は300 nMであった。
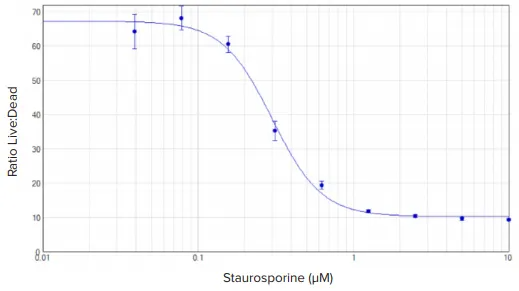
図2. EarlyTox 生死アッセイ:スタウロスポリンで24時間処理したHeLa細胞の濃度応答曲線。セルをカルセインAMおよびEthD-III中で1時間インキュベートした。濃度曲線は、赤色(645 nm発光)RFUに対する緑色(530 nm発光)RFUの比率をY軸としてプロットした。SoftMax® Proソフトウェアで4パラメータカーブフィットを行った。EC50値は300 nMであった。
EarlyToxグルタチオンアッセイキット
スタウロスポリンで4時間処理したHeLa細胞は、アポトーシスに伴う細胞内グルタチオンの減少を示し、EarlyTox Glutathione assayを用いて測定した。スタウロスポリン濃度の増加に伴う蛍光の減少は、SpectraMax iD3リーダーで検出された。結果は、SoftMax Proソフトウェアで4パラメータカーブフィットを用いてグラフ化した。蛍光強度値は時間の経過とともに増加したが、アッセイ インキュベーション時間が1時間から2時間の範囲で、同様のEC50値 263 nMと295 nMが得られた(図3)。
EarlyToxカスパーゼ-3/7 R110アッセイキット
スタウロスポリンで4時間処理したHeLa細胞はアポトーシス反応を示し、EarlyTox Caspase-3/7 R110アッセイを用いて測定した。アポトーシス細胞に対応する蛍光は、SpectraMax iD3リーダーで検出した。結果は、SoftMax Proソフトウェアで4パラメータカーブフィットを用いてグラフ化した。細胞基材中で1時間または2時間インキュベートしたセルのEC50値は、193 nMと200 nMで類似していた(図4)。
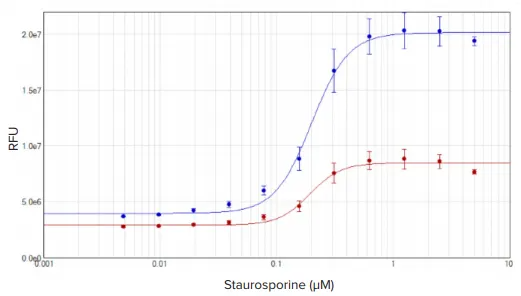
図4. EarlyTox Caspase-3/7 R110アッセイ:スタウロスポリンで4時間処理したHeLa細胞の濃度反応曲線。細胞を試薬中で1時間(赤プロット)または2時間(青プロット)インキュベートした。濃度曲線は、SoftMax® Proソフトウェアの4パラメータカーブフィットを用いてプロットした。EC50値はそれぞれ193 nMと200 nMであった。
結論
SpectraMax iD3リーダーと併用することで、EarlyTox細胞生存能アッセイキットは、シンプルなワークフローとマイクロプレートフォーマットによるスループットの向上により、生細胞と死細胞またはアポトーシス細胞の直接測定を可能にします。ワークフローの柔軟性を提供し、長期間にわたって一貫した結果が得られます。SoftMax Pro ソフトウェアのプロトコルは事前に設定されているため、インストゥルメンテーションの設定が最適化され、自動データ解析により結果を得るまでの時間が短縮されます。
SpectraMax iD3マルチモードマイクロプレートリーダー
SpectraMax iD3リーダーは、大型で高解像度のタッチスクリーンインターフェースと内蔵ソフトウェアパッケージを備えており、ユーザーによるカスタムプロトコルのセットアップ、プリロードされたプロトコルの使用、専用コンピュータワークステーションを必要としない実験の実行が可能です。内蔵型近距離無線通信(NFC)機能により、カスタムプロトコルや結果にワンタップでアクセスでき、貴重な時間を節約できる。
PDF版(英語)