Application Note SpectraMax Glo Steady-Lucレポーターアッセイキットを用いた
ルシフェラーゼ発現測定
- グローベースのルミネセンスは、スクリーニングアッセイにおいてプレートのバッチ処理を可能にするシグナルタイムウィンドウを拡張します。
- SpectraMax発光マイクロプレートリーダーに最適化
- SoftMax Proソフトウェアの設定済みプロトコールにより、データ取得および解析を簡素化
PDF版(英語)
はじめに
ルシフェラーゼのような遺伝子レポーターを使用すると、遺伝子発現を高感度で非破壊的にモニタリングすることができます。61kDの単量体タンパク質であるホタルルシフェラーゼは、その高感度、広い直線検出範囲、および哺乳類細胞に内因性発光活性がないことによる極めて低いバックグラウンドのため、多くの研究者にとって特に魅力的です。ルミネッセンスマイクロプレートリーダーを用いたアッセイでは、ハイスループット対応の "グロー "アッセイが、複数のプレートのバッチ処理に好まれることが多い。このアプリケーションノートでは、発光シグナルが長時間持続するSpectraMax®Glo Steady-Luc™ Reporter Assay Kitを用いたCHO-K1細胞におけるルシフェラーゼ発現の測定を示します。このアッセイキットは、SpectraMax®i3xマルチモードマイクロプレートリーダー用に最適化されており、SoftMax®Proソフトウェアであらかじめ設定されたプロトコールにより、迅速なデータ解析が可能です。
材料
- SpectraMax Glo Steady-Luc Reporter Assay Kit、Molecular Devices(エクスプローラーキット #R8352 またはバルクキット #R8353)
- 競合キット Steady-Glo Luciferase Assay System、Promega (Cat# E2510)
- SpectraMax i3x マイクロプレートリーダー、Molecular Devices(Cat# i3X)
- 96ウェル白壁クリアボトムプレート、Costar (Cat# 3903)
- 精製ルシフェラーゼ、Promega (Cat# E1701)
- 384-well solid white plate、Greiner (Cat# 655075)
- CHO-K1細胞、ATCC (Cat# CCL-61)
- 完全培地
- Ham's F12培地、Life Technologies (Cat# 11765-54)
- ウシ胎児血清、Gemini (Cat# 100-106)
- ペニシリン/ストレプトマイシン、Life Technologies (Cat# 15070-063)
- 0.05%トリプシンEDTA、Life Technologies (Cat# 25300-054)
- pGL4 ホタルルシフェラーゼベクター、Promega (Cat# E6681)
- pGL3 コントロールベクター、Promega (Cat# 1741)
- FuGeneHD トランスフェクション試薬、Promega (Cat# E2311)
方法
SpectraMax Glo Steady-Luc Reporter アッセイには簡便なワークフローがあります。作用液をマイクロプレートの各ウェルに培地と1:1の割合で混合し、ルシフェラーゼを発現する細胞をプレーティングする。その後、SpectraMax i3x Multimode Microplate Readerで発光シグナルを読み取る前に、プレートに蓋をして混合し、細胞を完全に溶解させる(図1)。Softmax Pro ソフトウェアの設定済みプロトコルを使用すると、データ取得と解析が簡単に合理化されます。

図1. SpectraMax Glo Steady-Lucレポーターアッセイキットのワークフロー。
ルシフェラーゼ標準曲線
このアッセイの直線検出範囲を同定するために、ルシフェラーゼ濃度の関数としてRLUを測定する標準曲線を作成した。SpectraMax Glo Steady-Luc Reporter Assay Kit の全成分をまず室温に平衡化させた。SpectraMax Glo Steady-Luc作業溶液は、Steady-LucアッセイバッファーにD-Luciferinを1mg対4mLの割合で加えて作った。精製ルシフェラーゼを0.01%BSA含有PBSで1×106fg/wellの濃度から10倍連続希釈し、各濃度25μLを384well solid white plateに3回ずつ添加した。その後、25μLのSpectraMax Glo Steady-Luc作業溶液を、ルシフェラーゼとコントロールを含むウェルに加えた。プレートを振り、暗所で10分間インキュベートした。SpectraMax i3xリーダーを用い、SoftMax Proソフトウェ アであらかじめ設定したSpectraMax Glo Steady-Luc Reporterアッセイプロトコルを用いて発光を測定した。検出後、プロトコールは自動的にデータ曲線を作成する。
トランスフェクションおよび細胞希釈アッセイ
レポーター遺伝子アッセイ法の開発の一環として、スクリーニングのための確実なシグナルを与えるのに必要な細胞数とプラスミド量を最適化することがある。pGL4.13ホタルルシフェラーゼを6ウェルプレートに2種類ずつ導入し、細胞希釈アッセイを行った。CHO-K1細胞を、SV40初期エンハンサー/プロモーターの制御下にあるルシフェラーゼ遺伝子luc2をコードするpGL4.13[luc2/SV40]ベクター、またはプロモーターおよびエンハンサー配列を欠くpGL3-Basic(コントロール)ベクターで、1ウェルあたり1.7μgまたは0.8μgで一過性にトランスフェクトした。24時間後、細胞をトリプシン処理し、100μL/ウェルで96ウェルプレートに播種した。100μL/ウェルのSteady-Lucワーキング溶液をウェルに添加した。光から試薬を守るためにプレートを覆い、オービタルシェーカーで混合した。10分後、あらかじめ設定したSpectraMax Glo Steady-Luc Reporter assayプロトコルを用いて、SpectraMax i3xリーダーで発光を測定し、記録した。設定済みプロトコールは、Protocol LibraryタブのReporter Assaysセクション、またはSoftMax Pro Softwareプロトコル共有ウェブサイト(www.softmaxpro.org)にある。
スクリーニングアプリケーション
SpectraMax Glo Steady-Luc Reporter Assay Kitを用い、pGl4ホタルルシフェラーゼをトランスフェク トした細胞のプレートを複数回リードすることにより、レポーター遺伝子アッセイスクリーンをシミュレートした。細胞は既述のようにトランスフェクションし、96ウェルプレートに1ウェル当たり30,000細胞ずつプレーティングし、一晩培養した。アッセイ当日、プレートを室温に平衡化し、D-ルシフェリンを含む100μLのSteady-Lucワーキング溶液を各ウェルに添加した。プレートに蓋をし、オービタルシェーカーで5分間混合した後、SpectraMax i3xリーダーに入れて混合した。発光を5分ごとに、各測定前に3秒間オービタルシェイクしながら、合計5時間測定した。
結果
ルシフェラーゼ標準曲線
比較のため、アッセイの検出範囲を特定するための標準曲線を、競合他社のグロールシフェラーゼアッセイでも行った。どちらの場合も、発光とルシフェラーゼ濃度の間に直線関係があることが確認された(図2)。ルシフェラーゼのR2値は、SpectraMax Glo Steady-Luc Reporter Assay Kitでは0.998、競合アッセイキットでは0.999であった。正規化されたデータのpaired t-testは、各濃度で同等の結果を示した(P < 0.05)。計算はGraphPad Prismを用いて行った。両キットを用いた場合、ルシフェラーゼの検出下限(LLD)は384ウェルフォーマットで5フェムトグラム/ウェルであった。
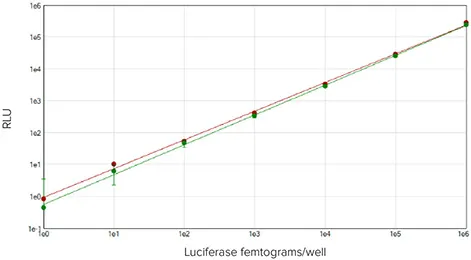
***図2. 384ウェルフォーマットでのルシフェラーゼ標準曲線。
SpectraMax Glo Steady-Luc Reporterアッセイ(緑)(R2=0.999)または競合アッセイ(赤)(R2=0.998)で精製ルシフェラーゼを10倍希釈した直線結果。どちらのアッセイでもLLD=5 femtogram/wellであった。
トランスフェクト細胞におけるルシフェラーゼの測定
ルシフェラーゼを一過性に導入したCHO-K1細胞を30,000個/ウェルからウェルにピペッティングし、Steady-Luc Reporter working solutionを添加した。図3に示すように、SpectraMax Glo Steady-Luc Reporterアッセイと競合グロールシフェラーゼアッセイの両方が、細胞数と発光の間に直線関係を示した。0.8μgのpGL4.13ルシフェラーゼベクターを受けた細胞では、SpectraMax Glo Steady-Luc Reporter Assay Kitを用いた場合R2=0.995、競合アッセイキットを用いた場合R2> 0.999であった。どちらのキットも、アッセイでテストした細胞の最低希釈倍率である468細胞/ウェルを検出した。
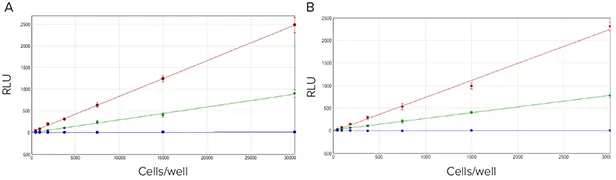
***図3. 90%コンフルエントのCHO-K1細胞に、1.7μg pGL4(ホタル)(赤)、0.8 pGL4(ホタル)(緑)、またはpGL3(コントロール)ルシフェラーゼプラスミド(青)をトランスフェクトした。**(A)**SpectraMax Glo Steady-Lucレポーターアッセイ(プラスミド0.8μgでR2>0.995)および**(B)*。
コンペティターアッセイ(0.8μgプラスミドでR2=0.999)。両キットとも、アッセイで最も少ない細胞数/ウェル(468細胞/ウェル)を検出した。
スクリーニングアプリケーション
SpectraMax Glo Steady-Luc Reporter assayは、シグナル時間ウインドウを拡大したグローベースの発光アッセイである(図4)。30,000細胞/ウェルのルシフェラーゼ発現CHO-K1細胞を含むプレートを5分ごとに読み取り、スクリーニングプレートのバッチ処理をシミュレートする。5時間後のシグナルは初期値の20%以内である。レポーターアッセイスクリーンの各プレートには、多数のプレートでデータを比較できるように、バックグラウンドに対するデータの正規化のためのコントロールが含まれている。図5に示されるように、シグナルは20枚のプレートで15%以内にとどまっており、このアッセイで90分間に20枚のプレートを実施することが可能であることを示唆している。
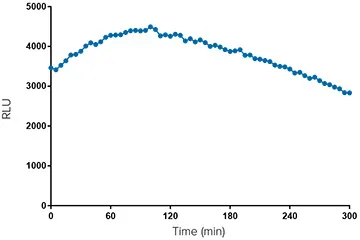
***図4. CHO-K1細胞におけるルシフェラーゼシグナルの経時変化。
CHO-K1細胞にルシフェラーゼを導入した。アッセイ当日、プレートを室温に平衡化し、D-ルシフェリンを含む100μLの再構成Steady-Luc作業溶液を各ウェルに添加した。プレートに蓋をし、オービタルシェーカーで5分間混合した後、SpectraMax i3xリーダーに入れて混合した。発光を5分ごとに5時間読み取り、各読み取り前に3秒間オービタルシェイクした。
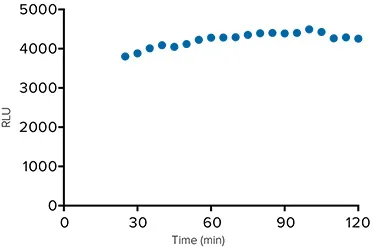
***図5. スクリーニング応用。
ルシフェラーゼを導入したCHO-K1細胞のSpectraMax Glo Steady-Lucアッセイでの生データ。ルシフェラーゼを導入した細胞からの平均シグナルは、プレートを5分ごとに読み取るスクリーニングアッセイ中のバッチ処理の例としてプロットされている。スクリーニングプレートでは、多数のプレートで比較できるように、バックグラウンドコントロールを使用してデータを正規化する。
結論
ルミネセンスマイクロプレートリーダーを用いたルシフェラーゼベースのレポーターアッセイは、ケミカルバイオロジーや創薬アプリケーションのハイスループット分析にますます普及しています。SpectraMax Glo Steady-Luc レポーターアッセイキットは、哺乳類細胞におけるホタル ルシフェラーゼ発現の高感度定量を可能にする。均質な実験プロトコルを適用することにより、このキットに含まれる特別に調合された物質の混合物は、安定したシグナルを示す時間ウィンドウを大幅に拡大し、スクリーニングアッセイにおけるプレートのバッチ処理を可能にします。このアッセイキットは、Molecular Devices社のSpectraMaxマイクロプレートリーダー用に最適化されており、Molecular Devices社のSoftMax Proソフトウェアを使用してデータ取得および解析を行うお客様向けに、設定済みのプロトコルが提供されています。
SpectraMax Glo Steady-Lucレポーターアッセイキットについてさらに詳しく >>
PDF版(英語)