Application Note FLIPR®膜電位アッセイキットを用いた
蛍光イメージングプレートリーダー(FLIPR)システムでの膜電位測定
PDF版(英語)
セクションI:はじめに
イオンチャネルは製薬業界にとって重要な創薬ターゲットである。従来、膜電位の変化を測定する方法としては、ì金標準であるパッチクランプ法が選択されてきた。この方法は最も情報量が多いが、非常に労力と時間がかかる。イオンチャネルのハイスループット・ドラッグスクリーニングの解決策にはならない。
Molecular Devices Corporationは、膜電位の変化を検出するための迅速、簡便かつ信頼性の高い蛍光アッセイ法を提供するために、FLIPR膜電位アッセイキットを開発した。このアッセイは、パッチクランプ法に匹敵するレベルの情報を提供する。FLIPRシステムと組み合わせることで、イオンチャネル薬物ターゲットのハイスループットスクリーニングに非常に優れたシステムを提供します。
このアッセイでは、通常、まず細胞をマイクロプレートに増殖培地で播種する。その後、色素が細胞に添加され、細胞膜を横切って平衡化される。その後、細胞を含むマイクロプレートをFLIPR装置に移し、蛍光シグナルをモニターしながら化合物とコントロールを細胞に添加する。
本アプリケーションノートでは、Membrane Potential Assay Kit を用いてFLIPRシステムで膜電位アッセイを行うための基本的なプロトコールと、アッセイの最適化およびトラブルシューティングのための重要なパラメータについて説明します。細胞株にはそれぞれ固有の性質があるため、プロトコールはそれぞれのアッセイに最適化する必要があります。
本アプリケーションノートの「原理」の項では、アッセイの各ステップの目的を概説しています。材料と方法」のセクションでは、アッセイに使用する材料と方法について詳述しています。トラブルシューティングガイド(Troubleshooting Guide)」には、よく遭遇する問題の解決法が記載されています。さらに、付録Aには膜電位アッセイで使用する消耗品のリストが記載されています。
セクション II: 膜電位測定法の原理
パッチクランプとの比較
FLIPR膜電位アッセイキットは、パッチクランピングデータに匹敵する高い情報量と、FLIPRシステムで達成可能なハイスループットスクリーニングの利点を兼ね備えています。パッチクランプ法の最大の利点は、応答時間が非常に速いことであり、単一細胞レベルでの膜電位の非常に速い変化を検出することができます。これまでFLIPRでイオンチャネルの研究に用いられてきた色素、例えばDiBACは応答時間が長かった。しかし、新しい膜電位アッセイキットでは、応答時間が短縮された。これまでFLIPR上でDiBACを用いると10~30分かかっていたアッセイが、1~2分で完了するようになった。さらに、パッチクランピングの結果とデータを比較すると、良好な相関性が示された(図1、2参照)。チャネルの開口と閉口の両方が観察できるようになった。これは、膜電位の一方向の変化しか示せないことが非常に多いDiBACとは異なる(図3参照)。
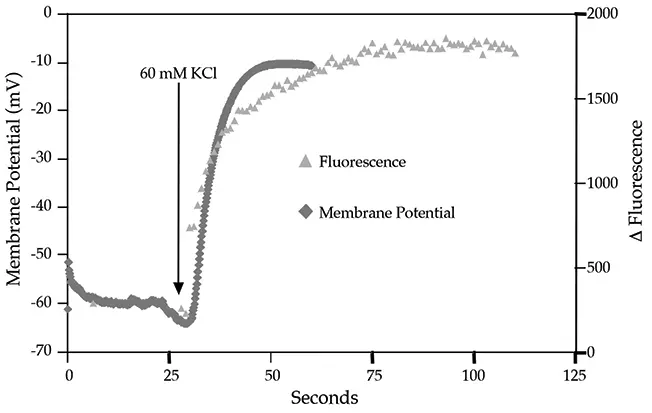
図1:電位依存性K+チャネルを発現するCHO細胞におけるパッチクランプ(mV)アッセイとFLIPR(蛍光)アッセイの比較。データ提供:Millennium Pharmaceuticals社、Michael Xie博士。
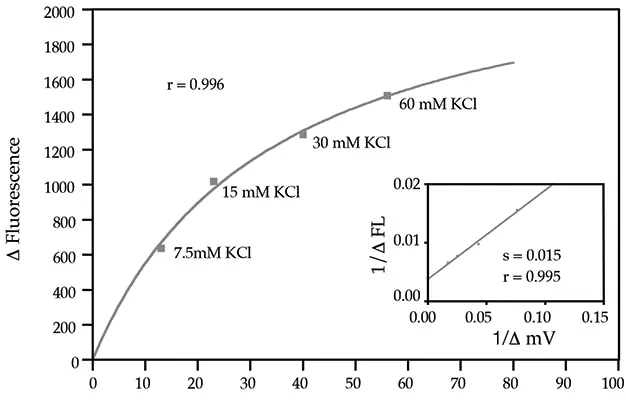
図2:膜電位変化とFLIPR上の蛍光変化の相関: K+チャネルをトランスフェクトしたCHO細胞を様々なK+濃度に曝露した。データ提供:Millennium Pharmaceuticals社、Michael Xie博士。
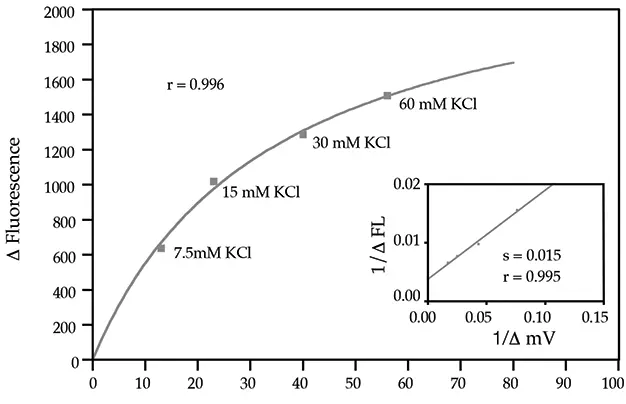
図3:FLIPR膜電位アッセイキット、DiBAC、Fluo-3アッセイによるリガンド結合Ca2+チャネルの比較。データ提供:Millennium Pharmaceuticals社、Michael Xie博士。
異なる種類の細胞を使用
FLIPR Membrane Potential Assay Kitは、接着性、非接着性を問わず、多くの細胞種に使用できるよう設計されています。FLIPR膜電位アッセイキットは、付着性、非付着性を問わず、多くの細胞種に対応するように設計されています。実験室における標準的な操作手順に基づいて、ユーザーの裁量で様々な細胞操作条件が採用される可能性があることを私たちは認識しています。FLIPR Membrane Potential Assay Kitに最適な細胞条件としては、FLIPRにプレートを入れる前にコンフルエントな細胞単層を形成させることが必要です。
細胞は、透明な平底、黒色または透明壁の384ウェルまたは 96ウェル組織培養プレートに播種する。底が平らであるため、細胞蛍光が単一の水平面に局在する。接着細胞は実験前日に播種し、非接着細胞は実験当日に播種する。全ステップは同じ96ウェルまたは384ウェルプレートで行う。アッセイの基本ステップは以下の通りである:
- 細胞をプレーティングする
- 細胞を染色する
- FLIPRシステムで細胞をアッセイする
アッセイ当日に80~90%の均一なコンフルエント単 層が形成されるように、細胞播種密度を最適化する必要があ る。オーバーコンフルエントな細胞単層は、試験 物質に対する細胞の反応を低下させる可能性がある。通常、サブコンフルエント・レベルで培養維持され ている細胞は、比較的低い密度で播種すべきである。個々の細胞株によっては、ポリD-リジンコーティングプ レートのような接着マトリックスコーティングを施したプレ ートを用いると、接着性が向上し、化合物添加中の細胞 のì吹き飛びを最小限に抑えることができる。
細胞に色素をロードする
色素負荷プロトコールは、最良の結果を得るために細胞株ごとに最適化されなければならない。
蛍光染料
FLIPR Membrane Potential Assay Kitの内容は、FLIPRシステムのプロトコールに従って使用した場合に、確実な結果が得られるように最適化されています。キットに含まれる色素は親油性、陰イオン性、ビスオキソノール色素で、細胞膜電位に依存して生細胞の細胞質膜を横切って分配することができる。色素が細胞質タンパク質と結合すると、蛍光強度が増加する。細胞が脱分極すると、より多くの色素が細胞内に入り、細胞内脂質やタンパク質に結合した色素の細胞内濃度が上昇するため、蛍光シグナルが増加する。細胞が過分極されると、色素は細胞から排出され、脂質やタンパク質に結合する色素の細胞内濃度が低下するため、蛍光シグナルは減少する。色素はアルゴンイオンレーザーの波長488nmで励起される。
キットの組成は独自に開発されたもので、特許出願の対象となっている。
負荷時間と温度
最適なローディング時間は細胞のタイプに依存する。蛍光色素は一般に細胞に対して毒性があるため、最適なローディング時間を超えないようにするのが最善です。ほとんどの細胞株では、37℃で60分のローディング時間が通常有効であり、アッセイ開発の出発点として推奨される。
注意:いくつかの細胞株で観察されているように、30分間のローディングで許容できる 蛍光シグナルと安定したベースラインが得られる場合は、より短いローディング時間を使用する。場合によっては、室温でのインキュベーションが37℃と同じかそれ以上うまくいくこともある。
化合物プレートの調製
その複雑さにより、コンパウンドプレートの調製にかかる時 間は様々である。従って、細胞の準備ができ次第コンパウンドプレートが使用できるよう、注意深く実験計画を立てるのが最善です。つまり、細胞プレートに Loading Buffer を加える前に、コンパウンドプレートを準備する必要があるかもしれません。
プラスチック表面への化合物の付着を抑えるため、ポリプロピレンプレートを推奨する。化合物を保持するためにV底96ウェルプレートを使用すると、化合物プレート内のデッドボリュームを最小限に抑えることができます。化合物プレートのデッドボリュームは、FLIPRピペッターを使用した場合、平底プレートで約50 µL、V底プレートで約10 µLです。
化合物は、添加量と細胞プレート内のバッファー量に応じ て、最終濃度の3倍、4倍または5倍で調製する。化合物の混合効率、細胞の接着性、細胞反応の速度論によっ て、これらの量は変化する可能性がある。
膜電位測定は、迅速な細胞動態を捉えるため、迅速に行う必要がある。したがって、化合物を細胞プレートに素早くピペッ トし、ウェル内の液体を効果的に混合する必要がある。しかし、化合物を急速に添加しすぎると、細胞の種類によってはプレートから外れてしまうことがある。サンプル量が多ければ多いほど、少なければ少ないほ どウェル内で迅速に混合される。しかし、サンプル量が少ないほど細胞層の破壊が少なく、同じ化合物プレートを複数の細胞プレートに使用することができます。接着力の弱い細胞が外れるのを避けるため、化合物の量を少なめにして細胞プレートに加え、ピペッターは比較的低速で化合物を分注する必要があります。
注意:通常、膜電位測定キットではピペッターのミキシング機能は使用しません。シグナルが急速に更新されるため、シグナルの上昇中にミキシングを行うとアーチファ クトが生じる可能性があります。
膜電位測定用FLIPRシステムのセットアップパラメーター
アッセイを実施する前に、フィルターをFLIPRシステムのフィルター#2の位置に取り付ける必要があります。FLIPRのフィルタードアの内側にあるフィルターホルダーを、フィルターホルダーを固定している2つの蝶ネジを緩めて外し、清潔な台上またはタオルを敷いた台の上にスライドさせて出します。フィルター#2の位置は空のはずです。反時計回りにネジを緩めて、リングを1つ取り外します。540~590nmのBPエミッションFLIPRフィルターを#2の位置に慎重にセットし、切り欠きが外側になるようにリングを元の位置にねじ込みます。フィルターホルダーをFLIPRの正しい位置にセットする。
基底蛍光シグナルのチェック
FLIPRソフトウェアの実験セットアップでフィルター#2を選択する。表1に示すレーザー出力、カメラのF値、露光時間の設定から始める。これらの設定は基底蛍光シグナルの測定に最も頻繁に使用される。
| 設定 | FLIPR 1システム | FLIPR 1システム |
|---|---|---|
| FLIPR 1システム | 0.300-0.600 | 0.600-1.20 |
| カメラF値 | f/4.0 | f/4.0 |
| 露光時間(秒) | 0.4 | 0.4 |
表1: FLIPR のハードウェア設定(細胞プレートの基底蛍光シグナルテスト用)。
データ実行の最初に、細胞からの基底蛍光シグナル(すなわち、化合物添加前)をチェックする ìsignal testを行う。バックグラウンドより20,000~30,000カウント高い基底蛍光シグナルで作業するのが最適である(カメラの飽和は65,000カウントで起こる)。FLIPR IシステムとFLIPR384システムで使用するレーザー出力が異なるのは、励起光がプレートを走査する方法が異なるためです。FLIPR384 システムで同じ基底蛍光シグナルを得るために必要なレーザー出力は、通常 FLIPR I システムの 2 倍です。
基底蛍光シグナルの調整
許容できる基底蛍光シグナルが得られるように、以下のパラメーターを調整する:
露光時間
基底蛍光シグナルが高すぎる場合は、露光時間を最小 0.05 秒に減らすことができる。基底蛍光シグナルが低すぎる場合、露光時間を長くすることができるが、サンプリング間隔は露光時間+0.6秒(データ統合に0.6秒かかる)という最小値まで長くしなければならない。
カメラのF値
カメラのF値を大きくすると、絞りの開度が小さくなる。基底蛍光信号が高すぎる場合は、f値を4.0から8.0に上げる。基底蛍光信号が低すぎる場合は、レーザー出力を上げることができる。 f/2はFLIPRシステムで最大の絞り開度設定である。
レーザー出力
基底蛍光シグナルが低すぎる場合はレーザー出力を上げ、高すぎる場合は下げる。アッセイ中のレーザー出力は、FLIPR I システムでは 0.300 W ~ 1.000 W、FLIPR384 システムでは 0.600 W ~ 2.000 W の範囲とする。
露光時間
注:基底蛍光を望ましい範囲に調整するためのパラメーターは3つあるが、ほとんどのユーザーは3つのパラメーターのうち2つ(レーザーパワーと露光時間)を調整する。ほとんどのユーザーは、プレートごとにカメラのf/stopを一定に保っている。
膜電位測定用ピペッターパラメーター
FLIPRシステムソフトウェアでは、アッセイチャンバーの温度と分注パラメーターを設定できます。
測定温度
膜電位アッセイキットの色素はDiBACよりも温度変化に弱いため、ほとんどのアッセイは室温で行う。しかし、化合物や細胞の種類によっては、生理的温度でアッセイを行った方が良い反応を示すことが観察されています。ヒーターを作動させるには、FLIPR Iシステムで加熱オプションを選択するか、FLIPR384システムで加熱ステージをセットアップして加熱オプションを選択します。アッセイを開始する前に、装置温度を平衡化させるために最低30分以上の時間をとってください。
ピペッターの高さ
96ウェルピペッターの場合、ピペッターがプレートから液剤を吸い上げた後、液剤が漏れないように、各ピペットチップの底に小さな気泡を吸引します。この気泡は、液剤が分注される際にピペットチップから最初に出てくるものです。ウェル内での気泡の吹き出し(光の乱反射やスプリアス・シグナルの原因となる)を避けるため、チップをウェル内の液面より高い位置から分注を開始するのが最善です。また、試料を完全に分注するために、添加終了後にピペッターの先端を水中に沈めておくことが望ましいです。分注終了時にピペット先端が空中にある場合、表面張力により先端部に液滴が形成されることがあります。したがって、ピペッターの高さは、ウェル内の分注開始液量より上、かつ分注後の最終液量より下に設定する必要があります。例えば、ウェルの容量が100 µLで、添加するサンプル量が50 µLの場合、ピペッターは120ñ140 µLの高さから化合物を分注することができます。
384ウェルの液面は深いカーブを描くメニスカスになっています。したがって、化合物を添加する前に、セルプレート内の液量に対応するようにピペッターの高さを設定することを推奨します。
液体吐出速度
デフォルトのピペッター分注速度は、96ウェルプレートでは50µL/秒、384ウェルプレートでは20µL/秒です。表 2 に、96 ウエルおよび 384 ウエルプレートフォーマットの分注速度の制限値を示します。
| 96ウェルプレート | 384ウェルプレート | |
|---|---|---|
| 低速分注(µL/sec.) 弱い接着細胞または非接着細胞 | 10-40 | 5-10 |
| 速い分注スピード(µL/秒) 強く接着した細胞 | 50-100 | 15-20 |
表2: 液体吐出速度
これらの値は、細胞の種類ごとに実験的に決定されなけれ ばならないが、ウェル中の化合物の混合を促進するため、一般的に はできるだけ速く分注することが望ましい。トレードオフとして、ピペッティング速度は、ウェルから 細胞が外れるほど強引であってはならない。
セクション III: 材料と方法
材料と設備
- 540-590nmBP発光FLIPRフィルターを装着したFLIPRシステム(Molecular Devices Corporation製)
- 膜電位アッセイキット(Molecular Devices Corporation、R-8034)
- 透明、平底、黒色または透明壁の 384 ウェルまたは 96 ウェルプレート(付録 A の消耗品リストを参照)
- 透明ポリプロピレン複合プレート(付録Aの消耗品リストを参照)
- 懸濁状態の細胞
- 増殖培地
- 試験化合物
- インキュベーター(5% CO2、37)
- 遠心分離機
- マイクロプレート用のピペッターと滅菌チップ
- 1N NaOH
細胞の準備
ステップ1 96ウェルプレートでは100µL/ウェル、384ウェルプレートでは25µL/ウェルの細胞懸濁液を使用する。接着していない細胞は実験当日にプレーティングする。その後、ブレーキを外した状態で、プレートを1000 rpmで最大4分間遠心することを推奨する。接着細胞は実験前日に播種し、5%CO2、37℃のインキュベーターで一晩培養する。80%~90%のコンフルエントな細胞単層を作製するために、表3に示す密度で細胞を播種することを推奨する。
| 96ウェルプレート | 384ウェルプレート | |
|---|---|---|
|
接着細胞 (x10 4 細胞/ウェル) |
2-10 | 0.5-3 |
|
非付着細胞(x10 4 細胞/ウェル) |
10-50 | 2.5-10 |
|
増殖培地量(µL) |
100 | 25 |
表3: 推奨細胞播種密度。
染料ローディング
ローディングバッファーの調製
以下の手順は、上記のように調製した接着細胞または非接着細胞を用いて、96ウェルまたは384ウェルプレート10枚用にデザインされている。
ステップ 2 1X 試薬緩衝液を調製するため、10X 試薬緩衝液(膜電位測定キットのコンポーネント B)10mLを蒸留水で 100mLに希釈し、1N NaOHでpH7.4に調整する。
注意:時折、10X 試薬緩衝液のボトルに白い沈殿が生じることがあります。これは正常であり、アッセイには影響しません。
ステップ3 FLIPR膜電位測定試薬(膜電位測定キットのコンポーネントA)のバイアルを取り出します。10 mLの1X試薬バッファーでバイアルを完全に溶かします。完全に溶解するまでピペッティングを繰り返して混合する。バイアル瓶の混合液を90 mLの1X試薬バッファーに希釈し、ローディングバッファーを調製する。内容物を完全に移すには、バイアルを複数回洗浄する必要があります。
注意:供給された試薬は、細胞を適切にローディングするのに十分な量です。最適な結果を得るためには、試薬を追加したり、容量や濃度を変えたりしないことが重要です。
ローディング・バッファーを用いた細胞のローディング
ステップ 4 細胞プレートをインキュベーターまたは遠心機から取り出す。上清は除去しないでください。各ウェルに等量のLoading Bufferを加えます(96ウェルプレートでは1ウェルあたり100μL、384ウェルプレートでは25μL)。
ステップ5 細胞プレートを37℃で1時間インキュベートする。場合によっては、室温でインキュベートしても同等かそれ以上の効果がある。
FLIPRでの膜電位アッセイの実行
ステップ 6 Loading Bufferでのインキュベーション後、プレートを直接FLIPRに移し、FLIPRシステムマニュアルに記載されている通りにアッセイを開始する。推奨される実験セットアップパラメーターを表 4 に示す。
| パラメータ | 96ウェルプレート | 384ウェルプレート |
|---|---|---|
| 化合物添加量(μL) | 50 | 25 |
| 化合物濃度(倍 | 5 | 3 |
| 添加速度(µL/sec) 接着細胞 | 50-100 | 10-20 |
| 非付着細胞 | 10-20 | 5-10 |
表4:実験セットアップパラメーター。
注:FLIPR Membrane Potential Assay Kit はアゴニストだけでなくアンタゴニストの添加にも最適化されています。96ウェルプレートでは各ウェルに50µL、384ウェルプレートでは25µL添加します。アゴニストの添加量は変わりませんが、濃度とピペッターの高さは変わります。
セクションIV:トラブルシューティングガイド
このセクションでは、ユーザーが遭遇する可能性のある問題の解決策を紹介します。
- 化合物添加時の蛍光低下
- 細胞を長時間(例えば 1 時間以上)インキュベートする場合、FLIPR システムの化合物添加時に大きな蛍光低下(5-10K 蛍光単位)が起こることがあります。このような蛍光単位の低下は、化合物添加中にウェルから 細胞が外れたことが原因である可能性が高い。インキュベーション時間を短くする、ポリ-D-リジンコートプレートに細胞をプレーティングする、FLIPRの添加速度を遅くするなどの方法でアッセイを最適化する。
- 蛍光の増加
- 緩衝液のみのチャレンジで蛍光の増加が観察されることがある。この蛍光の増加は、イオン強度の増加に対する内因性イオンチャネルの反応による可能性が高い。パッチクランプのデータもこの変化を裏付けている。細胞の選択と内在性チャネルの発現レベルは、静止膜電位と変化する膜電位に大きく影響する可能性がある。化合物添加時のイオン濃度が変化しないように、化合物添加バッファーとセルプレートのバッファー(培養液+色素負荷バッファー)を合わせる。
- 反応なし
- 蛍光に変化がない場合、アッセイを再設計する必要があるかもしれません。推奨される方法としては、インキュベーションやアッセイ時間を長くする、Tyrodeís や特定のイオンを含まないバッファーなど、異なるバッファーを選択する、などがあります。例えば、カルシウムチャネルを研究する場合、カルシウムを含まないバッファーでロードセルを染色し、カルシウムを含むバッファーで化合物プレートを調製する。
- 膜電位アッセイにおけるDMSOの影響
- 高濃度のDMSOは多くの細胞株に対して毒性があり、化合物の混合に影響する。また、DMSOは細胞の生理的変化(分化など)を誘発する可能性があります。被験物質製剤にDMSOが含まれる場合、DMSOを滴定し、各指標細胞株と被験物質に使用できる最大濃度を決定することが重要である。試験した細胞株によっては、最終濃度1% DMSOまでシグナルレベルに影響がなかった。
付録A:FLIPR膜電位アッセイで使用する消耗品
| 96-well ブラックウォールプレート | 推奨サプライヤー | 電話番号 | 品目番号 |
|---|---|---|---|
| ブラックウォールプレート、クリアボトム、組織培養処理、滅菌済み、96ウェル | Corning/Costar | 800-492-1110 | 3603 |
| Packard Instrument |
800-856-0734 203-639-2404 |
6005182 | |
| Greiner 蓋付き(E&K社販売) |
408-378-2013 |
655090 | |
| Greiner 蓋なし(E&K 社販売) |
408-378-2013 |
655087 | |
|
黒壁プレート、透明底、組織培養処理、無菌、96ウェル コラーゲンコート |
Becton Dickinson |
800-343-2035 | 356649 |
| 96ウェルクリアプレート | 推奨サプライヤー | 電話番号 | 商品番号 |
|---|---|---|---|
|
グライナーUボトム ポリプロピレン |
E&K |
408-378-2013 | 650201 |
|
グライナー V底ポリプロピレン |
E&K | 408-378-2013 | 650201 |
| 384ウェル黒色ウォールプレート | 推奨サプライヤー | 電話番号 | 品目番号 |
|---|---|---|---|
| ブラックウォールプレート、クリアボトム、組織培養処理、滅菌済み、384ウェル | Corning/Costar | 800-492-1110 | 3712 |
| Packard Instrument | 800-856-0734 | 203-639-2404 | 6005261 |
| Greiner 蓋付き(E&K社販売) | 408-378-2013 | 781091 | |
| Greiner 蓋なし(E&K 社販売) | 408-378-2013 | 781092 | |
|
黒壁プレート、透明底、組織培養処理、滅菌済み、384ウェル、 ポリ-D-リジンコート |
Becton Dickinson | 800-343-2035 | 356663 |
|
黒壁プレート、透明底、組織培養処理、滅菌済み、384ウェル コラーゲンコート |
ベクトン・ディッキンソン | 800-343-2035 | 356667 |
| 384ウェルクリアプレート | 推奨サプライヤー | 電話番号 | 商品番号 |
|---|---|---|---|
| 化合物用透明プレート、384ウェル、ポリプロピレン、蓋付き | Greiner社(E&K社販売) | 408-378-2013 | 781201 |
| ピペッティングアクセサリー | 推奨サプライヤー | 電話番号 | 商品番号 |
|---|---|---|---|
| マルチチャンネルピペッター用滅菌済みベースン(細胞播種用) | Fisher | 800-766-7000 | 13-681-101 |
| マルチチャンネルピペッター用非滅菌ベースン | Fisher | 800-766-7000 | 13-681-100 |
| LIPRピペットチップ、黒、非滅菌、96ウェル、250 µL | Molecular Devices |
800-635-5577 408-747-1700 |
9000-0549 |
| FLIPR I用代替チップ オートチップ、黒色、滅菌済みでない、96ウェル、200 µL | ロビンスサイエンティフィック |
800-752-8585 408-734-8500 |
1043-24-O |
|
FLIPR用代替チップ 384 96ウェルフォーマット オートチップ、黒色、非滅菌、96ウェル、200 µL |
ロビンスサイエンティフィック |
800-752-8585 408-734-8500 |
1043-24-5 |
|
FLIPR用 384 クワドラント用 マイクロオートチップ(黒)、非滅菌、96ウェル、50 µL |
ロビンスサイエンティフィック |
800-752-8585 408-734-8500 |
1043-26-5 |
|
FLIPRピペットチップ、透明(ピペッター校正用)、96ウェル、250 µL |
ロビンスサイエンティフィック |
|
1043-04-0 |
|
FLIPR I(ピペッター較正用)の代替透明チップ: オートチップ、クリア、無菌、200 µL |
ロビンスサイエンティフィック |
800-635-5577 408-747-1700
|
9000-0548 |
|
FLIPR ピペットチップ、透明、384 ウェル、タイプ A(384 ヘッドタイプ A に適合 |
Molecular Devices |
800-635-5577 408-747-1700 |
9000-0257 |
|
FLIPRピペットチップ、クリア、384ウェル、タイプB(384ヘッドタイプBに適合) |
Molecular Devices |
800-635-5577 408-747-1700 |
9000-0512 |
| アッセイ消耗品 | 推奨サプライヤー | 電話番号 | 品目番号 |
|---|---|---|---|
| Hank's Balanced Salt Solution (10X stock) | ギブコ社 | 800-828-6686 | 14065-056 |
| HEPES 緩衝液 1X | Irvine Scientific | 800-437-5706 | 9319 |
| アッセイ消耗品 | 推奨サプライヤー | 電話番号 | 品目番号 |
|---|---|---|---|
| 膜電位アッセイ試薬キット | Molecular Devices |
800-635-5577 408-747-1700 |
R-8034 |
| FLIPR発光フィルター(540-590nmバンドパス) | Molecular Devices |
800-635-5577 408-747-1700 |
0310-4027 |
| DMSO、低含水 | Sigma |
800-325-3010 |
D2650 |
| UTP、Na塩(受容体媒介陽性対照 | Sigma |
800-325-3010 |
U-6625 |
| イオノマイシン(陽性対照) | CalBiochem |
800-854-3417 |
407950 |
| アスピレーターマニホールド 12ピン | Wheaton Science |
800-225-1437 |
851388 |
| アスピレーターマニホールド 8 ピン | Wheaton Science |
800-225-1437 |
851381 |
細胞培養施設で必要とされ、使用されるその他の物品:
| 説明 | 推奨サプライヤー | 電話番号 | 品目番号 |
|---|---|---|---|
| マルチドロップ 96/384 | Labsystems |
800-522-7763 508-541-0444 |
5840157 |
| 12 チャンネル インパクト 2 ピペッター(15-850 µL) | Matrix |
800-345-0206 |
2014 |
| Matrix インパクト用 1250 µL ピペットチップ | Matrix |
800-345-0206 |
8052 |
| 手動12チャンネルピペッター 50-200 µL | Brinkman |
5008130-3 |
|
| 滅菌済みピペットチップ 200 µL E+K | Scientific |
408-378-2013 |
3507-R965 |
- 5mL、10mL、25mL滅菌血清ピペット
- 2~25 mLピペット用充電式ピペッター
- 滅菌組織培養水
- 手袋
- 細胞培養用培地
- 細胞を浮遊させるためのEDTAとトリプシン/EDTA
- 血球計数器とカウンター
- 滅菌済み試験管15mLと50mL、または化合物希釈用の小さい試験管
- 1NのNaOH溶液
- 272
商標:FLIPRはMolecular Devices Corporationの登録商標です。その他の商標は各所有者に帰属します。
PDF版(英語)