Application Note SpectraMaxマイクロプレートリーダーによる活性酸素種の測定
- 合理化されたワークフローにより、酵素反応およびセル培養におけるH2O2の検出が可能
- 活性酸素アッセイを他のアッセイとマルチプレックスすることで、より包括的な細胞分析が可能
- 最適化ウィザードにより最適なシグナル検出が可能
PDF版(英語)
はじめに
活性酸素種(ROS)は、酸素を封じ込めた化学的に反応性の分子である。真核生物では、これらの分子は主に好気呼吸中に生成され、DNA損傷や脂質過酸化などの問題を引き起こし、細胞障害をもたらします。活性酸素はまた、アポトーシス、細胞の老化、細胞シグナル伝達にも関与している1, 2。当然のことながら、セルは還元酵素や抗酸化物質によってこれらの酸化種から身を守っているが、処理しきれないほどの活性酸素が蓄積すると、細胞は酸化ストレス状態に移行する。したがって、細胞の活性酸素レベルを正確に測定することは、活性酸素が細胞生物学や生理全般で果たす役割を理解する上で非常に重要である。
最も一般的に研究されている活性酸素には、スーパーオキシド(O2)、ヒドロキシラジカル(-OH)、過酸化水素(H2O2)などがあり、これらは細胞膜、ミトコンドリア、その他の小器官で代謝副産物として産生される3 。H2O2は半減期が長く、細胞透過性が高いため、活性酸素アッセイでは一般的に測定される。さらに、活性酸素の一部は無毒化の過程でH2O2に変換されるため、酸化ストレスの優れた指標となる。
このアプリケーションノートでは、SpectraMax® マイクロプレートリーダーを使用して、発光ベースのアッセイを用いて活性酸素レベルを正確に定量する方法を示します。最初の実験では、無益な酸化還元サイクルとそれに続く活性酸素の蓄積を引き起こす合成化合物であるメナジオンで処理したセルの活性酸素レベルを測定するために、リーダーをどのように使用できるかを示している4。2番目の実験では、発光アッセイをMolecular Devices EarlyTox® Live/Dead Assay Kitとマルチプレックスし、活性酸素蓄積と細胞生存率の関係を調べた。
材料
- HepG2 細胞(ATCC cat.)
- 完全増殖培地
◦最小必須培地 (Corning cat. #15-010)
◦ウシ胎児血清 (Gemini cat. #100-106)
◦ペニシリン/ストレプトマイシン抗生物質(Thermo Fisher Scientific社製 cat.) - 試験化合物
◦サポニン (Sigma cat. #47036-50G-F)
◦メナジオン(Sigma cat.) - マイクロプレート
◦96ウェル黒壁透明底組織培養処理マイクロプレート(Corning cat.)
◦96ウェル白色組織培養処理透明底マイクロプレート(Corning cat.)
◦96ウェルソリッド白色マイクロプレート (Greiner cat. #6550) - ROS-Glo H 2 O 2 アッセイ(Promega 社、商品番号 G8820)
- EarlyTox 生死判定アッセイキット(Molecular Devices社、カタログ番号R8340)
- SpectraMax i3x マルチモードマイクロプレートリーダー(Molecular Devices cat.)
- SpectraMax Lマイクロプレートリーダー(Molecular Devices社製 cat.)
方法
HepG2細胞を96ウェル白底透明プレートに10,000細胞/ウェルでプレーティングし、37℃で一晩培養した。試験化合物メナジオンを330 µMから1:3希釈系列で細胞に添加し、25 µMのROS-Glo H2O2基材を加えた。その後、セルを37℃で2時間インキュベートした。その後、等容量のROS-Glo 検出液を処理ウェルに添加し、プレートを室温で20分間インキュベートした。SpectraMax i3xリーダーおよびSpectraMax Lリーダーで発光を読み取った。データはSoftMax® Proソフトウェアで解析し、4パラメータカーブフィットを用いてグラフ化した。
2番目のアッセイでは、HepG2細胞を96ウェルクリアボトム黒壁プレートに10,000細胞/ウェルでプレーティングし、37℃で一晩インキュベートした。次にセルを0.25μMメナジオンまたは0.2%サポニン(1xPBSで希釈)で処理した。試験化合物添加と同時に、25μM ROS-Glo H2O2基材20μLを細胞に添加した。2時間培養後、各ウェルから50µLの処理細胞培養液を、50µLのROS-Glo検出溶液を封入したソリッド白色96ウェルプレートに移した。プレートを20分間インキュベートした後、SpectraMax i3xリーダーで発光を測定した。細胞を封じ込めた元のプレーティングプレートに、EarlyTox Live/Dead working solutionを50µL加え、細胞を室温で30分間インキュベートした。その後、プレートをSpectraMax i3xリーダーで、EarlyTox Live/Dead Assay Kitの製品添付文書に記載されている蛍光設定を用いて読み取った(設定済みプロトコルはSoftMax Proソフトウェアで利用可能)。データ解析とグラフ化はGraphPad Prismで行った。
結果
メナジオンはミトコンドリアの電子伝達鎖を阻害し、活性酸素の蓄積を引き起こすことが知られている。メナジオンで処理したHepG2セルは、濃度依存的に活性酸素の増加を示し、発光の増加で示された(図1)。SpectraMax i3xリーダーおよびSpectraMax Lリーダーを用いてこれらのサンプルの発光を測定したところ、EC50の計算値がそれぞれ13.0 μMおよび11.9 μMとなり、同様のデータが得られた。
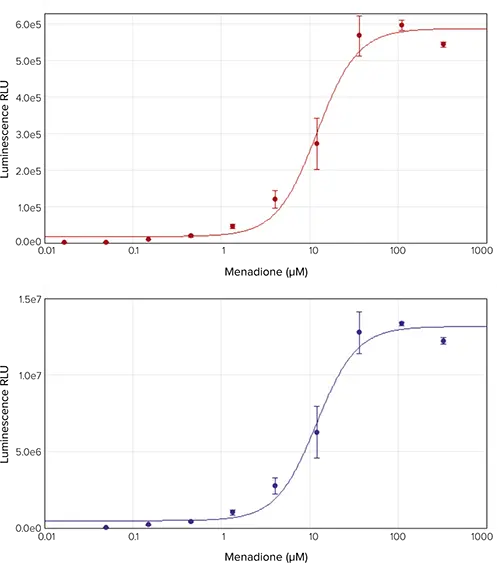
図1. メナジオン用量反応曲線。HepG2セルを330 µMから始まるメナジオン3倍希釈系列で処理し、ROS-Glo H2O2アッセイを用いて活性酸素レベルを測定した。発光はSpectraMax i3xリーダー(上)とSpectraMax Lリーダー(下)で測定した。算出されたEC50値は、それぞれ13.0μMと11.9μMであった。
結論
SpectraMax i3x および SpectraMax L リーダーは、ROS-Glo H2O2 アッセイによる正確な活性酸素測定を可能にする。さらに、SpectraMax i3x リーダーのマルチモード機能により、マルチプレックスアッセイが可能になり、ウェル当たりにより多くのデータが得られる。ROSアッセイをEarlyTox Live/Dead Assayとマルチプレックスすることで、メナジオンで処理したセルは高レベルのROSを示したが、サポニンで処理したセルと比較して劇的な細胞死は示さなかった。これらのアッセイを組み合わせることで、細胞毒性と活性酸素蓄積の関係をさらに調べることができる。データ解析と4パラメータカーブフィットの処理には、SoftMax Proソフトウェアを使用した。マイクロプレートとリードハイトの最適化ウィザードは、最適なシグナル検出を保証する。
参考文献
- Hancock, J. T., R. Desikan, and S. J. Neill. "細胞シグナリング経路における活性酸素種の役割"。Biochemical Society Transactions 29.2 (2001): 345-349.
- Lee, J., N. Koo, and D. B. Min. "活性酸素、老化、抗酸化栄養補助食品". Comprehensive Reviews in Food Science and Food Safety 3.1 (2004): 21-33.
- Turrens, Julio F. "Mitochondrial formation of reactive oxygen species.". The Journal of physiology 552.2 (2003): 335-344
- Criddle, David N., et al. "Menadione-induced reactive oxygen species generation via redox cycling promotes apoptosis of murine pancreatic acinar cells.". Journal of Biological Chemistry 281.52 (2006): 40485-40492.
SpectraMax i3x Multi-Mode Detection Platformの詳細はこちら >>
PDF版(英語)