Application Note 細胞増殖と細胞周期をリアルタイムでモニタリング
- 環境制御とタイムラプスイメージングによる生細胞実験の実施
- 細胞分裂や化合物の効果をリアルタイムでモニタリング
- タイムラプスデータを簡単にMP4フォーマットにエクスポートし、動画として保存可能
PDF版(英語)
はじめに
オクサナ・シレンコ博士|シニアリサーチサイエンティスト|モレキュラーデバイス社
フェリックス・スピラ博士|アプリケーションサイエンティスト|モレキュラー・デバイス
András Málnási-Csizmadia、博士|教授|エトヴェシュ・ロラーンド大学、ハンガリー
生物学的研究や創薬研究のために、細胞ベースアッセイの多様性と複雑性を拡大する必要性が高まっている。ライブセルアッセイは、リアルタイムで細胞の反応をモニターすることができ、化合物の治療効果や生物学的複雑性に関する重要な洞察を与えてくれる。我々は、ImageXpress® Pico自動細胞イメージングシステムを用いたリアルタイム定量細胞イメージングアッセイを用いて、細胞モデルにおける抗がん化合物の複雑な効果をモニターした。
抗がん化合物の効果を特徴づけるために、HeLa子宮頸がん細胞の細胞増殖と細胞周期に対する時間依存的効果をモニターした。環境制御(EC)チャンバーを用いて、望ましいCO2およびO2濃度を供給した。細胞数、コンフルエンス、細胞面積の定量化には透過光によるタイムラプスイメージングを用い、細胞周期に対する化合物処理の影響の評価には蛍光イメージャーを用いた。
細胞ベースアッセイは、ImageXpress PicoシステムとCellReporterXpress®Imaging Acquisition and Analysis Softwareを組み合わせて行った。このイメージャーは、5つの蛍光チャンネルに加え、透過光(明視野)および比色イメージングを提供する。環境制御チャンバーと高ステージ精度は、細胞増殖、分化、化合物毒性、その他様々な細胞ベースアッセイの自動モニタリングを可能にする、長時間のタイムラプス顕微鏡検査をサポートします。
方法
環境制御とタイムラプスモニタリング
ImageXpressピコシステムは、温度、CO2、O2濃度、湿度の制御とモニタリングが可能な環境制御チャンバーを備えています。タイムラプスイメージングと組み合わせることで、低酸素状態を含むライブ実験を行うための効率的なツールを提供します。
セル培養
HeLa細胞(ATCCより入手)を384ウェル黒色透明底マイクロプレート(Corning, #3603)に3,000個/ウェルの密度でプレーティングし、37℃、4% CO2の環境制御チャンバーで24時間培養した。化合物による処理は、図1~4に示すように24時間行った。ヒストンタンパク質mCherry-H2BとTubulin-GFPを安定発現させたHeLa細胞はMálnási-Csizmadia博士から提供され、通常のHeLa細胞と同様に培養・処理した。
細胞イメージング
細胞を可視化し、細胞増殖と細胞死をモニターするため、10倍の対物レンズを用い、透過光で24時間、1~2時間ごとに画像を取得した。透過光細胞数一般解析プロトコルを用いて、画像取得中に画像解析を行った。この解析により、セル数、平均セル面積、およびセルで覆われた総面積が測定された。
結果
透過光細胞数を用いた細胞生存能と増殖に対する化合物の影響の評価
細胞培養における表現型の変化は、タイムラプス画像を取得することにより経時的にモニターした。透過光または蛍光 マーカーを用いて、ECチャンバー内で24時間にわたりセルをモニ ターした。HeLa細胞を96ウェルおよび384ウェルのマイクロプレートに、それぞれ1ウェル当たり12,000個または3,000個プレーティングした。透過光画像は10倍の対物レンズを用い、96ウェルプレートでは1ウェルあたり4カ所、384ウェルプレートでは1ウェルあたり1カ所、24時間にわたり1~2時間ごとに取得した。
画像取得中に自動画像解析を行った。画像解析では、透過光でセルを見つけ、セル数、個々のセル面積、セルに覆われた面積をカウントした(図1)。死細胞はサイズと形状に基づいて同定され、健常細胞の解析からは除外された。細胞増殖のカイネティック・カーブを見るために、グラフ作成ツールを使用した。図2は、増殖の指標として、96ウェルプレートの各ウェルの細胞数の経時的増加を示している。
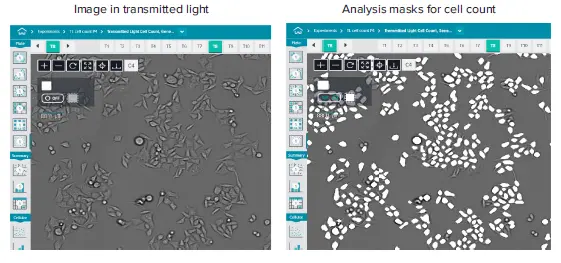
図1. 透過光を用いて10倍の対物レンズで取得したHeLa細胞の画像。セルカウントのための分析マスクは、白いオーバーレイとして示されている(提示された全画像の20%)。重要なことは、解析プロトコルは変更や調整ができないため、画像取得時にプロトコルを最適化する必要があることである。通常、露光時間は1~6msの範囲であり、フォーカスオフセットは通常-8である。

図2. 細胞増殖と化合物効果を24時間にわたってリアルタイムでモニターした。セルを96ウェルまたは384ウェルフォーマットにプレーティングし、ECチャンバーに入れた。透過光画像は10倍の対物レンズを用い、96ウェルでは1ウェルあたり4部位、384ウェルでは1ウェルあたり1部位、1-2時間ごとに取得した。画像取得中に自動画像解析を行った。IX-Pico ECカセットを使用した場合、エッジ効果がないことに注意。
透過光イメージングと解析を用いて、抗がん化合物の効果のタイムコースを評価した。細胞増殖に対する化合物の効果は、生細胞イメージングで2時間ごとに画像を取得し、合計24時間モニターした。スタウロスポリンとマイトマイシンCについて、用量依存的な細胞増殖阻害が観察された(図3)。化合物の効果を特徴付けるために、細胞増殖阻害(細胞数の減少)に対する化合物EC50値を、SoftMaxPro®Softwareによる4パラメータカーブフィット処理アルゴリズムを用いて算出した(図3B)。
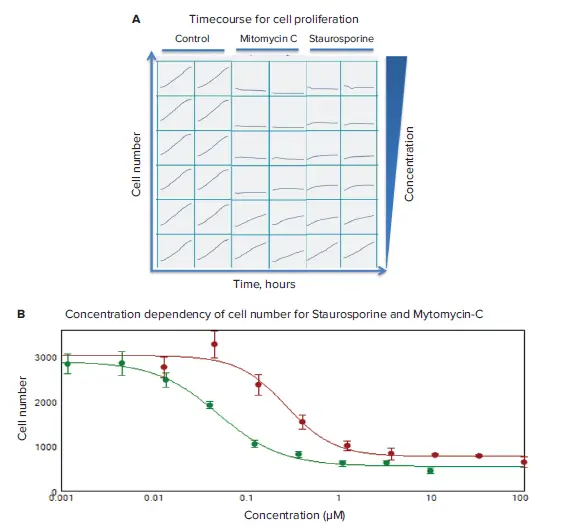
*図3. 細胞増殖のタイムコースと細胞数の濃度依存性。(A)対照ウェルと標記化合物の濃度を上げて処理したウェル(二重ウェル)のセル数の時系列データを可視化したもの。**マイトマイシンC(赤、IC500.27μM)およびスタウロスポリン(緑、0.05μM)の24時間後の濃度依存性。
蛍光マーカーを用いたリアルタイムでの分裂細胞の同定
ヒストンタンパク質mCherry-H2BとTubulin-GFPを安定発現させたHeLa細胞の細胞分裂をモニターした。蛍光標識したヒストンと細胞骨格タンパク質チューブリンを用いることで、細胞周期を進行する個々の細胞を追跡することが可能であった。図4は5つのセルを示しており、それぞれの細胞は12時間以内に分裂する。細胞間ブリッジと形成中の紡錘体極が見える(白矢印)。小さくて明るい核を持つ分裂細胞は、画像解析を用いて同定できる。細胞の総数と細胞の広がりは、すべての核(H2B-mCherry)とGFP(チューブリン)染色の面積を数えることによってもモニターできる(図4B)。
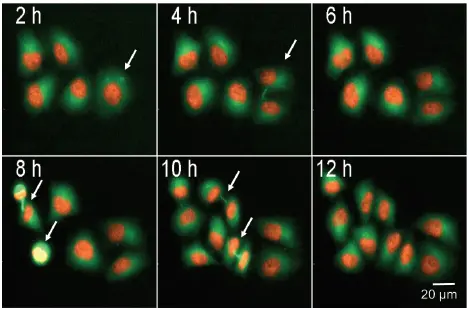
***図4. 有糸分裂細胞のライブセル検出。
細胞分裂中のmCherry-H2B, Tubulin-GFPを安定に発現するHeLa細胞を示す一連の画像。有糸分裂細胞は矢印で示し、画像は10倍の対物レンズとFITCおよびTRITC照明を使用して25時間、2時間ごとに取得した。有糸分裂細胞のパーセンテージ(%)は、全細胞数と有糸分裂細胞数との比を計算することによって数えることができる。
結論
全体として、我々の結果は、環境制御チャンバーと生細胞のタイムラプスイメージングを、細胞分裂のモニタリングと化合物の効果の評価にリアルタイムで活用できることを実証している。フライ上での画像解析により、実験中の細胞培養と細胞の表現型変化を自動でモニタリングできる。最後に、タイムラプスデータは簡単にMP4フォーマットにエクスポートし、ビデオとして保存することができます。
PDF版(英語)