Application Note ハイコンテントイメージャーによる
ミトコンドリアの動態と表現型のモニタリング
- 高品質の画像を取得し、ミトコンドリアの形状および構造の変化をよりよく可視化する。
- ミトコンドリアの表現型変化をより効率的かつ正確に定量化および測定する
- 様々な細胞モデルにおいて、疾患のメカニズムを理解し、化合物の毒性を評価する。
PDF版(英語)
はじめに
オクサナ・シレンコ博士|上級研究員|モレキュラー・デバイス
ジェイン・ヘズレー|シニア・アプリケーション・サイエンティスト|モレキュラー・デバイス
ミトコンドリアは細胞の主要なエネルギー源であり、細胞の代謝を調節する上で重要な役割を果たしている。ミトコンドリアは環境条件や細胞の要求に応じてその構造を変えることができる。ミトコンドリアの動的な性質は、分裂、融合、マイトファジー、生合成など、ミトコンドリアの形態を制御するいくつかのプロセスによって駆動される。
分裂は、円形でサイズが小さいミトコンドリアを大量に作り出す。融合は、細長い形状でサイズが大きい、より少量のミトコンドリアを作り出す。ミトコンドリアの分裂と融合という相反する過程は、いずれもミトコンドリアの品質管理と正常な細胞恒常性の維持に関わっている2, 3。分裂と融合の両方が、正常な細胞機能にとって重要である。
ミトファジーは損傷したミトコンドリアを除去するプロセスであり、正常なミトコンドリアのリサイクルの重要な構成要素である3。損傷または老化したミトコンドリアは、非対称分裂を起こす。健康な成分は新しいミトコンドリアに送られるが、損傷した成分はより小さな成分に分離され、偏光解消された後、マイトファジーによって速やかに除去される4。生合成とは、新しいミトコンドリア構成成分の合成をもたらすプロセスである。
ミトコンドリア動態の病理学的変化は、生体エネルギーの障害やミトコンドリアを介した細胞死を引き起こす可能性があり、虚血性心筋症、糖尿病、肺高血圧症、パーキンソン病やハンチントン病、骨格筋萎縮、アルツハイマー病など、幅広い病態に関連している1, 5。神経細胞は、解糖能が限られており、エネルギー使用量が多いため、ミトコンドリア機能の変化に対して特に敏感である6。ミトコンドリアの体積分画が最も多い心筋細胞もまた、ミトコンドリアの動態変化に対して特異的に敏感である7, 8。ミトコンドリア動態の変化は、多くの癌においても役割を果たしており、融合はアポトーシスシグナリングに対する細胞の感受性を低下させ、好気的解糖を誘導し(ワールブルグ効果)、アポトーシス細胞死を減少させることによって癌細胞の増殖を促進する可能性がある9。
ミトコンドリア動態の変化は、ストレスに対する正常な生理的反応である可能性がある。運動中の骨格筋における研究から、エネルギーの恒常性維持におけるミトコンドリアのフラグメントの役割が示唆されている。回復時には融合が活性化され、慢性的な運動ではミトコンドリアの生合成が活性化される10。
ミトコンドリア構造のリモデリングを研究するために、ハイコンテントイメージャーを用いることへの関心が高まっている。共焦点イメージングと水浸対物レンズは、画質を向上させ、ミトコンドリア構造をよりよく可視化することができる一方、画像解析のツールを利用することで、さまざまな表現型の数値的特徴を得ることができる。本研究では、細胞ベースアッセイにおけるミトコンドリアダイナミクスの研究に使用できる、ミトコンドリアの表現型と構造再配列の表現型アッセイについて述べる。
材料
ヒト神経芽細胞腫PC12細胞はATCCから入手した。Hoechst 33342およびMitoTracker Orange CMTMRosはThermo Fisher社から購入した。化合物はSigma社から購入した。
方法
ヒト神経芽細胞腫PC12細胞をGreiner社製384ウェルプレートに1ウェルあたり3,000細胞の密度でプレーティングした。翌日、ミトコンドリアに作用することが知られているいくつかのベンチマーク化合物、クロロキン(0~100μM)、ロテノン(0~10μM)、バリノマイシン(0~1μM)、メチル水銀(0~10μM)で18時間処理した。各化合物は、7つの異なる濃度、Half-log希釈で、n=8のサンプルサイズの4重反復で試験された。処理後、生細胞をミトコンドリア色素Mitotracker Orange CMTMRosと核色素Hoechst 33342の組み合わせ(それぞれ0.2μMと0.5μM)で30分間染色し、ImageXpress® Micro Confocalシステム(Molecular Devices)でイメージングした。生細胞の画像は、共焦点モードと40X水浸対物レンズを用いて撮影した。各ウェルについて3~4部位を撮像した。アッセイ性能を向上させるため、0.6~1μm間隔で3~4面のZ-スタック画像を取得した。核はDAPIチャンネルで、ミトコンドリアはTRITCチャンネルで、それぞれ100msおよび400msの露光でイメージングした。画像解析はMetaXpress®ハイコンテント画像取得・解析ソフトウェアのカスタムモジュールエディターを用いて行った。詳細は結果セクションで詳述する。簡単に説明すると、Find Fibersモジュールは細長いミトコンドリアを識別するために、Granularityモジュールはより真円度の高い粒子を識別するために使用した。セルごとの対物レンズをカウントするために、セル境界をアウトライン化した。二次解析は、ExcelまたはSoftMax® Proソフトウェアのカーブフィット処理ツールを使用して行いました。Z'値は、Z'=1-3*(STDEVcontrol+ STDEVexperiment)/(AVEcontrol- AVEexperiment)の式で計算した。
結果
ミトコンドリアの完全性と形状を明らかにすることは、疾患のメカニズムを理解し、毒性を評価する上で重要である。ミトコンドリアの数、輝度、大きさ、長さおよび形状は、ミトコンドリアがリサイクルされる過程で変化し、細胞の健康状態や代謝の変化を示すか、あるいはアポトーシスの過程に先行する可能性がある。我々は、対照PC12神経芽腫細胞のミトコンドリアの表現型を、ミトコンドリアのリサイクルを阻害するクロロキン、酸化的リン酸化の阻害剤であるロテノン、ミトコンドリアの膜電位を破壊するカリウムイオノフォアであるバリノマイシンなど、ミトコンドリアに影響を与えることが知られている化合物による変化と比較した。細胞を様々な濃度の化合物で4回に分けて18時間処理した。MitoTracker OrangeとHoechst核色素で染色した細胞のイメージングを、40倍の水浸対物レンズを用いて共焦点モードで撮影した結果、個々のミトコンドリアを分離し、ミトコンドリアの形状の変化をモニターすることができた。
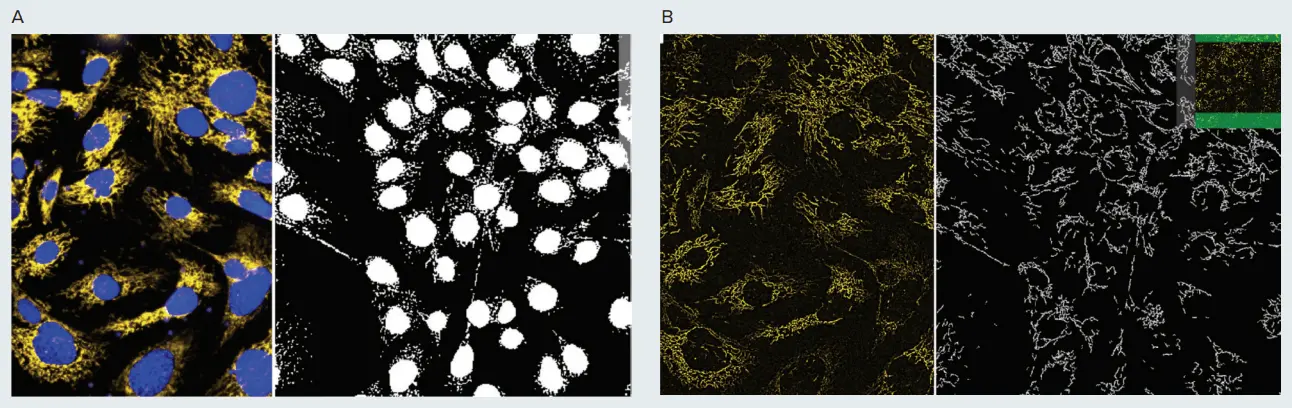
図1. ミトコンドリア形状の表現型解析。PC12神経芽細胞腫細胞をMitoTracker OrangeとHoechstで15分間染色し、40倍の水浸対物レンズを用い、IXM-Cで共焦点モードでイメージングした。画像はMetaXpressカスタムモジュールエディターのGranularityモジュール(A)とFind Fibersモジュール(B)を用いて解析した。A. 核は青色、インタクトなミトコンドリアは黄色で示す。分割画像では、核とミトコンドリア(顆粒)のマスクが右側に白く表示されている。B. 黄色のミトコンドリア画像は、画像鮮明化アルゴリズム(Top Hat)で前処理した。右の分割画像は「繊維」構造のマスクを示す。
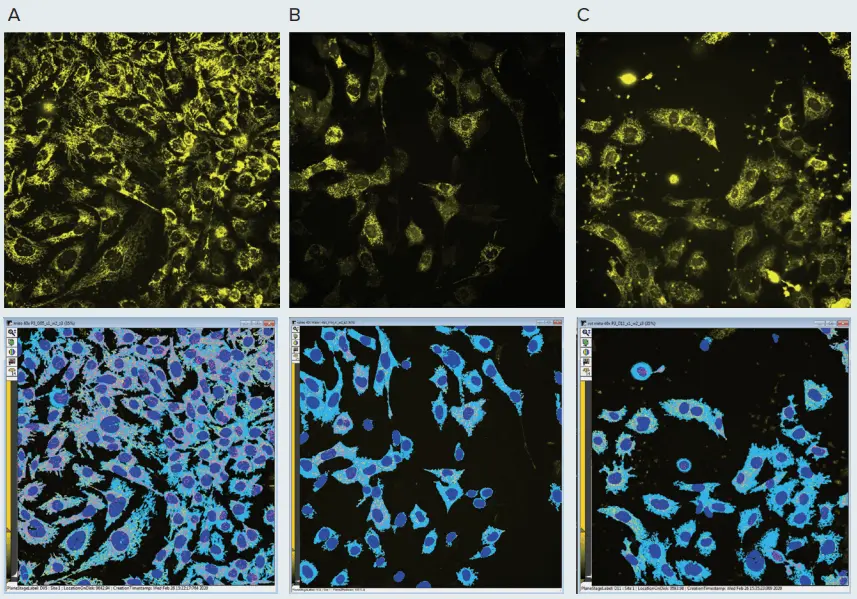
図2. ミトコンドリアに対する化合物の影響。上のパネルは、コントロールのPC12神経芽細胞腫細胞(A)、またはミトコンドリアにダメージを与えることが知られている化合物(バリノマイシン(B)およびロテノン(C))100 nMで18時間処理した細胞のMitoTracker CMTMRosミトコンドリア染色(黄色)。細胞はIXM-Cで40倍の水浸対物レンズを用い、共焦点モードでイメージングした。ミトコンドリアをよりよく可視化できるように、画像の輝度表示を調整した。ミトコンドリアの形状の変化に注意:バリノマイシンではミトコンドリアの糸が小さな粒子にフラグメント化し、ロテノンではミトコンドリアがもつれ、崩壊している。画像はMetaXpressカスタムモジュールエディターを用いて解析した。下のパネルの解析マスクは、ミトコンドリアの顆粒(ピンク)と繊維構造(黄色)、核(紺色)、およびセルボディ(水色)を示す。
図1および図2は、ミトコンドリア、コントロールサンプル、および化合物で処理したサンプルの画像である。例えば、図2に示したミトコンドリアの表現型の変化に注目してほしい。コントロール細胞ではミトコンドリアファイバーが長く伸びているが、バリノマイシンによる処理ではミトコンドリアの断片化と分裂が起こり、ミトコンドリアが小さな点として観察された。ロテノンで処理すると、ミトコンドリアはフラグメント化し、核の周りに凝縮した。重要なことは、バリノマイシンとロテノンの両方が、ミトコンドリアの蛍光強度の減少に反映されるミトコンドリア電位の喪失を引き起こしたことである(図2)。クロロキンの影響は目視観察では明らかではなかったが、画像解析測定の結果、形態の明らかな変化が認められた(下記参照)。化合物効果の濃度依存性が観察された(図2)。形態学的変化は低濃度の化合物ではっきりと観察された。より高濃度の化合物は、ミトコンドリア電位の喪失、ミトコンドリアの破壊、進行性の細胞死を引き起こした。
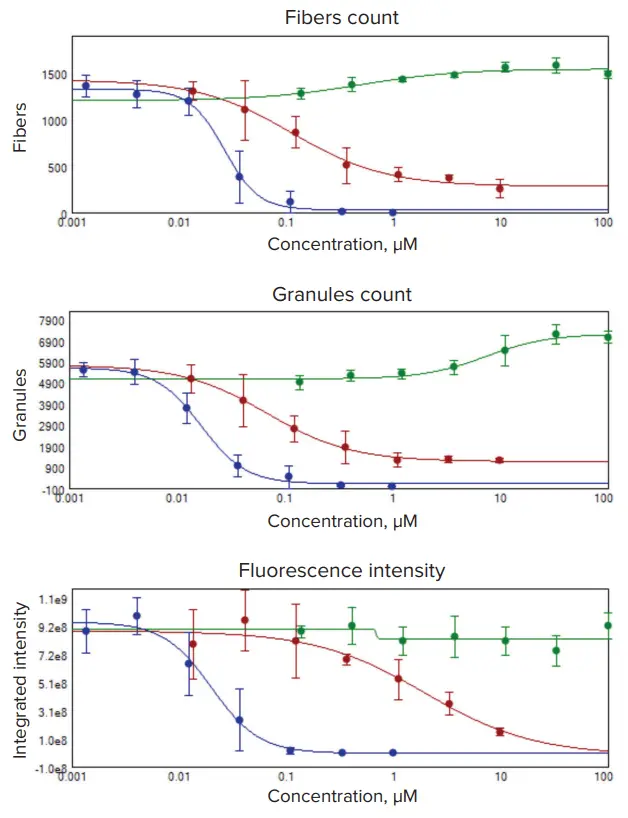
図3. ミトコンドリアのリサイクルを阻害するクロロキン、酸化的リン酸化を阻害するロテノン、ミトコンドリア膜電位を破壊するカリウムイオノフォアであるバリノマイシンでPC12神経芽腫細胞を処理したときの濃度依存性。セルは、18時間、4連複で指示濃度の化合物で処理した。細胞は図1および2に記載したように染色されイメージングされた。画像解析により、ミトコンドリアの構造は「線維」(上)または「顆粒」(中)と同定された。EC50値は、4重反復サンプルと4パラメトリックカーブフィット処理を用い、濃度依存性から算出した。追加プロットはミトコンドリア染色における蛍光強度の変化を示す。クロロキンは緑、ロテノンは赤、バリノマイシンは青で示した。
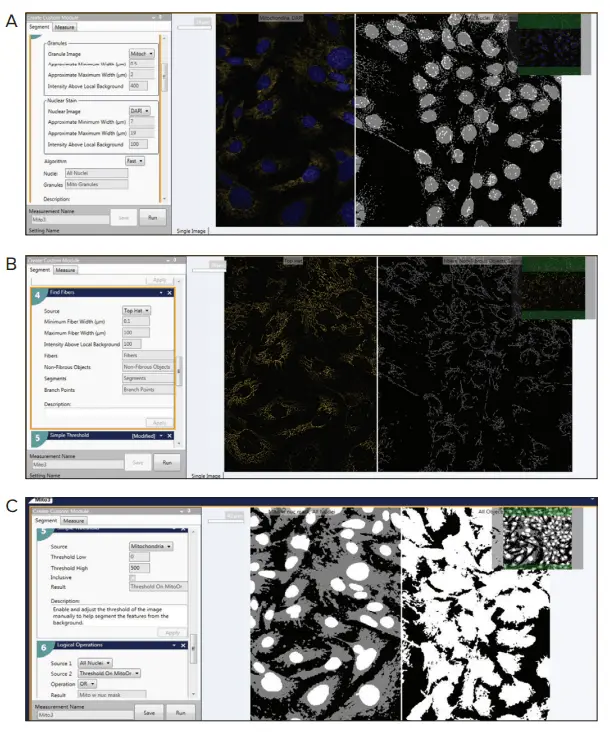
図4. カスタムモジュールエディター(説明)。カスタムモジュールエディターは、ミトコンドリアの健康、代謝性、リサイクル、化合物の効果、および疾患の状態を評価するために、ミトコンドリアの表現型をカウントおよび解析するように設計された。
このモジュールには以下のステップが含まれます:
- 粒度モジュール、ミトコンドリア粒子を検出する。
- Top Hatフィルターによるミトコンドリア画像の前処理。
- ミトコンドリア粒子とその分裂・融合を検出するFind Fibersモジュール。
- 細胞体を識別するための簡単な閾値
各対物レンズの測定値は、カスタムモジュールの最終ステップで定義されるように、各画像内のオブジェクトの総数を決定するため、または各細胞ごとに決定するために適用することができます。関連する測定値は仕様に依存する。最も興味深い測定は以下の通りです:
- 核数(セル数)
- 核の平均面積/平均強度
- 顆粒総数(部位ごと)
- セル:顆粒(セルあたり)
- 顆粒面積(平均)、顆粒面積(合計)、顆粒強度Aveまたは統合強度(平均)
- 総繊維(画像あたり)
- . セル: 繊維(セルあたり)
- 繊維長(平均)、繊維長(合計)、繊維強度(平均)
|
EC 50 , nM |
繊維数 | 顆粒数 |
|---|---|---|
| ロテノン | クロロキン | バリノマイシン |
| 112 ± 30 | 488 ± 1000 | 26 ± 2.3 |
| 68 ± 10 | 7260 ±2000 | 17 ± 2.0 |
***表1
EC50値は図3に示す曲線から定量した。
形態測定は、MetaXpress® ソフトウェアのツールを使用して導き出した。我々は、"顆粒 "または "繊維 "として定義できる対物レンズの発見と特徴付けを可能にするカスタムモジュールエディターを利用した。顆粒はGranularityモジュールによって定義され、繊維状の構造(セグメント)はFind Fibersモジュールによって決定される。構造は、最小幅や最大幅、局所的な背景に対する強度など、ユーザー定義の基準によって決定される。画像の前処理(鮮明化)は、繊維をより明確にするためのオプションのステップとして使用された(図1)。対物レンズの数、面積、強度、長さ、および形状は、各対物に対して定義することができ、セルごと、または画像ごとに、平均値または合計値として表示することができる(図2)。これらの測定値は、ミトコンドリアの構造ダイナミクスを特徴付けるための数や表現型を記述することができ(図4)、また様々な化合物の用量反応や有効濃度を計算することができる(図3)。具体的には、ミトコンドリアに対して毒性を示すことが知られている薬剤で処理すると、ミトコンドリアの電位が低下するだけでなく(顆粒と繊維の両方のミトコンドリア粒子の数と強度の低下として検出)、全繊維長と平均繊維長も変化し、特にバリノマイシンによる処理で顕著であった(図4)。対照的に、ミトコンドリアのリサイクルを阻害するクロロキンによる処理では、ミトコンドリアが蓄積し、したがって線維の数が増加した。
| コントロール | ロテノン | クロロキン | バリノマイシン | |
|---|---|---|---|---|
| セル数 | 44.5c ± 9.5 | 30 ± 5.5 | 46 ± 8.7 | 57 ± 11 |
| 繊維数(合計) | 2606 ± 250 | 564 ± 47 | 3791 ± 287 | 32 ± 44 |
| 繊維長平均 (µm) | 4.4 ± 0 | 3.9 ± 0.1 | 5.3 ± 0.3 | 2.7 ± 0.2 |
| 繊維(セル当たり) | 131 ± 34.7 | 8 ± 1 | 383 ± 57.4 | 1 ± 0.9 |
| 繊維長合計(セル当たり) | 431 ± 87.3 | 68 ± 15.3 | 3457 ± 912 | 54 ± 11 |
| 顆粒(合計) | 4739 ± 413 | 963 ± 131 | 8088 ± 887 | 105 ± 54 |
| 顆粒(セルあたり) | 97 ± 24.8 | 5 ± 1.3 | 529 ± 94 | 2 ± 1.2 |
| 顆粒面積和(セル当たり) | 114 ± 39.6 | 18 ± 0.7 | 609 ± 231 | 0 |
| 顆粒平均強度 | 1009 ± 47.8 | 1342 ± 73.1 | 1068 ± 43.1 | 944 ± 23.1 |
***表2.
対照試料と化合物処理試料の異なる測定値の比較。データはコントロール試料、10 µMのクロロキン、300 nMのロテノン、10 nMのバリノマイシンのものである。
表2は、対照試料と化合物処理試料の異なる測定値の比較を示す。データは単一(中間)濃度の化合物:20μMのクロロキン、300nMのロテノン、100nMのバリノマイシンについて示した。ミトコンドリア線維の数と長さは、ロテノンとバリノマイシンで処理した後、用量依存的に顕著な減少が観察されたが、クロロキンは逆の効果を引き起こした。粒度分析によって決定された顆粒の数と面積もまた、バリノマイシンとロテノンによって減少した。この方法は様々な測定値を導き出すことができ、このマルチパラメトリックアプローチは、複雑な生物学的変化の複数の側面に対するシグナル伝達経路の効果や化合物の効果を定義するために用いることができる。
| Z'値 | WI 40X | Air 40X |
|---|---|---|
| 全繊維 | 0.52 | 0.42 |
| 顆粒 | 0.55 | 0.41 |
| セグメント合計 | 0.5 | 0.38 |
***表3.
水浸対物レンズは、空気対物レンズと比較して、画像の質を改善し、より高いZ値で粒子数をより正確に同定する結果となった。
アッセイ開発中、水浸対物レンズと空気対物レンズの画質と分析への影響を比較しました。注目すべきは、水浸対物レンズを使用すると画像の質が向上し、一般的にZ'値が増加したことである(表3)。本分析は繊維と顆粒を区別しないので、繊維と顆粒の値は推奨プロトコルを用いて別々にカウントした。使用したカスタムモジュールの説明を図5に示す。このモジュールは、特異性のある細胞タイプや疾患モデルに合わせて調整したり、さらに変更したりすることができる。
結論
ハイコンテントイメージャーと高度な画像解析を用いたミトコンドリア動態解析法について述べた。提案した方法は、ミトコンドリアの表現型変化の定量化を可能にし、疾患表現型や化合物効果を特徴付けるための正常および病理学的構造変化の研究に用いることができる。自動化されたイメージング法は、様々な細胞イメージングモデルにおける薬剤開発や化合物の毒性評価に応用できる。
参考文献
- Roberta A. Gottlieb, M.D., and Daniel Bernstein, M.D. Mitochondrial Remodeling: 再配列、リサイクル、リプログラミング。セルカルシウム。2016 Aug; 60(2): 88-101.
- Yisang Yoon, Eugene W Krueger, Barbara J Oswald, Mark A McNiven. ミトコンドリアタンパク質hFis1は、ダイナミン様タンパク質DLP1との相互作用を通じて、哺乳類細胞のミトコンドリア分裂を制御する。Mol Cell Biol , 23 (15), 5409-20 2003年
- McLelland GL, Soubannier V, Chen CX, McBride HM, Fon EA. パーキンとPINK1は、ミトコンドリアの品質管理を制御する小胞輸送経路で機能している。2014;33:282-295.
- ミトコンドリアの分裂と選択的融合は、オートファジーによるミトコンドリアの分離と除去を支配している。Embo J. 2008;27:433-446.
- アーチャーSL. ミトコンドリアの動態--ヒト疾患におけるミトコンドリアの分裂と融合。N Engl J Med. 2013;369:2236-2251.
- Qi X、Disatnik MH、Shen N、Sobel RA、Mochly-Rosen D. Aberrant mitochondrial fission in neurons induced by protein kinase C{delta} under oxidative stress conditions in vivo. Molecular biology of the cell. 2011;22:256-265.
- Yu T, Sheu SS, Robotham JL, Yoon Y. ミトコンドリア分裂は、活性酸素種の産生増加を介して高グルコース誘導細胞死を媒介する。Cardiovasc Res.
- Sang-Bing Ong , Sapna Subrayan, Shiang Y Lim, Derek M Yellon, Sean M Davidson, Derek J Hausenloy. ミトコンドリア分裂の阻害は虚血・再灌流障害から心臓を守る。サーキュレーション , 121 (18), 2012-22 2010
- Suen DF, Norris KL, Youle RJ. ミトコンドリア動態とアポトーシス。Genes Dev. 2008;22:1577-1590.
- Konopka AR, Suer MK, Wolff CA, Harber MP. ヒト骨格筋のミトコンドリア生合成と品質管理のマーカー: 加齢と有酸素運動トレーニングの影響。The journals of gerontology. シリーズA、生物科学と医学2013。
PDF版(英語)