Application Note 生細胞イメージングでアポトーシスの複数のステージをモニタリング
- 完全な環境制御による生細胞タイムラプスイメージングの実行
- 表現型の変化をリアルタイムでモニター
- 単一の解析モジュールで複数の表現型を解析
- カイネティックデータレポートを自動生成
PDF版(英語)
はじめに
Matthew Hammer|アプリケーションサイエンティスト|Molecular Devices
アポトーシスの研究は、創薬や薬剤開発において非常に重要な側面である。さらに、アポトーシスと酸化ストレスなどの他の因子との関係を研究することは、アポトーシスの調節異常と関連する特異性疾患を理解する上で極めて重要である。早すぎる細胞死やアポトーシスは、アルツハイマー病、パーキンソン病、様々な自己免疫疾患と関連している1,2,3。逆に、がんなどの疾患は、アポトーシス経路の破壊につながる突然変異によって引き起こされる、制御不能な増殖によって定義される。
細胞ベースアッセイは、薬剤の細胞毒性作用を明らかにし、その作用機序を研究するための効率的なモデルである。さらに、薬物による細胞死の背後にあるメカニズムを特定し、アポトーシスをモニターすることで、薬物を改良し、意図しない毒性を防ぐことができる。タイムラプスライブセルアッセイは、エンドポイントアッセイと比較して、この点で明確な利点を提供する。化合物処理に反応する表現型の変化をリアルタイムでモニターすることができ、また一過性のイベントの評価も可能である。また、エンドポイントアッセイを読み取る適切な時間や、化合物試験に望ましい濃度範囲を明らかにすることで、アッセイの最適化にも役立つ。
HeLa細胞に対する抗がん化合物の細胞毒性効果を調べるために、2つのアポトーシスアッセイを実施した。長期タイムラプスイメージングは、ImageXpress® Pico Automated Cell.イメージングシステム。生細胞のコンディションは、ImageXpress Picoシステム内の完全統合型環境制御コンポーネントで維持された。このコンポーネントでは、CO2、O2、温度、湿度をすべてCellReporterXpress™画像取得・解析ソフトウェア内で制御することができる。
材料
- HeLa細胞
- HeLa培地(MEM、10% FBS、1% Pen/Strep)
- 生細胞イメージング培地(Fluorobrite DMEM、5% FBS、1% L-グルタミン、1% Pen/Strep)
- 96ウェルマイクロプレート(Greiner、cat. #655090)
- 384ウェルマイクロプレート (Corning Falcon, cat. #353962)
- スタウロスポリン(Millipore Sigma、cat. #S4400)
- パクリタキセル(Millipore Sigma、cat. #T7402)
- EarlyTox Nucview488 Caspase 3/7 Assay Kit(Molecular Devices、cat. #R8350)
- エチジウムホモダイマーIII(Molecular Devices、EarlyTox 生死アッセイキット、cat. #R8340)
- Hoechst 33342(インビトロジェン社製)
- CellROX ™ Deep Red 試薬(サーモフィッシャーサイエンティフィック、cat. #C10422)
- ImageXpress Pico 自動細胞イメージングシステムおよび CellReporterXpress 画像取得・解析ソフトウェア(Molecular Devices社製)
方法
セルヘルスアポトーシスアッセイ
HeLa細胞を384ウェルマイクロプレートに5,000細胞/ウェルの密度でプレーティングし、37℃、5% CO2で一晩インキュベートした。その後、細胞をHeLa培地中のHoechst 33342(3μM)で45分間染色した。インキュベーション後、NucView 488 Caspase 3/7(最終5μM)、Ethidium Homodimer III(EthD-III、最終1μM)および化合物の2倍溶液を添加する前に、Hoechst溶液を除去した。この第二染色液と化合物の希釈液は、フェノールレッドを含まない生細胞イメージング培地で作製した。化合物処理は、スタウロスポリンは10μM、エトポシドは100μMからそれぞれ1:2希釈でトリプリケートした。
酸化ストレスおよびアポトーシスアッセイ
HeLa細胞を8,000細胞/ウェルで96ウェルマイクロプレートにプレーティングし、37℃、5% CO2で一晩インキュベートした。その後、各ウェルから培地を除去し、3μMのHoechst 33342と5μMのCellROX Deep Red染色液を各ウェルに添加した。40分間のインキュベーション後、染色液を除去し、細胞を温DPBSで2回洗浄した。2X NucView 488 Caspase 3/7溶液(最終5μM)を、スタウロスポリンの1:2希釈液とともに、10μMからウェルに添加した。NucView 488溶液および化合物の希釈液は、生細胞イメージング培地で作製した。化合物処理は4重反復で行った。
長期生細胞イメージング
長期生細胞イメージングをImageXpress Pico環境制御システムで行った。プレートは、インストゥルメンテーション内のステージ上に設置され、周囲光から保護された所望の環境制御設定(5%CO2、85%湿度、20%O2、37℃)を完全に維持できるEnvironment Control Cassetteに設置した。細胞健康アポトーシスアッセイのために、2時間ごとに画像を取得する14時間のタイムラプス撮影を行った。酸化ストレスアポトーシスアッセイでは、1時間ごとに6時間画像を撮影した。両アッセイの撮影設定を表1に示す。 ECセンサーの測定値は撮影中に記録され、撮影の全期間を通じて環境制御設定のモニ タリングとQCが可能であった。
| 対物レンズ | (FOV) | サイト数 | 蛍光チャンネル(露光時間単位ms) |
|---|---|---|---|
| セルヘルスアポトーシスアッセイ | 10X (1.39 mm x 1.39 mm) | 1 (ウェルの17.63%) |
DAPI (10) FITC (200) テキサスレッド (100) |
| 酸化ストレスアポトーシスアッセイ | 20X (0.69 mm x 0.69 mm) | 4 (ウェルの5.1%) |
DAPI (10) FITC (200) Cy5 (500) |
表1. セルヘルスアポトーシスおよび酸化ストレスアポトーシスアッセイ用の取得設定。10倍の1サイトは384ウェルのマイクロプレートウェルの17.63%をカバーし、20倍の4サイトは96ウェルのマイクロプレートウェルの5.1%をカバーした。20倍の4部位取得は、シームレスなオンザフライのスティッチングのための画像スティッチング取得プロトコルで実行された。
画像解析
多波長解析により、細胞が細胞死の段階を経るにつれて、細胞の健康状態を測定できる。
図1に見られるように、CellReporterXpressの3チャンネル細胞スコアリング解析モジュールは、3つの蛍光色素の分布を測定し、化合物処理後の細胞表現型の明確な変化を定量化するために使用された。核の凝縮とカスパーゼの活性化は、アポトーシスの開始における重要なステップである。核凝縮は、Hoechst核色素の強度の増加と核の面積の減少によって見られた(図2A)。カスパーゼ3/7染色のみが陽性であったセルを初期アポトーシスとした(図1)。初期アポトーシスの最大細胞数は、試験した最高濃度のスタウロスポリンでは6時間後、最高濃度のエトポシドでは14時間後に確認された(図2B)。後期アポトーシスは、膜透過性の増加と、カスパーゼ染色とエチジウムホモダイマーIII染色がともに陽性である細胞の測定によって決定された。壊死細胞はエチジウムホモダイマーIIIのみ陽性のセルとして同定した。14時間の時点でカーブフィット処理を行い、試験化合物の用量反応曲線とEC50値を作成した(図3)。その結果、スタウロスポリンは0.039 μMから10 μMの間、エトポシドは7.5 μMから100 μMの間の濃度で、細胞生存率が用量依存的に劇的に低下することが示された。この時点で、高濃度のスタウロスポリンでは初期アポトーシスにあるセルの割合が減少し、一方で壊死細胞と後期アポトーシス細胞が増加した。エトポシドでは、7.5~100μMの濃度のセルは主に初期アポトーシスにあった。このことは、後期アポトーシスまたはネクローシスにある有意な細胞集団を誘発するには、時間経過を延長するか化合物濃度を上げる必要があることを示している。
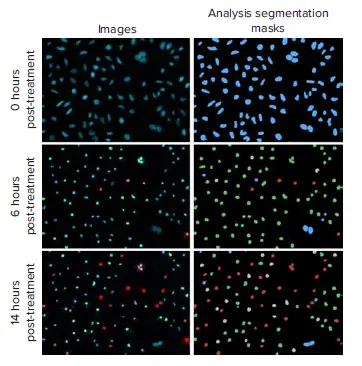
図1. スタウロスポリン(10μM)処理HeLa細胞の処理後0、6、14時間の代表画像と解析セグメンテーションマスク。CellReporterXpressソフトウェアの3チャンネル細胞スコアリング解析モジュールを用いて、アポトーシス表現型の異なる変化を解析した:生存細胞(青色マスク)、カスパーゼ陽性細胞(緑色マスク)、カスパーゼおよびEthD-III陽性細胞(灰色マスク)、EthD-IIIのみ陽性細胞(赤色)。
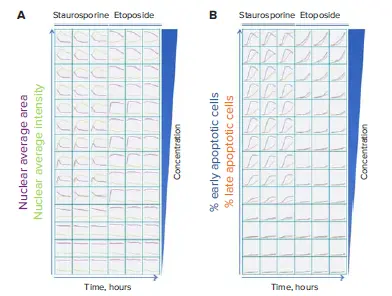
図2. 様々な濃度のスタウロスポリンとエトポシドで処理した後、14時間にわたってアポトーシスの段階をリアルタイムでモニターした。画像は2時間ごとに撮影した。A. 核凝縮はHoechst 33342核染色を用いて測定した。B. Hoechst 33342で染色したセルは、カスパーゼ3/7とエチジウムホモダイマーIII染色でスコア化し、細胞死の段階を示した。
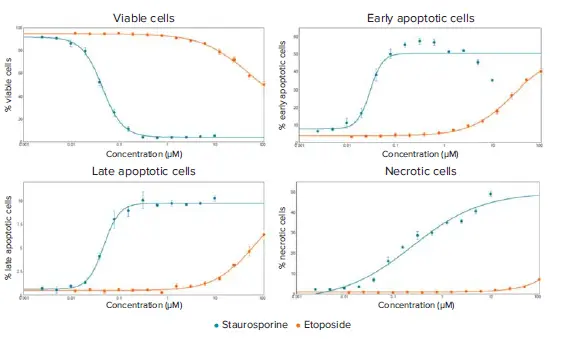
図3. スタウロスポリンとエトポシド処理細胞の14時間時点の用量反応曲線。EC50値は4つの曲線について作成した:%生存可能細胞(スタウロスポリン:0.044μM、エトポシド:48.61μM)、%初期アポトーシス細胞(スタウロスポリン:0. 029 μM、エトポシド:25.84 μM)、% 後期アポトーシス細胞(スタウロスポリン:0.047 μM、エトポシド:61.81 μM)、% 壊死細胞(スタウロスポリン:0.238、エトポシドEC50未到達)。
マルチ波長解析により、酸化ストレスとアポトーシスを同時に測定可能
タイムラプスを用いた反応の記録は、最適な実験エンドポイントや、望ましい効果を誘導する化合物の理想的な濃度を決定するのに有益である。また、同じウェル内で多数の生物製剤の活性を測定するのにも役立つ。図4に示すように、マルチ波長細胞スコアリング解析は、3つの異なる細胞集団を同定するために利用された。酸化ストレスとアポトーシスの最大反応はスタウロスポリンの投与量に依存した。高濃度3種では、活性酸素レベルは初期にピークに達し、その後3~4時間の間にカスパーゼ3/7活性化が増加するにつれてプラトー化した。低濃度のスタウロスポリンでは、アポトーシスを有意に誘導することなく、ROS陽性細胞とセルROX強度の漸増が認められた(図5と6)。このアッセイを単一のエンドポイントで実施するために、科学者はスタウロスポリン処理後6時間で画像化することを選択するかもしれない。
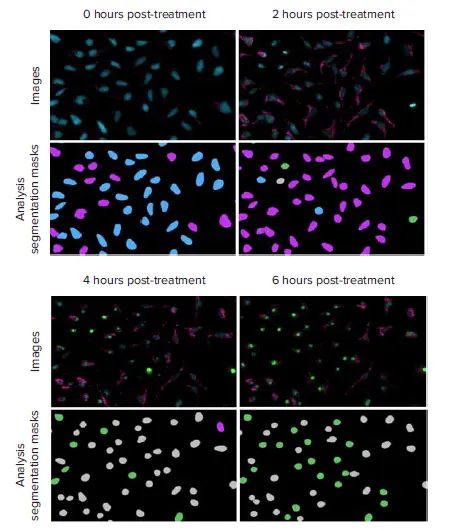
図4. 酸化ストレス蓄積とカスパーゼ活性化を経て進行するHeLa細胞の代表的な20倍画像と解析セグメンテーションマスク。これらの画像は5μMスタウロスポリンで処理したセルから得られた。画像:核(Hoechst 33342、青)、カスパーゼ3/7(NucView 488、緑)、活性酸素(CellRox Deep Red、ピンク)。3チャンネル細胞スコアリング解析を実行し、各時点における健常細胞(青)、酸化ストレスのみ陽性(ピンク)、カスパーゼ3/7のみ陽性(緑)、酸化ストレスとカスパーゼ3/7の両方陽性(灰色)の細胞の数と割合を測定した。
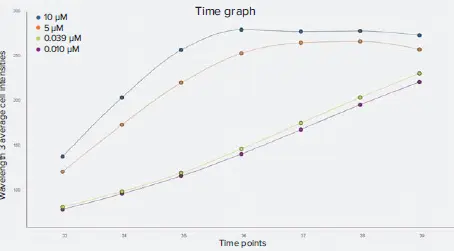
図5. Wavelength 3(CellROX Deep Red)の平均積算細胞強度のカイネティック時間グラフ。10 μM と 5 μM のデータポイントで表される最高濃度のスタウロスポリンでは、CellROX Deep Red 染色強度は約 3 時間と 4 時間でピークに達し、その後プラトーになった。低濃度のスタウロスポリンでは、CellROX Deep Red染色は時系列を通して徐々に増加した。
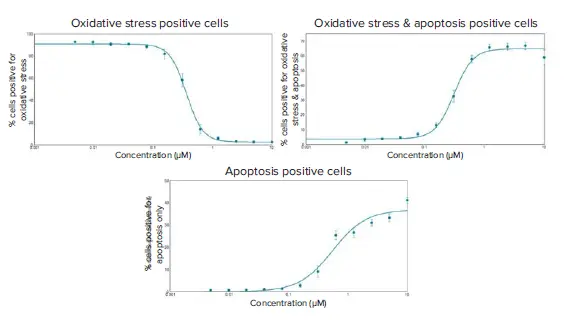
図6. 化合物処理後6時間のHeLa細胞におけるスタウロスポリン誘導酸化ストレスおよびアポトーシスの用量反応曲線。EC50値は、異なる表現型を示す3つの曲線について作成した:酸化ストレスのみ陽性細胞の割合:0.361 μM、酸化ストレスとアポトーシス陽性細胞の割合:0.314 μM、アポトーシスのみ陽性細胞の割合:0.547 μM。
結論
これらのアッセイは、複数の細胞健康マーカーを一度にリアルタイムでモニタリングするために、完全なライブセル環境条件下でタイムラプス撮影を実行することの利点を示している。環境制御機能を備えたImageXpress Pico自動細胞イメージングシステムは、細胞死の複数の段階を経て進行するHeLa細胞の時間的ビューを可能にする。さらに、これらの実験は、アポトーシスパスウェイの様々な段階にある細胞を測定し、抗がん化合物の細胞毒性効果に関する貴重な洞察を提供するための3チャンネル細胞スコア解析モジュールの有用性を示している。
参考文献
- J.M. Brown, L.D. Attardi (2005). 癌の発生と治療反応におけるアポトーシスの役割。Nat Rev Cancer 5(3):231-7.
- D.W. Dickson (2004). アルツハイマー神経原線維変性におけるアポトーシス機構:原因か結果か?J Clin Invest 114(1):121-30.
- W.G. Tatton, R. Chalmers-Redman, D. Brown, N. Tatton (2003). パーキンソン病におけるアポトーシス:神経細胞分解のシグナル。Ann Neurol 53(suppl 3): S61-70.
PDF版(英語)