Application Note SpectraMax iD5の高感度デュアルルシフェラーゼレポーターアッセイで
NF-κB活性化をモニタリング
- 高感度デュアルレポーターアッセイによるマルチプレックスフェラーゼアッセイ結果の検出
- レポーター発現をコントロールに正規化することで結果の精度を向上
- SoftMax Proソフトウェアの設定済みプロトコルで結果を迅速化
PDF版(英語)
はじめに
Cathy Olsen, PhD|Sr.アプリケーションサイエンティスト|Molecular Devices社
レポーター遺伝子は、様々なシグナル伝達経路や病態に関与する遺伝子の代用として、遺伝子発現を研究するための貴重なツールである。ルミノメーターや発光マイクロプレートリーダーで簡単に検出でき、細胞内の発光バックグラウンドが低いため、高いアッセイ感度が得られることから、ルシフェラーゼは最も一般的なレポーター遺伝子である。ホタルルシフェラーゼは、通常、目的の遺伝子の発現のためのリードアウトとして使用される。ウミシイ・レニラ・レニフォルミスのルシフェラーゼは、トランスフェクション効率、細胞生存率、およびアッセイサンプル間で異なる可能性のあるその他の因子を正規化するための第二のレポーターとして、マルチプレックスルシフェラーゼアッセイでよく使用されます。
SpectraMax® DuoLuc™ リポーターアッセイキットは、哺乳類細胞におけるホタルおよびレニラのルシフェラーゼの高感度定量を可能にします。最適化された2種類の検出試薬を連続注入することにより、同じマイクロプレートウェル内でルシフェラーゼをアッセイすることができます。その結果、実験シグナル(ホタルルシフェラーゼ)を構成的に発現しているコントロール(レニラルシフェラーゼ)に対して正規化することができる2シグナルアッセイシステムとなる。このアッセイは、SpectraMax® iD5 マルチモードマイクロプレートリーダーとSmartInject™ テクノロジー搭載インジェクターシステムとの使用に完全に最適化されています。
ここでは、DuoLucレポーターアッセイとSpectraMax iD5リーダーを使用して、哺乳類細胞モデルで核因子-κB(NF-κB)活性化を検出する方法を示す。NF-κBは、炎症、免疫、分化、増殖、アポトーシスを含む多くの細胞プロセスの遺伝子発現の「マスターレギュレーター」である。腫瘍壊死因子α(TNF-α)のようなシグナル伝達分子は、NF-κBの阻害因子を分解する細胞経路を刺激し、NF-κBを核内に遊離させ、そこで何百もの異なる遺伝子を制御することができる(図1)。
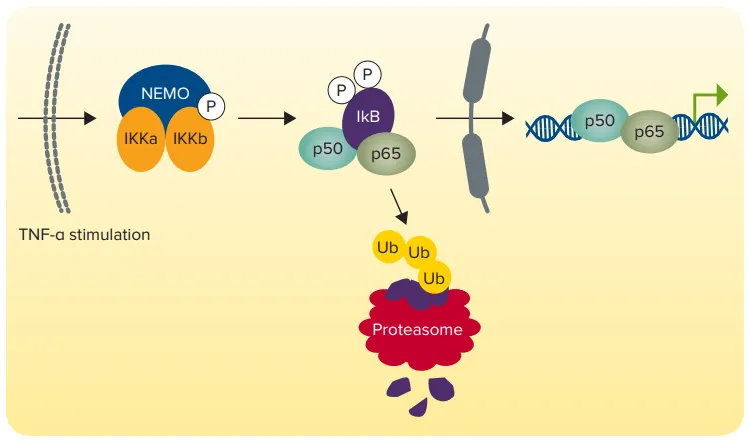
図1. NF-KBシグナル伝達経路。TNF-αはシグナルカスケードを活性化し、NF-KB阻害因子IKBの分解とNF-KB転写因子の核への放出をもたらす。
材料
- SpectraMax DuoLucレポーターアッセイキット(Molecular Devices社、商品番号R8361)
- HEK 293セル (ATCC cat. #CRL-1573)
- 培地 DMEM + 10%ウシ胎児血清 + ペニシリン/ストレプトマイシン
- pGL4.32[luc2P/NF-κB-RE/Hygro]ホタルルシフェラーゼベクター (Promega cat. #E849A)
- pGL4.75[hRluc/CMV]レニラルシフェラーゼ発現ベクター (Promega cat. #E693A)
- FUGENE HDトランスフェクション試薬 (Promega cat. #E2311)
- Opti-MEM 還元血清培地(サーモフィッシャーサイエンティフィック cat.)
- 96ウェル透明底白色ポリスチレンTC処理マイクロプレート(Corning cat.)
TNF-α 10μg/mL溶液(PBS+1mg/mL BSA)(シグマ社 cat. - BrightMax白色シーリングフィルム(Excel Scientific cat.)
- SpectraMax iD5® マルチモードマイクロプレートリーダー
◦SmartInjectテクノロジー搭載インジェクターシステム
方法
細胞の播種とトランスフェクション
コンフルエンス80%のHEK 293細胞をトリプシン処理で回収し、96ウェルクリアボトム白色マイクロプレートの各ウェルに15,000個ずつ分注した。細胞が50%以上のコンフルエンスに達した時点で、DNA量に対するFuGENEの比率を3種類変えて、NF-κB-REホタルルシフェラーゼとレニラコントロールベクターを共トランスフェクトした(表1)。セルを37℃の組織培養インキュベーターに入れ、24時間回復させた。
| トランスフェクション試薬とDNAの比率 | |||
|---|---|---|---|
| 3:1 | 2.5:1 | 2:1 | |
| 培地から最終容量 | 100 µL | 100 µL | 100 µL |
| DNA 量 | 2.2 µg(2 µg Fluc + 0.2 ng Rluc) | 2.2 µg(2 µg Fluc + 0.2 ng Rluc) | 2.2 µg(2 µg Fluc + 0.2 ng Rluc) |
| FUGENE HDトランスフェクション試薬量 | 6.6 | 5.5 | 4.4 |
表 1. トランスフェクション試薬の容量と試薬:DNAの比率を変えた場合のDNA量。
TNF-αによる誘導
10μg/mLのTNF-α溶液を培地で20ng/mLに希釈して誘導液を調製した。培地のみをコントロール液として用いた。処理するウェルから培地を除去し、各ウェルに100μLのコントロール液または誘導液を加えた。プレートをインキュベーターに戻し、7時間誘導した。
細胞溶解液の調製
処理したウェルから培地を除去し、セルをPBSで1回洗浄した。Passive Lysis Bufferを室温に温め、各ウェルに20μLずつ加えた。室温で15分間穏やかに振盪しながらセルを溶解した。発光アッセイシグナルを最大にするため、プレートの底にソリッド白色プレートシールを貼った。
ルシフェラーゼアッセイのセットアップ
キットの全成分を室温まで解凍した。2.2mgの凍結乾燥基質を封じ込めたバイアルに220μLの水を加え、ホタル基質を再構成した。Aquaphile coelenterazineは、440μgの凍結乾燥基質を含むバイアルに220μLの水を加えて再構成した。
ホタル作業溶液は、ホタル基質をホタルアッセイバッファーで1:50に希釈して調製した。Renilla working solution は Aquaphile coelenterazine を Renilla Assay Buffer で 1:50 に希釈して調製した。96ウェルプレート1枚につき、各基質220μLをプレーティングし、各作業溶液11mLを調製した。SoftMax® Proソフトウェアの設定済みプロトコルを使用して、以下のパラメータでアッセイを実行し、結果を解析した:
- インジェクター1を使用して、100μLのホタルワーキング溶液をウェルに添加する。
- 反応が発現するまで2秒間遅延させる。
- ホタルの発光を積分時間5秒で測定する。
- インジェクター 2 を使用して、100 μL のレニラ作業溶液をウェルに添加します。
- 2秒遅らせて反応を展開させる。
- 積分時間 5 秒でレニラ発光を測定する。
- 各アッセイウェルについて、最初の測定(ホタルルシフェラーゼ)の RLU 値を 2 番目の測定(レニ ラルシフェラーゼ)の RLU 値に正規化する。
SmartInject Technology搭載のSpectraMax iD5インジェクターシステムは、試薬注入時にアッセイプレートを揺動させ、試薬が完全に混合され、ホタルおよびレニラルシフェラーゼの両方で最大シグナルが得られるようにします。
結果
試験したすべてのトランスフェクション条件において、レニラルシフェラーゼのレベルは誘導に反応してほとんど変化せず、ホタルルシフェラーゼのレベルはサイトカインTNF-αの添加によって大きく増加した(図2)。全体として、ルシフェラーゼ発現は、試薬:DNAの比率が2:1では、試験した他の比率よりも低かった。
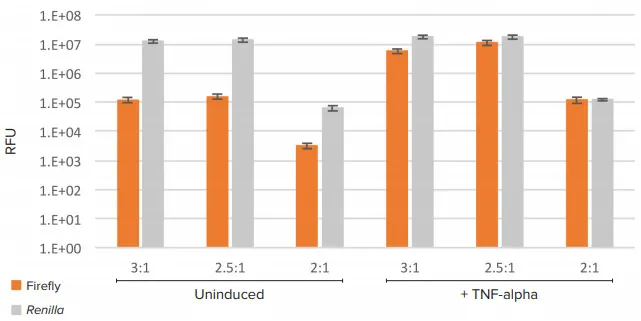
図2. ロー発光データ。各トランスフェクション条件(試薬:DNA比)について、非誘導細胞とTNF-a誘導細胞の値を示す。各試験条件についてN=9反復。
ホタルのシグナルをレニラのシグナルと正規化すると、3つのトランスフェクション条件すべてで高レベルの誘導が認められた(図3)。正規化比率の大きさは3:1および2.5:1の試験で低かったが、倍数誘導は大きかった。表2に、各試験条件で観察された倍数誘導値を示す。最良の倍数誘導は、試薬:DNA=2.5:1の比率で得られた。
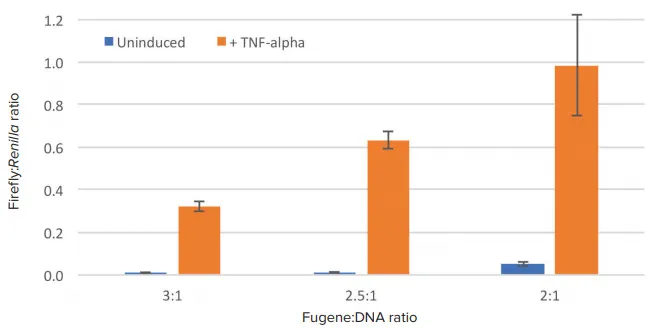
図3. 正規化ルシフェラーゼの結果。ホタルのRLU値はレニラの値に対して正規化した。
| 平均正規化FF:レニラ | |||
|---|---|---|---|
|
トランスフェクション条件(試薬:DNA) I |
誘導(+TNF-α) | 未誘導 |
誘導/非誘導 ) |
|
3:1 |
0.322 | 0.010 |
32 |
|
2.5:1 |
0.634 | 0.012 |
54 |
|
2:1 |
0.986 | 0.051 |
19 |
表2. トランスフェクション条件を変えた場合の誘導倍率。トランスフェクション試薬とDNAの比率を2.5:1にしたとき、最良の誘導が得られた。
結論
HEK293セルにおけるTNF-αによるNF-κB応答エレメントのロバスト性誘導が、DuoLucレポーターアッセイを用いて証明された。このアッセイはホタルとレニラの両方のルシフェラーゼに感度があるため、両方のルシフェラーゼで高いシグナルが得られた。正規化された比率から、試験した3つのトランスフェクション条件のうち最良の条件で、TNF-αによるNF-κB応答エレメントの54倍の誘導が明らかになった。
SpectraMax DuoLucレポーターアッセイは、SmartInjectテクノロジーを搭載したSpectraMax iD5リーダーで性能が最適化されている。データ収集・解析を簡素化するための設定済みプロトコルを備えた SoftMax Pro ソフトウェアにより、迅速、高感度、高信頼性のデュアルルシフェラーゼ・レポーターアッセイ結果を得るためのトータルソリューションが完成します。
参考文献
- Oeckinghaus, A and Ghosh, S. The NF-κB Family of Transcription Factors and Its Regulation. Cold Spring Harb Perspect Biol. 2009 Oct; 1(4): a000034.
PDF版(英語)