Application Note 腫瘍モデルにおける毒性測定のための
マルチパラメーター・イメージング・アッセイ
- 共焦点光学系を用いたスフェロイドのスクリーニング
- 無洗浄プロトコールでセル撹乱を避ける
- すべてのウェルでスフェロイドをテストする
- アッセイステップを増やすことなく、マルチプレックスフルオロフォア
PDF版(英語)
はじめに
トランスレーショナルリサーチを加速するために、がんや組織バイオロジーのモデリングに3Dスフェロイドを使用することへの関心が高まっている。本研究の目的は、化合物治療に対するヒト癌スフェロイドの表現型変化を特徴付けるハイスループット、ハイコンテントイメージャーおよび解析法を開発することである。スフェロイドは、腫瘍と同様に、表面に露出している細胞と深く埋もれている細胞、増殖している領域と増殖していない領域、低酸素の中心部と酸素が十分に供給された外側の細胞層の両方を含んでいるため、標準的な2次元(2D)細胞培養よりも腫瘍の挙動をより効果的に模倣できると考えられている。このような3Dスフェロイド・モデルは、潜在的ながん治療薬を同定するためのスクリーニング環境としてうまく利用されている。最適化されたスフェロイド細胞培養プロトコールは、アッセイ時間を短縮し、ばらつきを最小化するワンステップ染色手順で、U字底96ウェルおよび384ウェルプレートを使用する。スフェロイドの異なる表現型を効率的に比較できるように、3Dオブジェクトを通る複数のスライスからの細胞情報を1つの画像に統合するMaximum Projectionアルゴリズムを使用した。カスタム画像解析法を実装し、単一細胞およびスフェロイドの表現型のマルチパラメトリックな特徴付けを行った。様々な表現型の読み出しにより、マーカー特異性細胞数の定量化、細胞生存率とアポトーシスの測定、スフェロイドのサイズと形状の特徴付けが可能になった。
スフェロイドの培養
![]()
ヒト癌細胞株HCT 116からスフェロイドを形成するために、以下の方法を用いた。細胞をフラスコで37℃、5% CO2で培養した後、Fetal Bovine Serum (FBS)を添加した培地中で、96ウェルまたは384ウェルのCorning U字型ブラッククリアボトムプレート(それぞれCorning 4520および3830)に1000-1500細胞/ウェルの密度で持ち上げてプレーティングした。
化合物による処理
![]()
スフェロイド形成の24時間後に、化合物を10倍濃度でウェルに分注し、さらに4~6日間インキュベートすることにより、薬物処理を開始した。化合物は1倍濃度で2日ごとに再添加した。
マーカーの染色
![]()
化合物処理終了後、染色剤(表1)を4~6倍の濃度で1つのカクテルにまとめ、培地に直接加えた。スフェロイドを攪乱しないように、洗い流しが不要な染色剤を選んだ。抗がん化合物の効果を判定するために、生細胞と死細胞の割合を示すマルチパラメーター毒性アッセイが用いられた。
| 染色 | 目的 | 濃度 | インキュベーション |
|---|---|---|---|
| ヘキスト | 核マーカー | 24 μM (15 μg/mL) | 2 hour |
| カルセインAM | 生細胞インジケーター | 2 μM (2 μg/mL) | 2 hour |
| エチジウムホモ二量体 | 死細胞マーカー | 3 μM | 2 hour |
表1:毒性アッセイの染色条件。
画像を取得する
![]()
3D構造全体の細胞の反応を解析するために、ImageXpress® マイクロコンフォーカルハイコンテントイメージングシステムを使用して、スフェロイド体内の異なる深度から画像を収集した。MetaXpress®ハイコンテント画像取得・解析ソフトウェアは、数学的アルゴリズムを使用して、画像のスタックを単一の2Dプロジェクション画像に結合または折りたたみました。この場合、画像は最大投影法を用いて生成され、スタックの中で最も明るい強度を持つピクセルが2Dプロジェクション画像に保持される(表2)。
| 対物レンズ | 全Z厚 | 平面間距離 | 2D プロジェクション画像 |
|---|---|---|---|
| 10X Plan | Apo 180 | 25–35 μm | 最大 |
表2. 毒性測定に最適化された測定パラメータ。
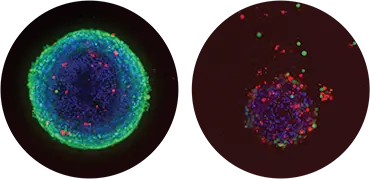
図1. 対照スフェロイド(左)と300 nMのマイトマイシンCで処理したスフェロイド(右)を10倍の対物レンズで重ねた画像。核(ヘキスト染色)青;生細胞(カルセインAM)緑;死細胞(エチジウムホモダイマー)赤。
分析
![]()
画像の定量的解析には、スフェロイドの形態学的特徴、セル含有量、複雑性を評価するパラメーターの導出が含まれた。化合物処理により、スフェロイドのサイズや幅が減少する可能性がある。共焦点スフェロイドイメージングは、個々の細胞の正確なカウントとスコアリングを可能にする。我々は、画像中の細胞の総数、カルセインAM陽性細胞の数(生細胞イメージング)、エチジウムホモダイマー(EthD-1)陽性細胞の数(死細胞イメージング)、および異なるマーカーを発現する細胞の平均面積と強度を報告した。MetaXpress®ソフトウェアのカスタムモジュールエディターをマルチパラメトリック画像解析に使用し、異なる生物学のアウトプットを定量化した(図2)。解析アルゴリズムは、Hoechst画像のスフェロイドを定義し、Calcein AMとHoechst染色を用いて細胞を「Live」としてスコア化し、EthD-1とHoechstの共局在を用いて細胞を「Dead」としてスコア化した(図3)。
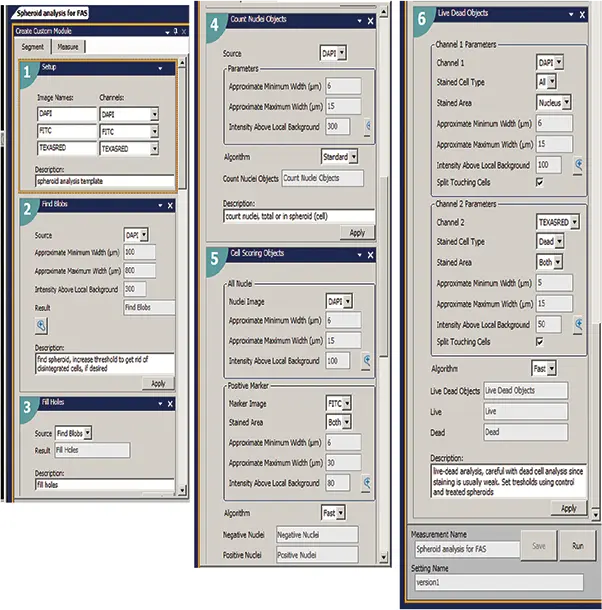
図2. カスタムモジュールを使って、まずDAPIチャンネルの核の画像を使いスフェロイドを特定した。このようにして、スフェロイドのサイズと、スフェロイド内および視野全体の全細胞数、生細胞数、死細胞数を記録することができた。次に、Count Nucleiモジュールで細胞の総数を同定し、Cell Scoringモジュールで代謝活性のあるCalcein AM陽性細胞の数を同定し、Live-Dead解析モジュールで生細胞(EthD-1陰性)と死細胞(EthD-1陽性)の数を同定して、画像を解析した。
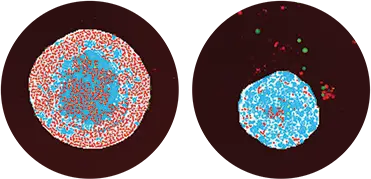
図3. スフェロイドの識別を示すセグメンテーションマスク。左がコントロールのスフェロイド。300nMのマイトマイシンCで処理した右側のスフェロイドは、生細胞数の減少とスフェロイドサイズの縮小を示す。
代表的な実験の結果を図4に示す。ウェル当たり1500個のセルを播種し、24時間後に異なる濃度の4種類の化合物で処理した後、さらに6日間化合物でインキュベートした。使用した化合物は以下の通りである: パクリタキセル、エトポシド、スタウロスポリン、およびマイトマイシンCである。化合物処理の結果、濃度依存的なスフェロイドサイズの減少、細胞数の減少、細胞生存率の低下が観察された。
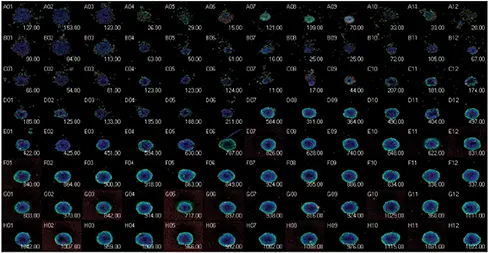
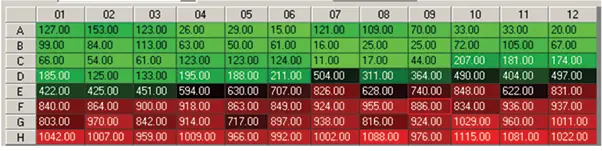
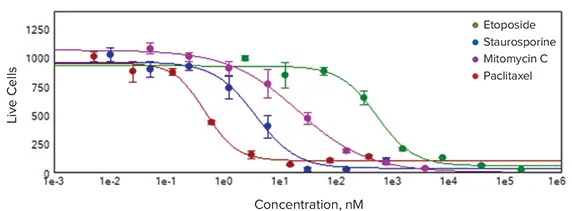
図4. 96ウェルプレートフォーマットにおけるスフェロイドアッセイのサムネイル図(上)。化合物の濃度は下から上に向かって増加した。MetaXpress®ソフトウェアのヒートマップに表示された生細胞数は、4化合物の用量反応を明確に示している(中)。パクリタキセル0.49nM;スタウロスポリン3.7nM;マイトマイシンC21.8nM;エトポシド537nM。
結論
in vivoの3D培養システムで均一なサイズのヒトがん細胞スフェロイドを作製し、ハイスループットのイメージングを用いて治療に対するスフェロイド応答をスクリーニングできることは、化学療法薬候補の関連試験を促進する上で重要なステップである。ImageXpress®マイクロ共焦点イメージングシステムとMetaXpress®ソフトウェアは、96ウェルまたは384ウェルフォーマットでの抗がん剤の細胞毒性をモニタリングするための迅速なイメージングと解析を可能にします。
これらのスフェロイドスクリーニングアッセイの撮影パラメーターの最適化に関する詳細は、論文を参照されたい: Sirenko, O. et al., High-Content Assays for Characterizing the Viability and Morphology of 3D Cancer Spheroid Cultures. Assay and Drug Development Technologies, 2015;13:402-414.
ImageXpress®マイクロコンフォーカルハイコンテントイメージングシステムについて詳しくはこちら >>
PDF版(英語)