Application Note 蛍光および化学発光ライブセルレポーターのマルチプレックスによる
NFkBシグナル伝達要件の解明
PDF版(英語)
はじめに

TNF-αによるNFκB応答エレメントの活性化をモニターするために、クローンテックラボラトリーズの化学発光Ready-To-Glow Secreted Metridia Luciferaseレポーターシステムを採用し、クローンテックの蛍光ベースのZsGreenプロテアソームセンサーと組み合わせた。この複合アッセイは、Molecular DevicesのSpectraMax® M5 マルチモードマイクロプレートリーダーのマルチ検出能力を用いて、TNF-α誘導、NFκB依存性シグナル伝達における活性プロテアソームの必要性を直接証明するために用いられた。両方のレポーターは、96ウェルプレートの同じウェルで、細胞を溶解することなく、完全にホモジニアスな方法で測定された。
NFkBのトランスロケーションはプロテアソームに依存する
プロテアソームは、ユビキチン依存的にタンパク質を短いペプチドに分解する巨大なタンパク質複合体である。プロテアソーム活性は、NFκBに基づく転写の制御に関与している。TNF-α刺激によってNFκBを活性化するには、IkBをリン酸化し、プロテアソームによって分解しなければならない。プロテアソームの分解が阻害されると、NFκBの活性化が損なわれる。
ZsGreenプロテアソームセンサー
Living Colors HEK 293 ZsGreenプロテアソームセンサー細胞株(Clontech Laboratories Cat. この安定的にトランスフェクトされた細胞株は、野生型ZsGreen蛍光タンパク質5とプロテアソーム標的配列との融合体をコードするプロテアソーム・センサ・ベクター(クローンテック・ラボラトリーズ Cat. しかし、プロテアソームの機能が低下すると、ZsProSensor-1は速やかに蓄積し、蛍光マイクロプレートリーダーやフローサイトメトリーで容易にモニターすることができる。(4, 7-8) ZsGreenプロテアソームセンサーは、SpectraMax® M5 マイクロプレートリーダーでプロテアソーム活性を定量的にモニターするのに使用されたことがある。
分泌型メトリディア・ルシフェラーゼ
Ready-To-Glow Secreted Luciferaseは、クローンテック社の配列およびヒトのコドンに最適化された分泌型メトリジア・ロンガ・ルシフェラーゼを利用した化学発光、酵素ベースのレポーターである。このアッセイは、高い倍数誘導、安定性と高輝度シグナルを示し、酵素ベースのシステムならではの高感度を有している9-10。
SpectraMax M5マルチモードマイクロプレートリーダー
SpectraMax M5マイクロプレートリーダーは、専用のシングルモードリーダーと同等のアッセイ性能を持つ、ベンチトップのデュアルモノクロメーター マルチ検出装置です。このリーダーには5つの検出モードがある: 検出モードは、紫外可視吸光度、蛍光強度、時間分解蛍光、蛍光偏光、発光の5つである12。
データ収集、解析、管理は、Molecular DevicesのSoftMax® Proソフトウェアを用いて行った。このソフトウェアは、Molecular Devicesのすべてのベンチトップマイクロプレートリーダーにこれらの機能を提供し、クロスプレート解析やカスタム計算を可能にする13。
プロテアソームの状態とNFκBシグナル伝達の観察
プロテアソーム活性とNFκB依存性シグナルトランスダクションを関連付けるために、プロテアソームセンサーセルラインに、NFκB応答エレメントによって駆動されるReady-To-Glow分泌型メトリジアルシフェラーゼをコードするレポーターベクターを一過性にトランスフェクトした。プロテアソームの活性をモニターするためにZsGreen蛍光を用い、TNF-αの添加によるNFκBを介したNFκB応答エレメントの転写活性化を測定するためにMetridiaルシフェラーゼ化学発光を用いた。プロテアソームセンサーとReady-To-グローアッセイはともにライブセルアッセイであり、SpectraMax M5 マイクロプレートリーダーは蛍光モードと化学発光モードの両方で機能するため、測定は同一ウェル内の同一細胞でマルチプレックスフォーマットで行った。
トランスフェクトされた細胞は、プロテアソーム阻害剤ALLN(50 µM)の存在下または非存在下、TNF-α(25 ng/mL)で誘導された。ZsGreen蛍光シグナルを用いて細胞のプロテアソーム活性をモニターし、次に分泌されたメトリジアルシフェラーゼ基材を同じウェルに加え、化学発光シグナルを測定した。
ALLN非存在下では、低レベルのZsGreenしか観察されず、プロテアソームが活性化してZsProSensor-1タンパク質を分解していることが示された。プロテアソーム阻害剤ALLNで処理していないセルにTNF-αを誘導すると、トランスフェクト細胞の培地上清に高レベルのメトリジアルシフェラーゼレポーターが検出され、NFκB応答エレメントが活性化し、分泌型メトリジアルシフェラーゼの発現を駆動していることが示された。(図1参照)。
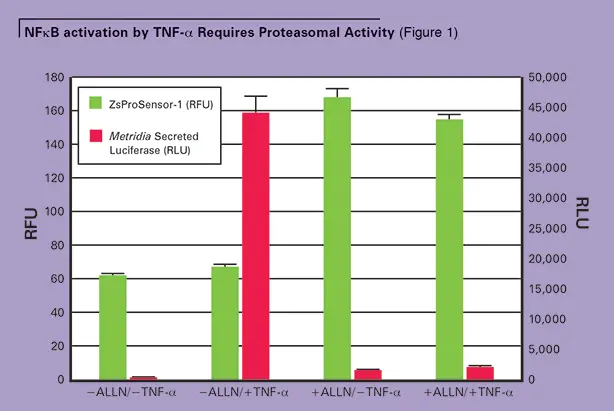
高レベルのメトリジアルシフェラーゼシグナルは、ALLNの非存在下およびTNF-αの存在下でのみ観察された。プロテアソームがALLNによって不活性化されると(ZsProSensor-1蛍光レベルの増加によってモニターされる)、NFkBシグナル伝達経路はTNF-α刺激に効果的に応答できなくなる。ALLN=N-アセチル-ロイシル-ノルロイシナル。
しかしながら、ALLNの存在下でセルをTNF-αで処理すると、高レベルのZsGreen蛍光が測定され、プロテアソームが不活性化されたことが示された。TNF-α誘導にもかかわらず、メトリジアルシフェラーゼ転写レポーターは低レベルしか検出されず、NFκBが効果的に活性化されていないことが示された(図1参照)。これらの結果を総合すると、TNF-α誘導性のNFkB依存性シグナル伝達にはプロテアソーム活性が不可欠であることがわかる(図2参照)。(図2参照)。
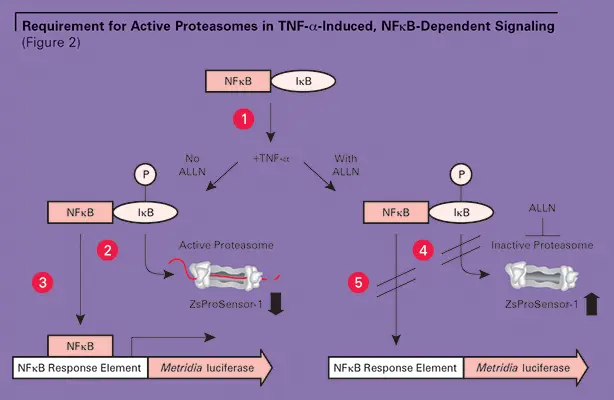
不活性なNFkBはIkBによって細胞質に隔離されている。NFkBが核に移動してシグナル伝達を開始するためには、IkBはTNF誘導によってリン酸化され(1)、プロテアソームによって分解されなければならない(2)。あるいは、プロテアソームがペプチドALLNによって阻害されると(4)、IkBは分解されず、NFkBはトランスロケーションできなくなる(5)。プロテアソームの状態(活性か不活性か)は、ZsProSensor-1レベルに基づいてモニターできる。
結論
プロテアソームセンサーとReady-To-Glowシステムを組み合わせることにより、TNF-αによる誘導でNFκBが転写を開始するには、活性プロテアソームが必要であることが、生細胞の単一培養で観察された(図2)。したがって、IkBのリン酸化/解離がNFκBシグナル伝達に十分であるという古典的見解は不完全である。
SpectraMax M5 マイクロプレートリーダーと付属の SoftMax Pro ソフトウェアにより、実験を次のように統一することができた:ZsGreen 蛍光測定の直後に、Metridia ルシフェラーゼ基質を同じウェルに添加し、化学発光を測定した。両方の測定値は、同じセルから、同じインストゥルメンテーションで、同じソフトウェアを使って取り込まれた。こうして、TNF-αによって誘導されるプロテアソーム活性とNFκB依存性シグナル伝達が同時にモニターされた(図1)。
従来、マルチプレックスアッセイのデザインは、(a)異なる蛍光タンパク質をマルチプレックスしてライブセルアッセイを作るか、(b)異なるルシフェラーゼをマルチプレックスして溶解ベースアッセイを作るかに限られていた。しかし、メトリジアルシフェラーゼは細胞溶解に依存しない分泌型レポーターであるため、蛍光と化学発光ベースのレポーター系を初めてマルチプレックスすることができ、両者の利点を1つの均一性ライブセルアッセイに統合することができた。同じウェル内で蛍光と化学発光のライブセルアッセイをマルチプレックスすることで、インテリジェントなアッセイ開発の新たな道が開かれる。
謝辞
Clontech LaboratoriesはMolecular Devices社のCathy Olsen氏の技術協力に感謝する。
参考文献
- Adams, J. (2002) Trends Mol Med 8(4 Suppl):S49-S54.
- Haas, M. et al. (1998) J Leukocyte Biol 63(3):395-404.
- Sun, L. and Carpenter, G. (1998) Oncogene 16(16):2095-2102.
- プロテアソームセンサーベクター。(2003年4月) Clontechniques XVII(2):14.
- Matz, M. V. et al. (1999) Nature Biotech 17(10):969-973. Erratum in Nature Biotech 17(12):1227.
- Li, X. et al. (1998) J Biol Chem 273(52):34970-34975.
- Living Colors セルライン。(2004年4月) Clontechniques XVII(2):14.
- Molecular Devices社製マイクロプレート蛍光光度計を用いた、生細胞におけるプロテアソーム阻害の測定。(2006) SpectraMax アプリケーションノート。Molecular Devices。
- Ready-To-Glow Secreted Luciferase System. (2006 年 7 月) Clontechniques XXI(2):12-13.
- Ready-To-Glow Dual Secreted Reporter System. (2006年10月) Clontechniques XXI(3):1.
- レディ-トゥ-グロー分泌型メトリジアルシフェラーゼの検出限界と直線範囲をMolecular Devices SpectraMax Lで測定した。
- SpectraMax M5/M5 eマルチ検出リーダー: 3モードのキュベットポートを備えた5モードマイクロプレートリーダー。Molecular Devices社のデータシート(2006年)。
- SoftMax Proソフトウェア: マイクロプレートデータ解析の業界標準。Molecular Devices社データシート(2006年)。
PDF版(英語)