Application Note Molecular Devicesマイクロプレートリーダーでの
MycoAlertマイコプラズマ検出アッセイ
- マイコプラズマ汚染を高感度で確実に検出
- 迅速な結果を得るためのシンプルな添加・読み取り法
- 結果の容易な解釈
PDF版(英語)
はじめに
原核生物の中で最も小さく単純なマイコプラズマは、細胞培養によく混入する。マイコプラズマ汚染の症状には、増殖速度の低下や、遺伝子発現を含む細胞応答の変化が含まれる。マイコプラズマは、細胞培養を顕微鏡で調べるだけでは検出できないため、汚染の有無を判断するには、高感度で信頼性の高いアッセイが必要である。従来のマイコプラズマ検出法では、時間のかかる染色やPCRのプロトコルが必要であり、結果の解釈も困難であった。
LonzaのMycoAlert™アッセイとMycoAlert PLUSアッセイは、発光マイクロプレートリーダーを用いて、細胞培養中の生存マイコプラズマを迅速かつ簡便に検出する方法を提供します。このアッセイは、主要なマイコプラズマ種に見られるマイコプラズマ特異的酵素を利用して、汚染をスクリーニングします。MycoAlert PLUSアッセイは次世代キットで、標準のMycoAlertキットよりも高い光出力を提供し、未使用の培地、培地サプリメント、または水の検査と同様に、幅広い発光リーダーの使用を可能にします。セットアップ手順はどちらのキットも同じです。
アッセイの第一段階では、MycoAlert試薬をセル培養上清に加え、生存マイコプラズマを溶解し、バックグラウンドのATPから光を発生する生物発光ルシフェラーゼ反応を開始する(図1)。第二段階では、MycoAlert基質が添加され、放出されたマイコプラズマ酵素と反応し、ADPをさらにATPに変換する。その後、プレートリーダーで生物発光を検出し、MycoAlert基質添加前後のサンプル中のATPレベルを測定する。
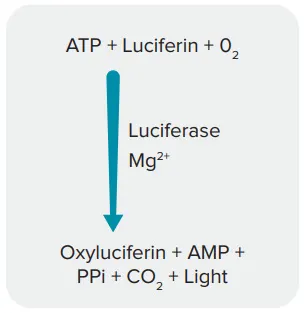
図1:ATPを検出する生物発光反応。
基質添加の前後にプレートリーダーで測定し、マイコプラズマが存在するかどうかを示す比率を得る。マイコプラズマ酵素が存在しない場合、2回目の測定値は1回目の測定値より増加しないが(MycoAlertアッセイでは0.9未満、MycoAlert PLUSでは1.0未満)、サンプルがマイコプラズマ陽性の場合、2回目の測定値は1回目の測定値より高くなる(比>1.2)。図2にアッセイのワークフローの概要を示します。
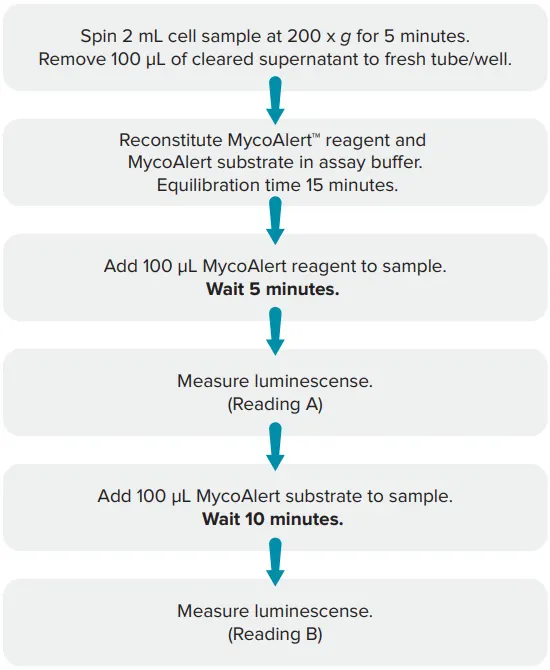
図2. MycoAlertアッセイのワークフロー。測定値Bの発光を測定値Aで割って、マイコプラズマの存在(比率>1.2)または非存在(MycoAlertアッセイでは比率<0.9、MycoAlert PLUSでは<1.0)を示す比率を得る。
このアプリケーションノートでは、発光アッセイモードを備えたMolecular Devicesマイクロプレートリーダーが、MycoAlertアッセイを用いた信頼性の高いマイコプラズマ検出において、いかに優れた感度と使いやすさを提供するかを示す。オリジナルのMycoAlertアッセイキットと、感度が向上した新バージョンのMycoAlert PLUSの両方をテストし、Molecular Devicesマイクロプレートリーダーとの互換性を示した。
材料
- MycoAlert Mycoplasma 検出キット(Lonza cat.)
- MycoAlert PLUS Mycoplasma Detection Kit(Lonza cat.)
- MycoAlert コントロールセット(Lonza cat.)
- 96ウェルポリスチレン白色ソリッドプレート(Greiner cat.)
- マイクロプレートリーダー
SpectraMax ® i3 マルチモードマイクロプレートリーダー
SpectraMax i3x マルチモードマイクロプレートリーダー
SpectraMax Paradigm® マルチモードマイクロプレートリーダー
SpectraMax M5マルチモードマイクロプレートリーダー
フィルターマックス™ F5 マルチモードマイクロプレートリーダー
SpectraMax Lマイクロプレートルミノメーター
メソッド
MycoAlertとMycoAlert PLUSアッセイの方法は、使用するアッセイコントロールの濃度範囲を除いて基本的に同じで、以下に詳述します。各キットは試薬を再構成したその日に使用した。
各アッセイフォーマットのMycoAlert Positiveアッセイコントロールの希釈系列を表1に示すように調製した。希釈はMycoAlert Assay Bufferで行いました。各サンプル100 µLをソリッド白色平底96ウェルプレートにピペッティングしました。サンプルはトリプリケートで行った。MycoAlert試薬を各ウェルに加え、室温で5分間インキュベートした。その後、発光検出モードの Molecular Devices マイクロプレートリーダーでプレートを読み取った(Read A)。その後、MycoAlert基質を各ウェルに添加し、プレートを室温で10分間インキュベートした。その後、プレートをプレートリーダーで再読した(Read B)。各サンプルの比率は、読み取り値B/読み取り値Aとして計算された。データはSoftMax® Proソフトウェアで作成および解析した。最終結果は、SoftMax Pro 6.5以降で利用可能な棒グラフ機能を使用して表示した。
| マイコアラート | マイコアラートプラス |
|---|---|
| 陽性コントロール | 陽性コントロール |
| 1:2 | 1:10 |
| 1:4 | 1:100 |
| 1:8 | 1:1000 |
| 1:16 | 1:10000 |
| 陰性コントロール | 陰性コントロール |
表1. MycoAlertおよびMycoAlert PLUSアッセイ用の標準希釈系列の調製。MycoAlert 陽性アッセイコントロールは、MycoAlert アッセイバッファーに示された比率で希釈した。
| パラメータ | 設定 |
|---|---|
| 読み取りモード | ルミネッセンス*(全波長) |
| 積分時間 | 1秒 |
| プレーティングタイプ | 96ウェルグライナー |
表2. MycoAlertアッセイの一般的なインストゥルメンテーション設定。*SpectraMax Paradigm リーダーは、このアッセイのシグナル検出に発光検出カートリッジを使用します。テストした他のすべてのリーダーは、統合ルミネッセンス検出モードを使用する。
結果
ルミネセンスリーダーの感度基準は、各キットについてLonzaにより定義されている。MycoAlert Kitの場合、アッセイコントロールサンプルは、少なくとも1:8の希釈で1.2以上の比率でなければなりません。MycoAlert PLUSキットの場合、少なくとも1:1000の希釈で1.2以上の比率を得る必要があります。
発光検出モードのMolecular Devicesマイクロプレートリーダーはすべて、MycoAlertおよびMycoAlert PLUSキットの両方で、Lonzaが指定した感度要件を上回った。MycoAlert および MycoAlert PLUS アッセイ用の SpectraMax i3x マルチモードマイクロプレートリーダーの代表的なデータを図 3 に示します。表3は、各アッセイに最低限必要なアッセイコントロール希釈についてテストしたすべてのMolecular Devicesプレートリーダーで得られた比率を示しています。
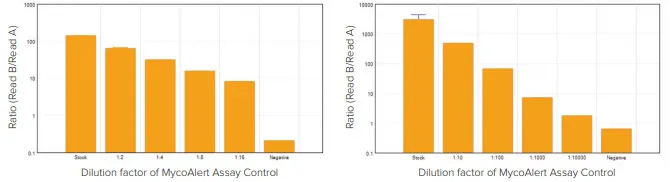
図 3:MycoAlert アッセイコントロールの希釈度を上げて検出する SpectraMax i3x リーダーの感度。陰性サンプルにはMycoAlertアッセイ緩衝液のみを封入。各キットについて、リーダーは最低希釈液を陽性として検出できた。アスタリスクは、各キットで最低限検出可能なアッセイコントロールの希釈度を示す。左:MycoAlert Assay Kit;右:MycoAlert PLUS Kit: MycoAlert PLUSキット。
| マイクロプレートリーダー |
マイコアラート比 (1:8アッセイコントロール) |
MycoAlert PLUS 比率
(1:1000アッセイコントロール) |
|---|---|---|
| SpectraMax i3x | 15.8 | 7.4 |
| SpectraMax M5 | 17.8 | 5.7 |
| SpectraMax Paradigm | 7.8 | 5.2 |
| FilterMax F5 | 9.8 | 2.9 |
| SpectraMax L | 9.8 | 9.0 |
表3. 最低限必要な希釈で得られたアッセイコントロールの比率。すべての比率が必要な閾値1.2を超えた。
結論
ここに示された結果から、発光検出モードを持つ全てのMolecular Devicesマイクロプレートリーダーは、MycoAlertおよびMycoAlert PLUSアッセイでマイコプラズマを検出するためにLonzaが設定した感度要件を上回っていることが確認された。どちらのキットでも、マイコプラズマ汚染を示すアッセイシグナルの最小限の増加は容易に検出できます。
Molecular Devicesマイクロプレートリーダーは、MycoAlertアッセイと組み合わせることで、マイコプラズマの高感度かつ迅速な検出を可能にし、細胞混入のモニタリングにかかる貴重な時間を節約します。
詳細はこちら >>
PDF版(英語)