Application Note 3D再構成ヒト脳微小組織における
神経突起伸長解析
- 内蔵の神経突起解析モジュールを使用して、複雑な構造のロバスト性画像解析を作成
- 使いやすく柔軟なカスタムモジュールエディターで解析アルゴリズムを調整し、下流の結果を改善
- 3D再構成ツールを使用して脳モデルを作成
PDF版(英語)
はじめに
Zhisong Tong | Research Scientist | Molecular Devices
Paul Adlard | Chief Scientific Officer | Tessara Therapeutics
器官型3D培養は、本来の3D組織構造に似ており、2D(単層)培養に比べ、より実際の組織を代表すると考えられている。次世代のin vitro細胞培養モデルとして、3Dバイオプリントスキャフォールド、organ-ona-chip、マイクロ流体ベースの3D細胞培養モデル、幹細胞由来のオルガノイドやスフェロイドなど、様々な3D培養コンストラクトが登場している。その中でもテッサラ・セラピューティクス社は、ヒト3D模倣神経マイクロティッシュを特徴とする新規のRealBrain®創薬スクリーニング・プラットフォームにより、3D器官培養を次のレベルに引き上げようとしている。
これらの微小組織は、初代あるいは人工多能性幹細胞(iPSC)由来の神経前駆細胞を、化学的に定義されたバイオマテリアルで構成された特許取得済みのハイドロゲルマトリックスに封入することによって作製される。これにより、試験管内で神経発達の自然な内因性プログラムを活性化するのに最適な微小環境が提供される。発達中の細胞は増殖し、微小環境を再構築し、遊走し、3次元的に自己組織化し、合成ハイドロゲルを細胞から分泌される細胞外マトリックス(ECM)に置き換える。さらに、マトリックスの光学的透明度が高いため、これらのマイクロティッシュはハイコンテントイメージングアプリケーションに理想的に適している。
神経ネットワークの複雑さを評価するためには、神経突起伸長の程度を定量化することが重要である。発達中のニューロンは、成長し、神経ネットワークに統合されるにつれて、新しい突起を作り出す。神経細胞の発生をモデル化した微小組織は、高度に相互接続された神経細胞を示すはずである。このような複雑な生物学的サンプルを大規模に可視化するには、3D画像を再構成できる緊密にオーケストレーションされた統合ワークフローによるハイコンテント画像取得と解析が必要です。
このアプリケーションノートでは、ImageXpress® Micro コンフォーカルハイコンテントイメージングシステムを用いて、蛍光マーカーで染色した3D神経マイクロ組織をイメージ化しました。その後、MetaXpress®ハイコンテント画像取得・解析ソフトウェアを用いて、3Dで再構成し、神経細胞の数とそれぞれのアウトグロースの程度を定量化する方法を開発した。この方法により、神経突起の数は細胞体の数と節の数に比例することがわかった。この種の解析は、ニューロンや神経回路網に対する化合物の影響の評価など、さまざまな応用が可能である。
MetaXpress カスタムモジュールエディターのワークフロー
MetaXpressカスタムモジュールエディター(CME)には、従来の画像処理に基づいた特定の解析タスクを実行するためのモジュールが組み込まれています。このモジュールは、画像から対物レンズを検出するモジュールと、対物レンズや画像を修正するモジュールの2つのカテゴリーで構成されています。対物レンズ」とは、ある生物学的サンプルの対象オブジェクトの領域をマークするマスクのことである。カテゴリーIのモジュールはさらに、あるZ平面または2Dプロジェクション画像から対物レンズを特定する2Dモジュールと、体積的に対物レンズを特定する3Dモジュールに分けられる。代表的な2Dモジュールは、神経突起伸長オブジェクト、セルスコアリングオブジェクト、血管新生オブジェクトなどである。CMEモジュールの分類。カテゴリーⅡのモジュールは、対物レンズを修正するモジュールと画像を修正するモジュールに再グループ化できる。対物レンズを修正する代表的なモジュールは、フィルタリング・マスク(filter mask)、グロウ・オブジェクト(grow objects)、ベストマッチによる接続(connect by best match)で、後者はベストマッチにより2Dオブジェクトから3Dオブジェクトを生成する。また、画像を修正するモジュールは、加算、乗算、最大値のような単純な演算から、トップハット、ガウシアン、LoGのような複雑なアルゴリズムフィルタまであり、より深い分析のためにカスタマイズされたアルゴリズムの強力なビルディングブロックとなります。
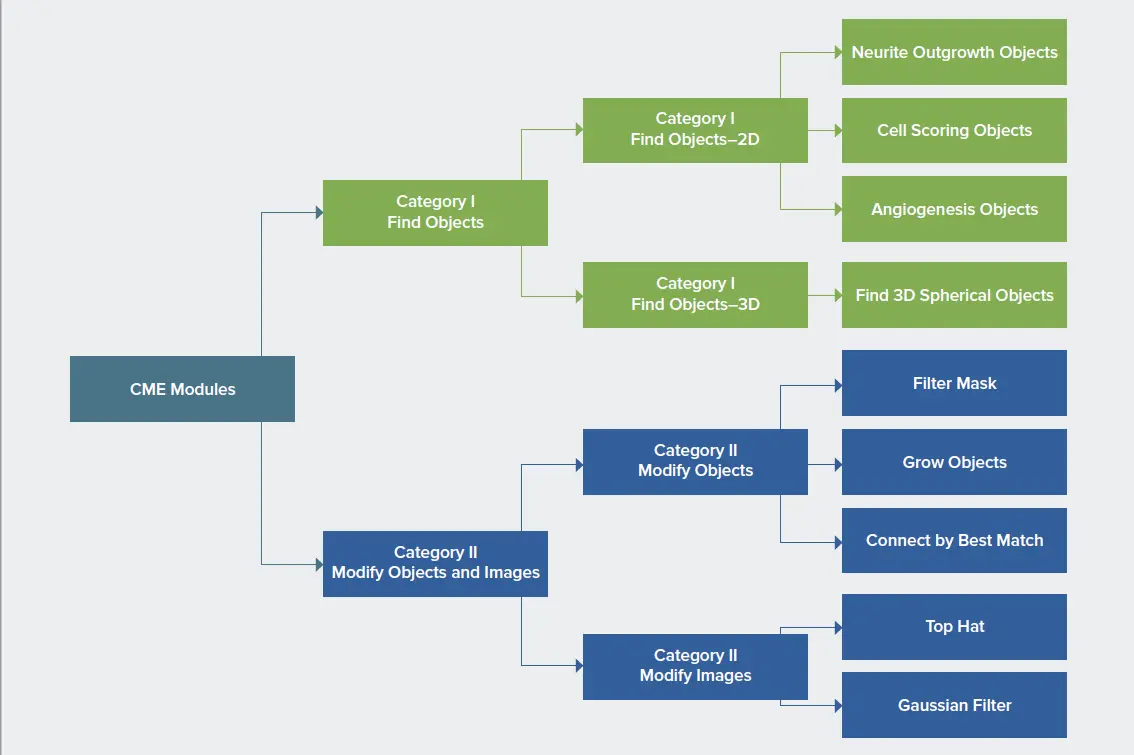
図1. CMEモジュールの分類。
神経突起伸長オブジェクトは、すべての細胞体と神経突起を識別するマスクを生成するために使用できる
神経突起と核のチャンネルを設定し、細胞体とアウトグロースの関連パラメータを指定することで、細胞体とアウトグロースの両方のマスクを生成した。
次に、個々の神経突起、細胞体、ノードをカウントするために、さらなる後処理が必要である。ノードとは、2つ以上の神経突起が交差している点と定義される。対物レンズと画像を修正するモジュールを使って、プロセスは3つのステップに分けられる。ステップ1では、shrink objectsモジュールを使って、アウトグロース用のラインマスクを除去し、残ったセルボディ用のマスクを残した(図3A-3B)。ステップ2、subtractモジュールを使って、元の全体マスクから 生成されたセル体マスクを除去し、残りのアウトグロース用 マスクを残した。ステップ3、簡単なアプローチとして平均フィル タリングを使い、ノードがラインより相対的に高いピクセ ル値を示すノードのマスクを作成した(図3C-3D)。ステップ4では、ステップ2で得られたアウトグロースのマスクからノードを除去した(図3E-3)。残ったのは、計数に使用した個々のアウトグロースラインである。
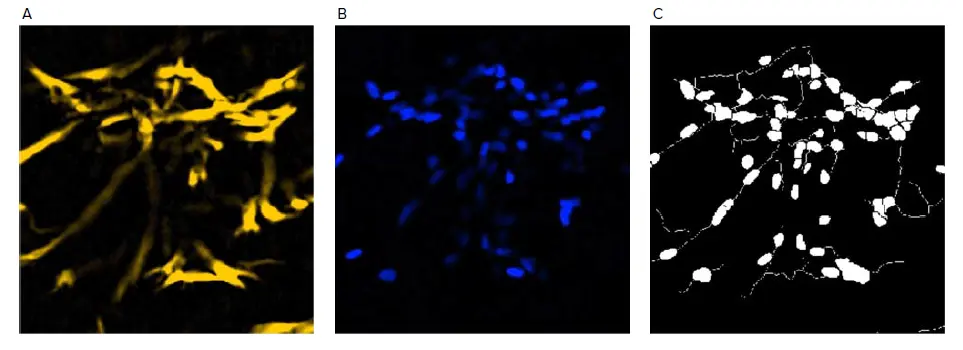
図2. 神経突起伸長解析の例。A) 微小組織のチューブリン染色は神経突起チャンネルとして使用され、細胞体についてはおおよその最大幅、ローカルバックグラウンド以上の強度、最小面積が指定されている。さらに、アウトグロースについては、おおよその最大幅、ローカルバックグラウンド以上の強度、有意とみなす最小の細胞アウトグロースが指定されている。B) 微小組織のDAPI染色は核チャンネルとなり、おおよその最小幅、おおよその最大幅、ローカルバックグラウンド以上の強度が指定されている。

図3. 個々の細胞体と個々の神経突起伸長を識別するために生成されたマスク。A) モジュール神経突起伸長オブジェクトから生成された全体マスク。B) shrink objectsモジュールを使ってA)のラインマスクを除去して作成した細胞体のマスク。C) subtractモジュールを使ってマスクA)からマスクB)を除去してラインマスクのA)のボックス領域を拡大したもの; D) 平均フィルタモジュールを用いてノードの位置を特定したもの。E) マスクC)からノードを除去して個々の神経突起伸長マスクの領域を拡大したもの。
細胞体、神経突起、神経節のカウントと神経突起の長さの測定
ベストマッチモジュールによりセルボディ、神経突起、ノードの3D対物レンズを作成し、ウェルあたりのセルボディ数、神経突起数、ノード数をそれぞれカウントした。図4Aおよび図4Bに示すように、セルボディ数に対する神経突起数の線形回帰は、セルボディあたり平均1.97個の神経突起を示し、ノード数に対する神経突起数の線形回帰は、ノードあたり平均2.62個の神経突起を示した。この線形関係は、CMEから生成した解析アルゴリズムのロスト性と一貫性を示している。図4Cでは、オルガノイドの体積は、予想通りすべての神経突起の全長と直線的な関係を示している。
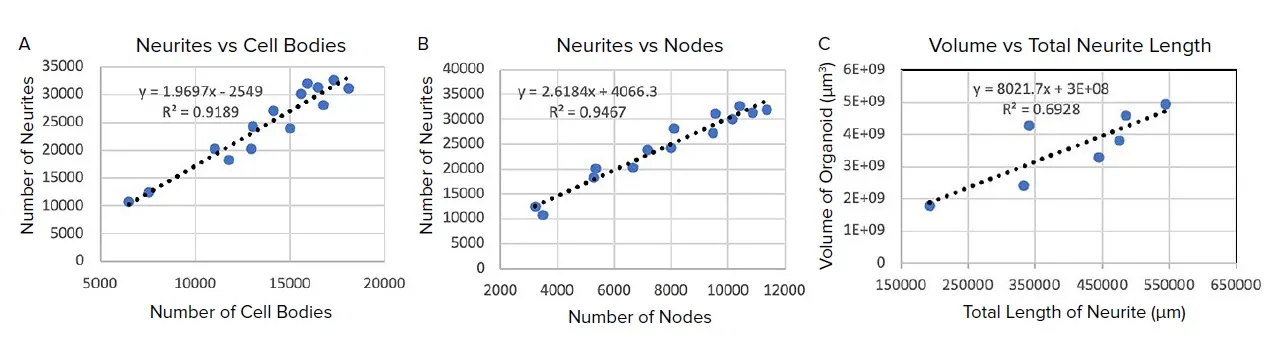
図4. B) オルガノイドあたりの神経突起の数とオルガノイドあたりの細胞体の数を示すグラフ。C) オルガノイドの体積とすべての神経突起の全長を示すグラフ。
ヒト脳微小組織の3D可視化
脳微小組織の3D可視化は、3D再構成ツールを使って再構築することができる。このツールを使えば、構造を回転させたり、さまざまな角度から見たりすることができ、再構成した画像を動画形式にエクスポートすることもできる。図5に、3D再構成後の脳微小組織全体の画像を示す。
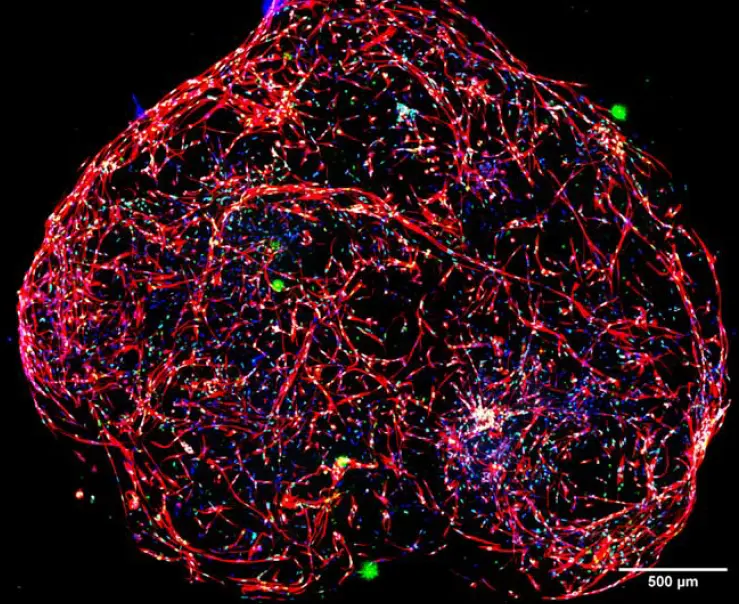
図5. MetaXpressの3D再構成ツールを用いた微小組織の3D再構成。赤: チューブリン、緑: SOX2、青:核
結論
- CMEのビルトインモジュールを活用し、対物レンズや画像の検索・修正、解析アルゴリズムのカスタマイズを行い、より深い知見を得ることができました。
- 異なるz層と波長チャンネルで撮影されたサンプルを、より情報量の多い3D脳モデルに再構成した。
- また、ヒトの脳の微小組織から神経突起、節、細胞体を解析するアルゴリズムを開発し、3Dモデルを再構築することにも成功した。
- ハイコンテントイメージャーと3Dヒト神経微小組織のこの革新的な組み合わせは、産業用医薬品スクリーニングプログラムにおいて、より大きなメカニズム的洞察を明らかにする大きな可能性を秘めている。
PDF版(英語)